重铬酸钾电催化合成进程表征研究
2010-12-25李成未张松平冯丽珍
李成未,李 珂,张松平,冯丽珍
(1.河南教育学院化学系,河南郑州 450046;2.郑州华信学院药学系,河南郑州 451100)
重铬酸钾电催化合成进程表征研究
李成未1,李 珂2,张松平1,冯丽珍2
(1.河南教育学院化学系,河南郑州 450046;2.郑州华信学院药学系,河南郑州 451100)
采用自制电合成反应器、多层金属氧化物复合阳极、不锈钢阴极、阳离子交换膜,阳极液为铬酸钾水溶液,阴极液为氢氧化钾水溶液,进行重铬酸钾电催化合成实验.从实验结果和电化学反应原理,说明可用宏观测定的工作电压随反应时间的变化来定量表征重铬酸钾电合成反应进程.讨论了工作电压随反应时间的变化关系,建立了工作电压随反应时间变化的数学模型和工作电压变化速率方程,所建模型满意地表征了重铬酸钾电催化合成进程.
重铬酸钾;电催化合成;工作电压;模型
重铬酸钾是铬化合物生产的重要起始原料,作为一个重要的无机化工产品,广泛使用于制三氧化二铬、铬黄颜料、电焊条、火柴、氧化剂、铬钾矾以及化学试剂,并供鞣革、电镀、钢铁钝化、有机合成等使用.其传统生产方法主要有复分解法、碳酸钾硫酸法、碳酸钾碳化法、苛性钾碳化法、霞石焙烧法、铬酸钾碳化法等[1].但这些方法都存在铬污染副产品、铬流失以及环境污染等缺点[2-3].本文采用一种绿色合成技术[4-6]——电催化法合成重铬酸钾,此法正在竞相研发阶段[2-3,7-12].该方法具有副产品氢氧化钾、氢气和氧气可回收利用的优点,可在温和条件下最大程度地实现目标反应的原子经济性和含铬副产品的零排放.本文从工程应用角度,研究了用工作电压的变化来表征重铬酸钾电催化合成进程.
1 实验
1.1 试剂、仪器及材料
试剂:铬酸钾,w(K2CrO4)≥99.5%,北京红星化工厂;氢氧化钾,w(KOH)≥92.0%,天津市化学试剂三厂;均为分析纯.阴、阳极液用水为高纯水,电导率≤1μS/cm.
仪器:H.H.-6型电热恒温水浴锅,常州市华普达教学仪器有限公司.44B型电解分析器,上海第二分析仪器厂.JJ型精密增力电动搅拌器,江苏金坛亿通电子有限公司.自制二室电解槽.
材料:Aciplex®-F4112型全氟羧酸/磺酸阳离子交换膜,旭化成公司.自制阴、阳极[10].
1.2 实验过程
实验在自制的二室电合成反应器中进行,二室内各装电动搅拌器气液冷凝分离器.二室中间是固定的Aciplex®-F4112阳离子交换膜,分置多层金属氧化物复合阳极和不锈钢阴极[10].反应器置于 H.H.-6型电热恒温水浴锅中,控温精度 ±0.1 K.实验开始时,在阳极室加入 350 mL给定浓度的铬酸钾水溶液,阴极室加入 350 mL、0.1 mol/L的 KOH溶液,在搅拌情况下,用恒温水浴锅控制反应温度,进行电流密度为 0.3 A/cm2的恒电流反应,用精密电位计测定合成反应过程的工作电压[2].
2 结果与讨论
重铬酸钾电催化合成反应是在直流电的作用下,阳极液中的钾离子以水合离子的形式通过离子膜转移至阴极室,水分子在阳极失去电子释放氧气,同时产生 H+,铬酸钾在 H+作用下转化为重铬酸钾;阴极液中水分子得到电子释放氢气,同时产生 OH-,与从阳极区迁移来的钠离子结合成为氢氧化钠溶液.电极反应如下:
阳极反应
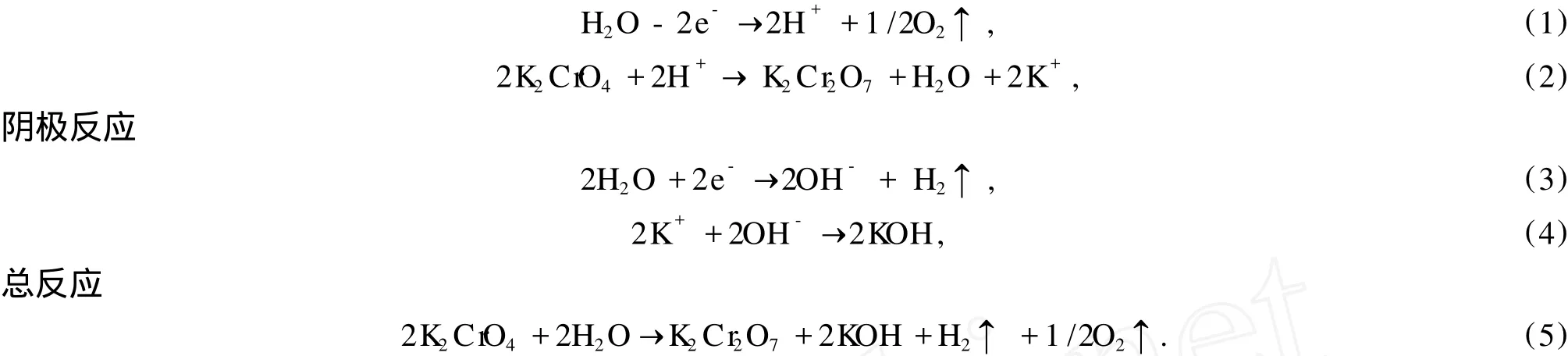
根据电化学反应原理,电催化反应器的工作电压取决于阴、阳极的平衡电极电位、过电位、工作电流、电解液电阻、膜材料电阻、阴阳极材料及其连接导线的电阻,即取决于电化学反应的热力学和动力学、电解质溶液的物理性质、反应过程的特性参数和电催化合成过程的电流效率[2].在反应装置确定的情况下,工作电压随反应时间的变化将取决于电化学反应进程.图 1、图 2显示了不同反应温度T、不同初始 K2CrO4浓度c0时,重铬酸钾电催化合成过程中工作电压E随反应时间t变化的实验数据.由图可知,反应开始阶段,有很短时间的工作电压较快上升,这是一个时间很短的活化诱导期.随着反应的进行,阴、阳极区发生水的氧化还原反应,阳极区析出氧气,阴极区析出氢气,水合钾离子通过阳离子交换膜逐渐迁移至阴极区,阳极液浓度增加,酸度加大,电阻增大,引起工作电压上升.反应接近终点时,阳极液浓度、黏度和酸度都变得很大,这些因素都是造成电解槽工作电压上升的内在原因[10],因此重铬酸钾电催化合成反应进程可用实验测得的电解工作电压的变化来定量表征.
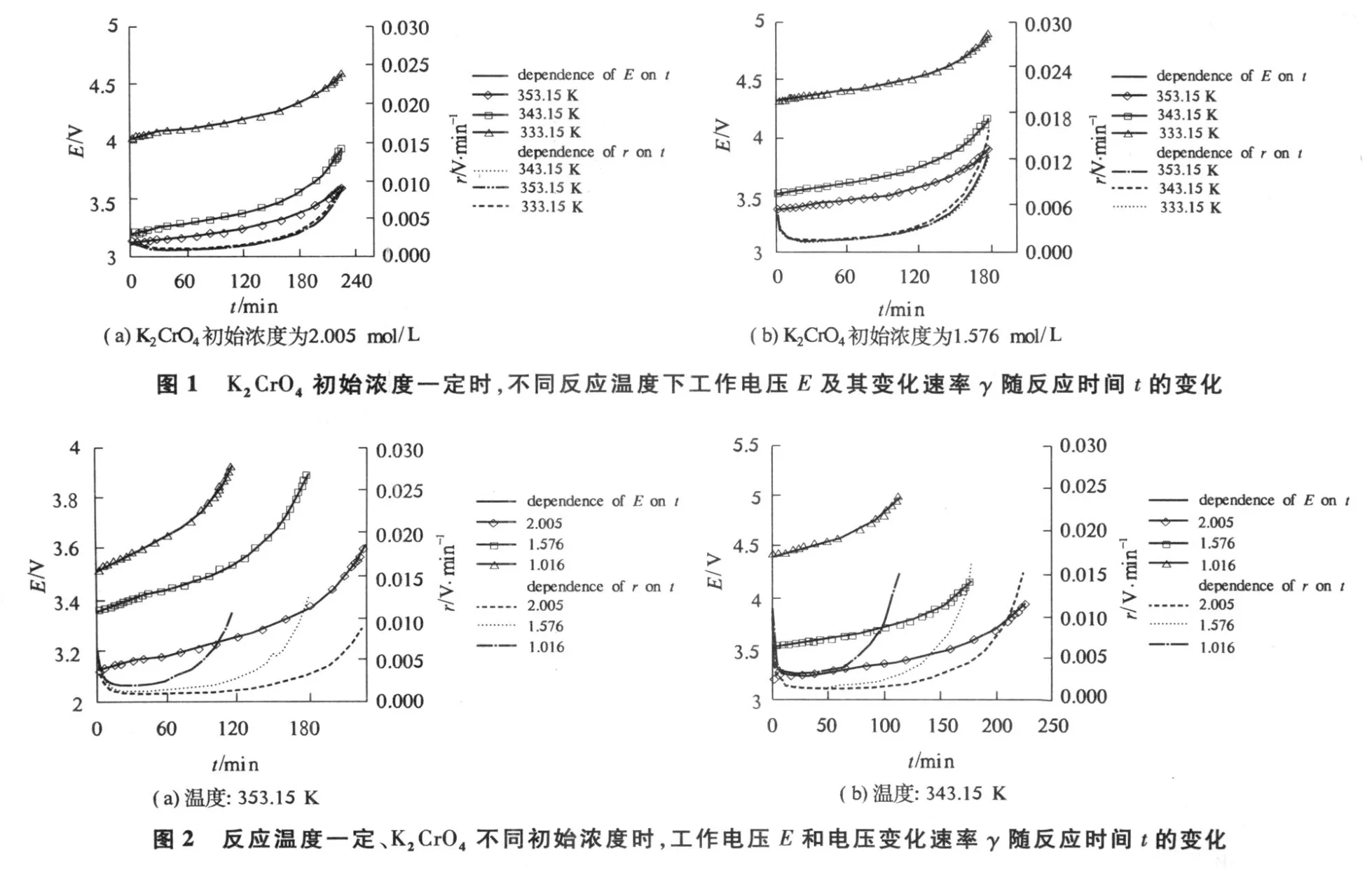
由图 1、图2看出,重铬酸钾电催化合成反应过程中,工作电压E与反应时间t之间有非常类似的变化关系,这种变化关系可用如下方程表征

式中a和b为模型参数,k为浓度函数.
式(6)中的模型参数a、b和浓度函数k可由实验数据按最小二乘法确定,结果列入表 1.用a、b、k的值,即可按模型(6)计算不同反应时间下的电解槽电压,计算值如图 1、图 2.计算值与实验值之间的平均相对误差(ARD)和标准误差(SD)列入表 1中.可以看出,由式(6)得到的电压计算值与实验数据误差较小,可以表征重铬酸钾电催化合成过程中工作电压的变化规律,反映了电催化合成进程,为重铬酸钾电催化合成工业化生产提供了理论依据.
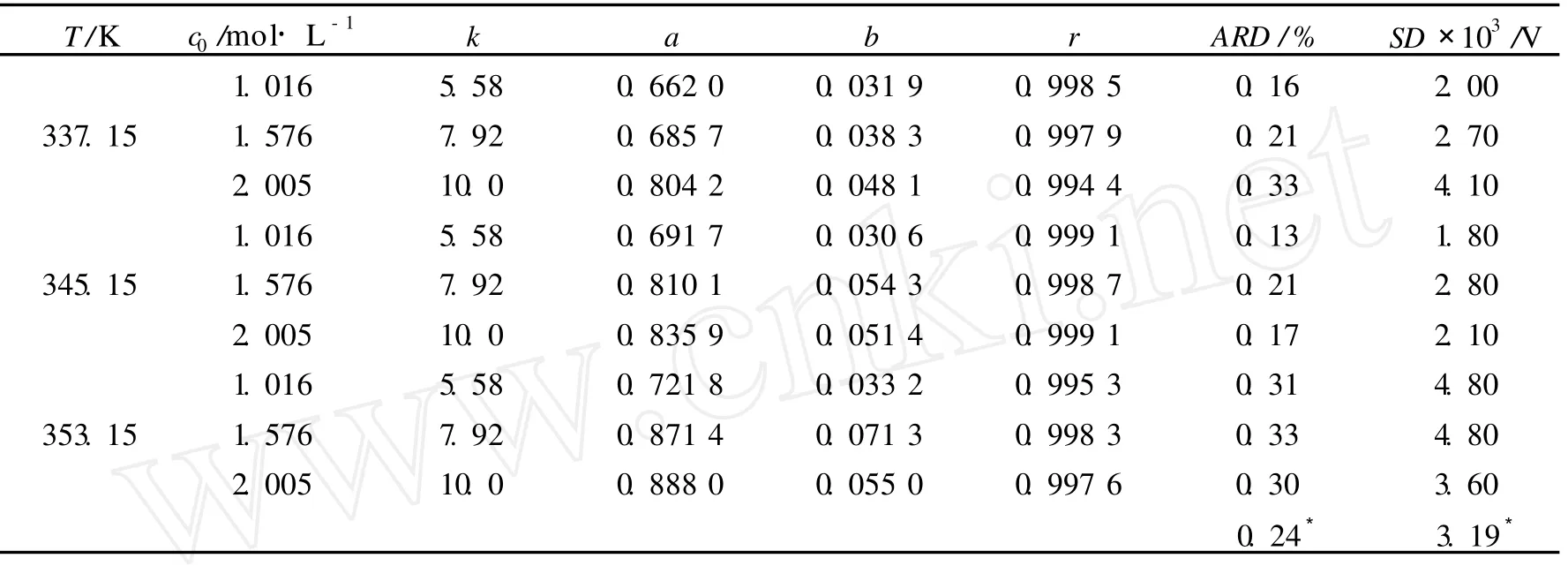
表 1 工作电压变化方程(6)中参数 a、b、k、相关系数 r和工作电压计算值与实验值相比较的 SD和ARD
从表 1中可以看出k值和温度无关,而随 K2Cr O4初始浓度c0增大而增大.可用式(7)计算

将模型(6)对反应时间t求导,可得工作电压E随时间t变化速率方程式

由式(8)即可计算工作电压变化速率,见图 1、图 2.由图可知,反应开始阶段,有很短时间的工作电压较快上升;之后电压缓慢上升,直到理论电解结束时间,这是正常反应的稳定区域;反应后期,随反应进行电压急剧上升,这表明反应已到终点.由以上反应现象看出,重铬酸钾的电催化合成反应进程中,首先进入一个很短的活化诱导期,诱导期之后,电催化合成反应正常进行,这些都可由测得的工作电压来表征.
3 结论
在自制二室电催化合成反应器中,实验测得不同温度、不同阳极液铬酸钾初始浓度下重铬酸钾电催化合成反应过程中不同反应时间下的电解槽电压.建立了电压随反应时间变化的数学模型及其变化速率方程,电压模型计算值与实验值相比较的 243个数据点的总标准误差和平均相对误差分别为 0.003 19 V和 0.24%.讨论了重铬酸钾电催化合成过程中电压随反应时间变化的内在电化学反应原因,表明重铬酸钾电催化合成反应进程可用宏观测得的电解槽电压随反应时间的变化来定量表征.
[1] 成思危,丁翼,杨春荣.铬盐生产工艺[M].北京:化学工业出版社,1988:282-299.
[2] 李成未,余志辉,齐涛,等.铬酸酐电合成过程中工作电压的变化[J].化工学报,2006,57(1):71-73.
[3] 李成未,齐涛,王福安,等.铬酸酐电化学合成中阳极液在钛基多元金属氧化物复合电极上的电化学研究[J].化工学报,2008,59 (3):670-672.
[4] WangLiucheng,Wang Fu’an.Solubility ofNiacin in 3-picoline+water from 287.65 to 359.15 K[J].Journal of Chemical&EngineeringData, 2004,49(1):155-156.
[5] HeWeichun,Wang Jianming,Shao Haibo,et al.Novel KOH electrolyte forone-step electrochemical synthesisof high purity solid K2FeO4:comparison with NaOH[J].Electrochemistry Communications,2005,7(6):607-611.
[6] Zhao Jianhong,WangLiucheng,Wang Fu’an.Solubilities of p-aminopheol in sulfuric acid+water+(methanol,ethanol,1-propanol,2-propanol,1,2-propanediol and glycerin,respectively)from(292.35 to 348.10)K[J].Journal of Chemical&Engineering Data,2006,51(2): 376-381.
[7] AhmedM I,Holsen TM,Selman J R.Electrochemical chromic acid generation processwith fuel-cell electrode assistance.Part I:removalof contaminants[J].Journal ofApplied Electrochemistry,2001,31(12):1381-1387.
[8] Wang Jiyan,Wang Fu’an,Zhang Peng,et al.Densities and viscosities of chromium trioxide+potassium chromate+potassium dichromate+ water from(298.15 to 333.15)K[J].Journal of Chemical&EngineeringData,2008,53(3):648-653.
[9] Wang Fu’an,Wang Jiyan,Zhang Peng,et al.Measurement and modeling of refractive indices formulticomponent chromium compound solutions [J].Chemical Engineering and Technology,2008,31(3):426-432.
[10]Li Chengwei,Qi Tao,Wang Fu’an,et al.Variation of cell voltage with reaction time in electrochemical synthesis process of sodium dichromate [J].Chemical Engineering and Technology,2006,29(4):481-486.
[11]Li Chengwei,Qi Tao,Wang Fu’an,et al.Macrokinetic study of the electrochemical synthesis process of sodium dichromate[J].Chemical Engineering and Technology,2007,30(4):476-473.
[12]Li Chengwei,Wang Fu’an,Qi Tao,et al.Apparent kinetics for electrosynthesisprocess of chromic acid[J].Chemical Research in Chinese Universities,2009,25(4),532-536.
On Characterization in Electro-Catalysis Synthesis Process of Potassium D ichromate
L ICheng-wei1,L I Ke2,ZHANG Song-ping1,FENG Li-zhen2
(1.Department of Chem istry,Henan Institute of Education,Zhengzhou450046,China;2.Department of Phar macy,Zhengzhou Huaxin College,Zhengzhou451100,China)
A self-made electrosynthesis reactor,with a multiple-unitmetal oxides combination anode,a cathode of stainless steel,and a cation exchange membrane were used to carry out the electro-catalysis synthesis experiment of potassium dichromate from potassium chromate.The anolyte was potassium chromate solution,and the catholyte was potassium hydroxide solution.From the experimental results and the principle of electrochemical reaction,it was found that the process of electrochemical synthesis reaction of potassium dichromate might be quantitatively evaluated by the dependence of operating voltage on reaction time.The variation of operating voltage with reaction time was discussed.The math model of the dependence of operating voltages on reaction t ime and the change rate equation of operating voltage were upbuilt.The model satisfactorily characterizes the electro-catalysis synthesis process of potassium dichromate.
potassium dichromate;electro-catalysis synthesis;operating voltage;model
TQ131.1+3
A
1007-0834(2010)04-0025-04
10.3969/j.issn.1007-0834.2010.04.009
2010-10-28
河南省教育厅自然科学研究计划项目(2009B530004)
李成未(1966—),男,河南兰考人,河南教育学院化学系教授,工学博士,研究方向:绿色化学与清洁生产.
