关于化学反应热效应理论和量热技术的教学研究
2010-12-13张志红
刘 浪 张志红
(1.新疆大学化学化工学院 新疆 乌鲁木齐 830046; 2.昌吉学院化学与应用化学系 新疆 昌吉 831100)
关于化学反应热效应理论和量热技术的教学研究
刘 浪1张志红2
(1.新疆大学化学化工学院 新疆 乌鲁木齐 830046; 2.昌吉学院化学与应用化学系 新疆 昌吉 831100)
化学反应热效应和量热技术是大学一年级无机化学课程的重要教学内容,大部分无机化学教材对这部分内容阐释得过于简单。本文以本科无机化学原理为基础,对化学反应热效应的相关规定及其意义、热化学原理在热效应测量技术中的体现和应用进行深入讨论,以期对教师教学有所启发,对学生深入理解相关的理论知识和实验技术有所裨益。
化学反应热效应;量热技术;教学研究
化学反应伴随吸热或者放热现象在自然界是普遍存在的,但科学地定义和测量化学反应热效应却并非简单的事情。化学反应热效应和量热技术是大学一年级无机化学课程的重要教学内容,目前国内大部分无机化学教材对这个看似简单的问题阐释得过于简单,使一部分学生到大三时对这个问题的认识和理解仍然停留在中学水平上。本文在不超越本科无机化学基础理论的前提下,对这部分教学内容中容易被忽视和常使学生感到困惑的几个问题进行深入讨论,以期能够对教师教学有所启发,对学生深入理解相关的理论知识和实验技术有所裨益。
一、化学反应热效应的含义
中学化学教材将化学反应热效应简单地定义为“化学反应吸收或放出的热”。大学无机化学中首先明确热的定义:“由于系统和环境的温度差引起的能量传递形式”。热不是系统的性质,它不对应于某个状态,而对应于一个变化过程。它不但与始、终态有关,还和变化的途径有关。有些书上把热和功称为途径函数 (path function),以示与状态函数 (state function)之区别[1]。如在常温常压下,氢氧燃料电池工作时所放出的热,与相同量的氢气和氧气燃烧所放出的热不相同 (前者对环境做电功,后者对环境做体积功,二者数量也不相同),是对上述结论的一个例证。由于热不是状态函数,在明确了反应物 (始态)和反应产物(终态)的情况下,“化学反应吸收或放出的热”并不是一个确定的值。如果对化学反应热效应的测量基本原则不作统一规定的话,对同一个化学反应,可以给出不同、但都是“正确”的测量结果(如上例)。因此,严格说中学对化学反应热效应的定义是不严谨的。热化学中,对化学反应热效应的定义,其实就是对其测量基本原则做了统一的规定。下面我们对这些规定及其意义进行讨论。
规定一:封闭系统
热化学的理论基础是热力学第一定律,其数学表达式为:
由此可以得出等容热效应Qv和等压热效应Qp的两个重要关系:

应当注意,第一定律的数学表达,把导致系统内能变化的原因,归结为系统与环境之间以热和功这两种形式的能量交换,排除了由于系统与环境之间物质交换而导致系统内能的变化,因此(1)式只能适用于封闭系统,(2)和(3)式也只在封闭系统中成立,当用△U和△H来表示化学反应的等容热效应和等压热效应时,热效应的测量必须规定封闭系统。这一点在国内大多数的无机化学和大学化学教材中都没有明确地指出①,学生也很容易忽视,应当引起注意。
规定二:不做非体积功
根据第一定律的数学表达式(1),在等容(体积功等于零)和不做非体积功条件下,总功W=0,则得到(2)式;在等压(P1=P2=P3=constant)和不做非体积功条件下,可得到 (3)式。由此看出,当用△U或者△H表示化学反应的等容或者等压热效应时,其实就引入了“不做非体积功”规定。
规定三:等容或者等压
如上所述,在封闭系统、不做非体积功和等容或者等压三个规定的前提下,有(2)和(3)式成立。即尽管热不是状态函数,但是在满足这些条件下,化学反应热效应 Qv或 Qp,在数量上等于状态函数 U或者 H的变量,其数值只取决于反应物 (始态)和反应产物 (终态)。如果使一个化学反应的等容热效应QV或等压热效应Qp均具有唯一的数值,必须要明确始终态。
规定四:反应前后温度相等
以合成氨反应为例

始态,系统中有 0.5mol的N2和 1.5mol的 H2,气体物质的量 n=2mol。为简便,假设气体是理想气体,则根据理想气体状态方程 pV=nRT,如果只规定系统的体积V,则系统的压力 p和温度 T不确定,即系统的状态不确定;如果只规定系统的压力 p,则系统的体积V和温度 T不确定,系统的状态也不确定。对终态也可以得出相同的结论。显然,如果再规定反应前后的温度,则反应前后系统的状态将会被唯一地确定,这时,一个化学反应的Qv和Qp就会有唯一确定的值。理论上,反应前和反应后的温度可以规定为任意的合理值,在热化学中,规定反应前后温度相等。我们常说的 298.15K时某化学反应的热效应,其含义是反应物和反应产物的温度都是 298.15K。
综上,将化学反应热效应简单地理解为“化学反应吸收或放出的热”是不够严谨的。在化学反应热效应的定义中,给出了上述四个限制条件,使得热效应成为某温度和压力下化学反应本身的性质,从理论上排除了人为原因造成同一个反应在相同的温度和压力下具有不同热效应数值的可能。
另外,还需要特别指出的是,热效应数值对应于按热化学方程式所发生反应的物质的量,即反应进度为 1mol。例如对于合成氨反应

并不是说标准压力下,0.5mol的氮气和 1.5 mol的氢气混合反应,就能释放出 294.1kJ的热,因为该反应不能进行完全,这时得不到 1mol氨气。这个热化学方程式的真正含义是,标准压力下,在一个更大的反应系统中(氮气和氢气的量远远大于 0.5和 1.5mol),有 0.5mol的氮气和 1.5mol的氢气转化为1mol氨气,放热 294.1kJ。
二、热效应的测量
大多数无机化学教材通过绝热式量热计来介绍化学反应等容热效应的测量原理。图 1是量热计构造示意图,测定时置于绝热环境中。
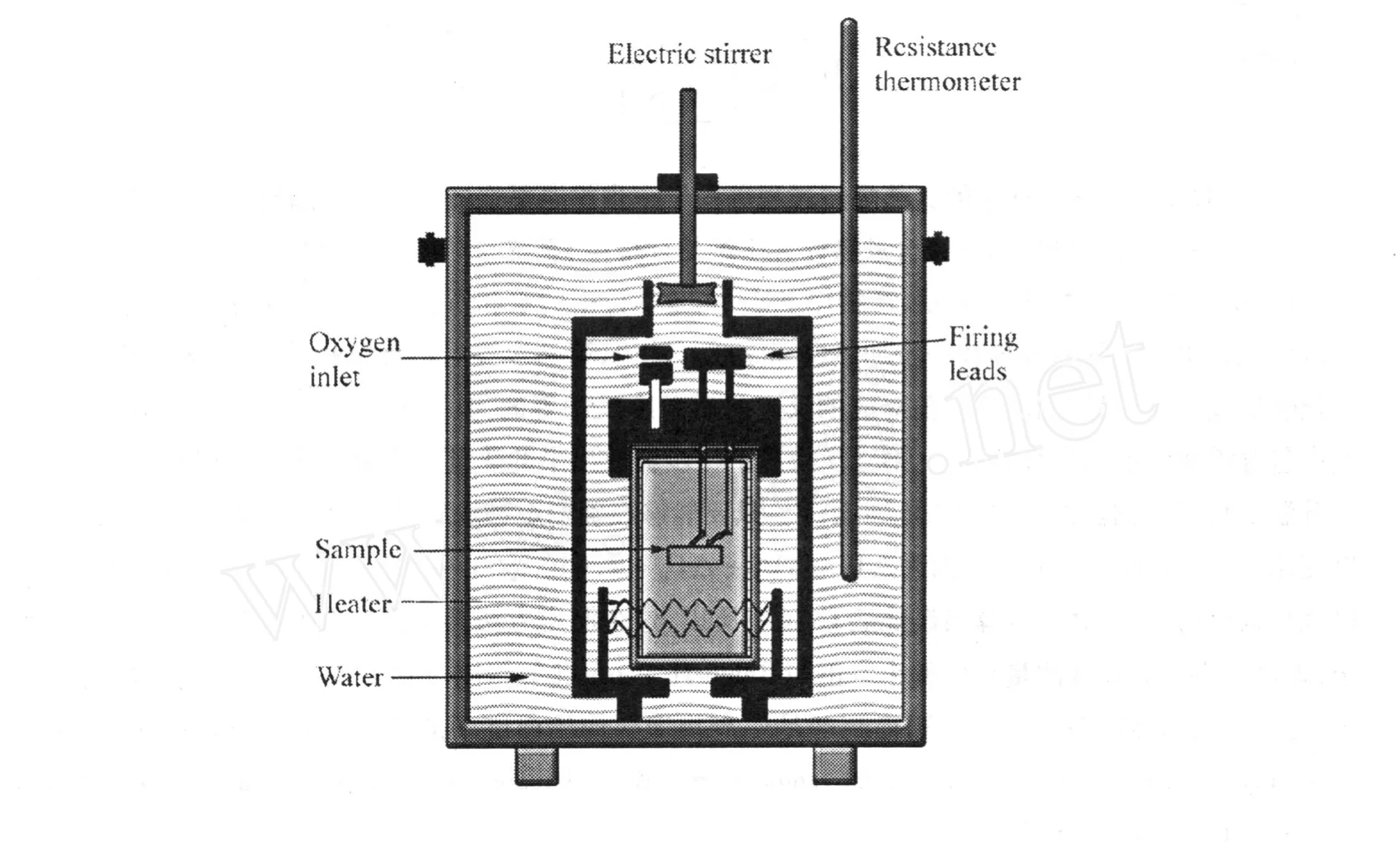
图 1 等容弹式量热计构造
氧弹中充入高压氧气,固体样品被压成片后通过点火铁丝引燃,样品和铁丝燃烧放出的热使量热计升温,测定点火前后量热计温度的变化值,可以计算样品等容燃烧热QV。计算方法如下:

式中,m为待测物质的质量(g);M为待测物质的摩尔质量 (gmol-1);QV为待测物质摩尔等容燃烧热 (kJ mol-1);QFe为点火铁丝的燃烧热,数值为 6.649 kJ g-1;mFe为点火铁丝的质量 (g);△T为燃烧前后量热计内温度的变化值;c为量热计的热容(kJ K-1),它表示量热计每升高一度所需吸收的热量。量热计的热容常通过已知燃烧热的标准物(如苯甲酸)来标定,计算方法如下:

式中,ms、Ms、QV,s分别为标准物的质量、摩尔质量和摩尔等容燃烧热。△T′为标准物燃烧前后量热计温度的变化值。
在教学中学生常感到疑惑的是,这种测量方法并没有满足反应前后温度相等的要求。燃烧反应发生后,产物的温度比反应前升高了△T,如果使产物降温回到起始温度,还应当再放出一部分热。这种测量方法得到的结果是否比实际值偏小呢?

图 2 在量热计中的绝热燃烧过程等同于一步等温燃烧过程和一步加热升温过程
如图 2所示,以量热计为系统,量热计置于绝热环境中,系统与环境没有热和功的传递,燃烧反应过程△U=0。如果反应物用 R表示,产物用 P表示,量热计中的水和所有部件用 K表示,则燃烧反应过程可以设想成由一步等温过程和一步加热过程完成。其中,第一步等温燃烧过程的△U1等于样品和点火铁丝燃烧放出的热量总和,这个值对应的反应前后温度是相等的,其数值为△U1=(m/M)Qv+mFeQFe,其中包含需要测定的燃烧热QV。第二步是用第一步释放出来的热量加热量热计(包括反应产物),使系统升温△T,系统内能的变量为△U2=c△T。只要能够准确测定燃烧后量热计的热容 c和燃烧前后的温度变化△T,就能得到△U2值;因为△U=△U1+△U2=0,则△U1=-△U2,可得△U1值;扣除点火铁丝燃烧释放出的热量,就可以算出燃烧热QV值。所以,这个测定方法其实符合“反应前后温度相等”的规定,理论上讲不会导致测量结果偏小。正如 Ralph H.Petrucci等指出[2]:“在测量中,我们虽然没有使系统回到初始的温度,但是我们计算得到却是使产物回到初始温度下的热 (In actual practice,we do not physically restore the system to its initial temperature.We calculate the quantity of heat that would be exchange in this restoration.)”。
应当指出,量热计的热容 c是用已知热效应的标准物进行标定的,在标定和测定时,氧弹里物质的种类和数量可能是不一样的,因此我们并没有准确得到样品燃烧后量热计的热容 c,这对测量结果是有影响的。
量热计的热容其实是氧弹内的物质、量热计中所有部件和水的总热容。我们知道,水的摩尔热容是所有液体物质中最大的,在实验中,标定物和样品取用量大都不足 1g,量热计中加入的水一般都在 3kg左右,这样,水对量热计热容 c的贡献远远超过了氧弹里的物质和量热计中所有部件,氧弹内物质种类和数量的变化对量热计热容 c的影响不大,对测定结果影响是很小的。这个结论可以利用热化学数据计算验证,此处不再赘述。
如果在量热计中安装一个加热线圈 (见图 1),样品燃烧后量热计的热容 c也是可以精确标定的。样品燃烧结束后,我们得到了△T值。把量热计从绝热环境中取出冷却至点火前的温度附近,然后再置于绝热环境中。给加热线圈通电,测定量热计温度升高值△T″(△T″尽可能与△T相近),按下式计算量热计的热容 c
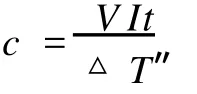
式中,V、I、t分别为电压、电流和通电时间,△T″为通电前后水温的变化值。
当然,如果在操作中使△T″=△T,可以根据△U1=-△U2=-V It直接求出△U1,从而求出燃烧热Qv。但是在实际中,温度测量的精度要求达到 0.002oC,我们很难做到使△T″和△T恰好完全相等。
此外,燃烧后量热计要先冷却至点火前的温度附近,电加热时还要使△T″尽可能与△T相近,这是因为任何物质的热容都不同程度地受温度影响,量热计的标定过程与样品的测定过程的温度以及温度的变化范围相近,可以使量热计在标定时和测定时的热容 c相近,减小实验误差。
三、结论
热化学是大学一年级无机化学课程重要的教学内容,也是一些后续专业课程的基础。许多学生只记住了对化学反应热效应的一些规定,却不理解这些规定的意义;只知道热交换是测定热效应的基本原理,却难以将热化学严密的理论与热效应测定的实验技术紧密结合起来。在教学中,教师在这些方面引导学生进行深入的探讨,不但有利于学生掌握相关的专业知识,对启发学生科学思维、培养科学方法也会起到积极地作用。
注释:
①见北京师范大学,华中师范大学,南京师范大学.无机化学 (上册第四版)[M].北京:高等教育出版社,2002: 212-218;王明华,徐瑞钧.周永生,张殊佳.普通化学 (第五版)[M].北京:高等教育出版社,2002:22-23;丁延桢,杨宏新,尉志武,蔡作乾.大学化学教程[M].北京:高等教育出版社,2003:70-71;郑能武,刘清亮,刘双怀.无机化学原理[M].安徽:中国科学技术大学出版社,1988:12-16.
[1]PeterAtkins,Julio de Paula.Atkins’Physical Chemistry(Seventh edition影印版)[M].北京:高等教育出版社, 2006:73.
[2]Ralph H.Petrucci,W illiam S.Har wood,F.Geoffery Herring.General Chemistry-Principles and Modern Applications(Eighth edition影印版)[M].北京:高等教育出版社,2004:227.
O64
A
1671-6469(2010)03-0081-05
2010-05-10
刘浪 (1973-),女,四川营山县人,新疆大学化学化工学院,副教授,博士,研究方向:材料化学。
(责任编辑:马海燕)
