氰化镀铜液中游离氢氧化钠的自动电位滴定
2010-12-08曾家民丘星初
丘 山,丘 圣,曾家民,丘星初
(1.中联环保科技开发有限公司,广东番禺 511483;2.江西环境工程职业学院,江西赣州341000)
氰化镀铜液中游离氢氧化钠的自动电位滴定
丘 山1,丘 圣2,曾家民1,丘星初1
(1.中联环保科技开发有限公司,广东番禺 511483;2.江西环境工程职业学院,江西赣州341000)
研究了氰化镀铜溶液中,用自动电位滴定法测定氢氧化钠的条件和方法。实验结果表明,以pH复合电极为指示电极,设定滴定终点为pH=11.4时,共存的氰化钠、酒石酸钠及碳酸钠不干扰测定。操作简便快捷,7 min内能打印出分析结果。
游离氢氧化钠;自动电位滴定法;氰化镀铜溶液
Automatic Potentiometric Titration for Determing Concentration of Free Sodium Hydroxide in Cyanide Copper Plating Bath
引 言
氰化镀铜液中氢氧化钠质量浓度的测定,最常用的是以酚酞为指示剂的盐酸滴定法[1],该法需用硝酸银消除氰化物的干扰,碳酸钠也需用氯化钡除去,测定操作繁复冗长;此外,滴定终点也较难观察。本文采用自动电位滴定法,免除了中和滴定的弊端,而且简便快捷。
1 仪器和试剂配制
ZDJ-4A型自动电位滴定仪(上海精密科学仪器有限公司出品)。与仪器相匹配的计算机和打印机。
T-818-B-6型参比电极;
E-201D型pH复合电极;
20 ml滴定管。
碳酸钠标准溶液:称取在270~300℃干燥至质量恒定的基准无水碳酸钠1.000 g溶于水中,移入100 mL容量瓶,加水定容,混匀。此溶液每毫升含碳酸钠10.00mg。相当于氢氧化钠7.547 88mg。
(0.1 mol/L)盐酸滴定液:移取浓盐酸9 mL,加水稀释至1 000 mL,混匀,备用。
2 测定步骤
2.1 盐酸滴定液的标定
准确吸取碳酸钠标准溶液10.00 mL于反应杯中,加水25 mL,投入搅拌珠,设定 n为 40~50 r/min,设定预控点的pH为5.0,滴定终点的pH为4.0,自滴定开始至听到仪器长鸣声提示后,结束滴定。记录消耗滴定剂的体积(V标)。盐酸对氢氧化钠的滴定度T按下式计算。

2.2 样品溶液的滴定
准确吸取冷却至室温的氰化镀铜溶液5.00 mL(或稀释10倍后的溶液5.00 mL)于反应杯中,加水25 mL,设定预控点为 pH=12.0,滴定终点 pH=11.4,按上述步骤滴定,记录滴定剂消耗的毫升数V样。按下式计算分析结果。

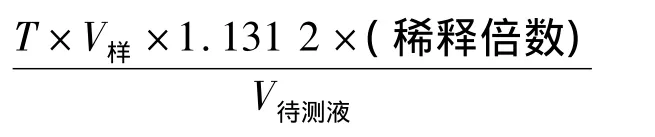
式中:V为待测氰化镀铜溶液消耗盐酸滴定液的体积,mL;T为盐酸对氢氧化钠的滴定度;0.884为校正系数。
3 结果和讨论
3.1 滴定终点pH的选择
滴定终点pH的选择是实验成败的关键。从氰化镀铜溶液的化学组成来看,除氢氧化钠之外,尚有游离的氰化钠(一般为15~23 g/L)和酒石酸钠,此外还有在电镀生产过程中镀液吸收空气中的CO2而生成的碳酸钠,这些强碱弱酸盐的共存,都影响到氢氧化钠的测定,其中最弱的酸为氰氢酸,其Ka=7.2 ×10-10(或pKa=9.14[2])。因此氰化钠溶液水解的pH可按下式[3]作近似计算。

式中:pKa=9.14,c(NaOH)一般不超 0.4 mol/L。代入上式,可得

实验测得10 g/L的碳酸钠溶液的pH=11.07。因此,将滴定终点设定在 pH=11.4 时,氰化钠和碳酸钠的共存将不干扰氢氧化钠的滴定。因而也不需分离氰化物和碳酸盐,这就大大简化了分析手续。
但当滴定终点设在pH=11.4时,盐酸滴定氢氧化钠的反应并未达到等当点,实际上只进行到88.4%时滴定就结束了。这可从图1的实验看到,还可以从滴定曲线证实,电位突跃明显(滴定曲线略),表明本分析方法可靠。故在分析结果计算时除以系数0.884。

图1 终点pH对滴定的影响
3.2 滴定剂浓度的选择
在实际的电镀生产中,电镀工件的基体不同对氢氧化钠质量浓度的要求不同。如电镀锌基铸件时,游离氢氧化钠仅为1~3 g/L,而镀件为铁工件时,氢氧化钠可调高至10~30 g/L。两者相差10倍。为了保证滴定的准确度,选用滴定剂的浓度为0.1 mol/L,在滴定低浓度氢氧化钠时,取镀液原液直接滴定;而在滴定高含量氢氧化钠时,则将镀液稀释10倍后进行。
3.3 滴定时搅拌速度的选择
实验结果表明,盐酸与氢氧化钠的反应速度较快,反应时中速搅拌即可。设定搅拌的转速以40~50 r/min为宜。在此条件下,每次滴定时间在7 min以内。
3.4 滴定初始体积的选择
滴定时电极的探头必须浸没在被滴定的试液中,同时搅拌珠的旋转又不能触及探头,以免碰伤电极。因此滴定的初始体积设定为30 mL,如试液量不足30 mL,则加水补足至30 mL。方可开始滴定。
3.5 精密度和加标回收率
氰化镀铜溶液样品8次重复测定ρ(NaOH)分别为:10.66、10.61、10.68、10.62、10.56、10.63、10.64、10.62 g/L,ρ平均(NaOH)为 10.628 g/L;标准偏差S=0.036;相对标准偏差=0.336%。
在含氢氧化钠50.138mg的镀液中分别加入标准氢氧化钠50.08 mg,测得回收率分别为100.6%、100.2%、99.5%、99.7%、100.6%、103.46%、99.8%、100.2%,回收率的平均值为 100.2%。
4 结论
本实验研究了氰化镀铜溶液中,在氰化钠和酒石酸钠及碳酸钠的共存下测定游离的氢氧化钠含量,方法操作简便快捷,有较高的准确度和精密度。
[1]徐红娣,邹群.电镀溶液分析技术[J].北京:化学工业出版社,2003.70.
[2]丘星初.化学分析手册[M].北京:化学工业出版社,1960:435.
[3]J.A.迪安.分析化学手册[M].常文保译,北京:科学出版社,2003:3-4.
TG115.31
B
1001-3849(2010)12-0040-04
2010-08-02
2010-08-25
