离子液体/凝胶聚合物电解质的制备及其与LiFePO4的相容性
2010-12-05崔闻宇安茂忠杨培霞
崔闻宇 安茂忠 杨培霞
(哈尔滨工业大学化工学院,哈尔滨 150001)
离子液体/凝胶聚合物电解质的制备及其与LiFePO4的相容性
崔闻宇 安茂忠*杨培霞
(哈尔滨工业大学化工学院,哈尔滨 150001)
以1-甲基-3-乙基咪唑六氟磷酸盐(EMIPF6)、聚偏氟乙烯-六氟丙烯(P(VDF-HFP))和六氟磷酸锂(LiPF6)为原料,采用溶液浇铸法制备了离子液体/凝胶聚合物电解质(ILGPE).通过循环伏安(CV)、计时电流法、恒流充放电、电化学阻抗法(EIS)研究了该电解质的离子传输特性以及与锂离子电池正极材料LiFePO4的相容性.结果表明,离子液体/凝胶聚合物电解质的室温电导率为1.650×10-3S·cm-1,电化学稳定窗口达到5.0 V.在充放电循环过程中,电极表面形成的钝化膜改善了锂离子脱、嵌可逆性和电极/电解质的界面性质.
锂离子电池;离子液体/凝胶聚合物电解质;EMIPF6;正极材料;相容性
目前,锂离子电池电解液多为液态有机溶液,常用的有机溶剂包括乙烯碳酸酯(EC)、丙烯碳酸酯(PC)、碳酸二甲酯(DEC)等[1].但是这些有机溶剂都是易燃物质,并且液态电解液存在漏液的危险,因此在滥用条件下,如加热、过充、过放、短路、振动、挤压等易导致着火、爆炸乃至人员受伤等事件[2].而聚合物电解质具有不漏液、比能量高、安全性好等优点,对于开发安全性高、绿色环保的锂离子电池电解质体系具有重大意义,但是较低的室温电导率制约了其进一步发展.
离子液体,通常是指由有机阳离子与无机或有机阴离子组成,在室温下呈液态的物质[3].由于离子液体具有非挥发性、蒸汽压低、导电性好、电化学稳定窗口宽、热稳定性好等诸多优点[4],自20世纪70年代末首次作为电池的电解质使用以来受到越来越多的关注.将离子液体引入聚合物电解质,以期得到不挥发、室温电导率高、安全性好的电解质的设想更是引起了人们的极大兴趣.Fuller等[5-6]首先将这种设想应用于离子液体/凝胶聚合物电解质的制备,此后在该电解质方面展开了广泛的研究.据目前文献报道,离子液体/聚合物电解质多数采用聚氧乙烯(PEO)、聚偏氟乙烯(PVDF)及其共聚物聚偏氟乙烯-六氟丙烯[P(VDF-HFP)]这两大类聚合物为基体.以PEO为基体,分别引入离子液体N-甲基-N-丙基吡咯-二(三氟甲基磺酰)亚胺(PYR13TFSI)[7]、N-甲基-N-丙基吡咯-二(三氟甲基磺酰)亚胺(PYR14TFSI)[8]、1-甲基-4-丁基吡啶-二(三氟甲基磺酰)亚胺(BMPy-TFSI)[9],成功得到了离子液体/凝胶聚合物电解质.但其室温电导率并不理想,未达10-3S·cm-1数量级,从而限制了上述PEO基离子液体/聚合物电解质的应用范围;另一方面,PVDF[10]或P(VDF-HFP)[11-12]聚合物基体常与咪唑类离子液体组合制备离子液体/聚合物电解质,由于其室温电导率可达10-3S·cm-1数量级而吸引了众多研究者的目光.研究人员分别采用1,2-二甲基-3-N-丁基咪唑(DMBITFSI)[13]、1-甲基-3-乙基咪唑四氟硼酸(EMIBF4)[14]、1-甲基-3-丁基咪唑六氟磷酸(BMIPF6)[14]咪唑类离子液体成功制备了PVDF基或P(VDF-HFP)基-离子液体/聚合物电解质.然而,多数研究仅局限于探讨PVDF基或P(VDF-HFP)基-离子液体/聚合物电解质本身的离子传输,电化学稳定窗口等性能,而对此类电解质与电极材料的相容性问题却很少关注,此类离子液体/凝胶聚合物电解质在锂离子电池中的成功应用更是鲜有报道.
本文以价格低廉、结构简单的离子液体1-甲基-3-乙基咪唑六氟磷酸(EMIPF6)(结构式如图1所示)、聚合物P(VDF-HFP)、锂盐LiPF6为原料,采用溶液浇铸法制备了离子液体/凝胶聚合物电解质,并通过添加EC/PC增塑剂改善了离子传输特性和电化学稳定窗口.同时还考察了LiFePO4与该电解质体系的相容性,以及室温下Li/LiFePO4电池在该电解质体系中的电化学循环性能.

1 实验
1.1 离子液体/凝胶聚合物电解质的制备和表征
电解质制备过程中使用的原料为:聚偏氟乙烯-六氟丙烯[P(VDF-HFP)](分析纯,Mw=500000, Aldrich),1-甲基-3-乙基咪唑六氟磷酸盐(EMIPF6) (分析纯,上海成捷化学有限公司),六氟磷酸锂(LiPF6)(分析纯,上海成捷化学有限公司),磷酸亚铁锂(LiFePO4)(电池级,浙江长兴瑞科电源新材料有限公司),N-甲基吡咯烷酮(NMP)(分析纯,德国默克公司).
离子液体/凝胶聚合物电解质的制备过程如下:将一定量的P(VDF-HFP)溶于NMP中,搅拌6 h,然后加入LiPF6和EMIPF6,继续搅拌12 h后得到均匀透明的凝胶液.称取适量的凝胶液置于聚四氟乙烯(PTFE)模具中,真空90℃干燥24 h,脱模后得到弹性自撑的透明离子液体/凝胶聚合物电解质(ILGPE),并将其迅速转入充满氩气的手套箱中.将等质量的EC和PC混合均匀后滴加到电解质膜表面后待用(m(EC)∶m(ILGPE)=m(PC)∶m(ILGPE)=7.5%).
ILGPE电导率(σ)采用电化学阻抗(EIS)法测试,测试电池的结构为不锈钢/ILGPE/不锈钢.ILGPE的电化学稳定窗口采用线性扫描伏安(LSV)法测试,测试电池的结构为Li/ILGPE/不锈钢,扫描速率为10 mV·s-1,扫描电压范围0-5 V.ILGPE的锂离子迁移数(tLi+)采用电化学阻抗和计时电流相结合的方法进行测试,测试电池的结构为Li/ILGPE/Li.在计时电流法测试前后对ILGPE分别进行电化学阻抗测试,计时电流的测试时间为1000 s,脉冲电压为10 mV. ILGPE与金属锂的界面相容性采用电化学阻抗法测试,测试电池的结构为Li/ILGPE/Li.
1.2 电极制备和电池组装
电池的正极组成为80%(w,下同)LiFePO4、10%乙炔黑及10%PVDF,以NMP为溶剂混合均匀后,涂布在铝箔集流体上,真空120℃干燥24 h后冲切成圆形电极片(直径14 mm),极片经油压机压实,再经过真空80℃干燥12 h后放入充满氩气的手套箱中备用.以金属锂为对电极,离子液体/凝胶聚合物电解质为隔膜和电解质,组装成2025扣式电池并进行电池性能测试.
1.3 电池的电化学性能测试
电池的充放电截止电压为2.7-4.2 V,电容为0.1C.循环伏安(CV)测试的电压范围为2.7-4.2 V,扫描速率为0.1 mV·s-1.电池循环过程中的界面性质采用电化学阻抗法表征.
以上所有的电化学阻抗测试均在电化学分析仪(CHI604B,上海辰华仪器公司)上完成,测试频率范围为105-10-2Hz,振幅为5 mV.
1.4 电极形貌的表征
电池循环前后,电极的表面形貌采用扫描电子显微镜(SEM,Hitachi S-4800)进行表征.
2 结果与讨论
2.1 ILGEP的组成与性能的关系
本文制得的ILGPE膜厚度为145-150 μm,是透明、弹性自撑膜,其数码照片如图2所示.
表1为室温(25℃)下ILGPE膜的电导率、电化学稳定窗口以及锂离子迁移数.结果表明,离子液体的加入使得电解质的室温电导率和电化学稳定窗口均有所提高,当m(EMIPF6)∶m(LiPF6)=1∶1(ILGEP-2)时,电导率为1.295×10-3S·cm-1,电化学稳定窗口达到4.7 V.然而,进一步增加离子液体含量(ILGPE-3),电导率、电化学稳定窗口并没有随着离子液体含量的增加而提高,而是比ILGPE-2有所降低,这主要是由于离子液体含量的进一步增加导致了聚合物电解质膜的机械性能很差,难以形成弹性自撑膜,机械性能的下降造成了聚合物结构的破坏,从而破坏了离子传输通道.结果还表明,离子液体/凝胶聚合物电解质的锂离子迁移数随着离子液体含量的增加而降低,这与Shin等[8]的研究结果一致.对比ILGPE-2和ILGPE-4,探讨了增塑剂EC、PC对离子传输特性和电化学稳定窗口的影响.结果显示,EC、PC的加入提高了电解质的各项性能参数,其电导率、电化学稳定窗口、锂离子迁移数分别增加到1.650×10-3S·cm-1、5.0 V、0.547.这归因于EC、PC等碳酸酯类有机增塑剂具有较高的介电常数和相对较低的粘度[9,15].对比ILGPE-4、ILGPE-5和ILGPE-6可以发现,增塑剂含量对离子液体/聚合物电解质的室温电导率、电化学窗口以及锂离子迁移数影响甚微,故将增塑剂的含量确定为可以均匀分布于ILGPE的表面的最小用量,即ILGPE-4中的用量.
2.2 ILGPE与金属锂的界面稳定性
图3为Li/ILGPE-2/Li和Li/ILGPE-4/Li不同搁置时间后的电化学阻抗图.在图3(a)中,阻抗复平面图包括一个高频区的容抗弧和一条低频区斜线.对于Li/ILGPE-2/Li来说,咪唑类离子液体与金属锂发生反应[12],半圆弧的大小反映了离子液体与金属锂之间相互反应产生的电荷传递电阻.随着放置时间的延长,电荷传递电阻从最初的2500 Ω不断增大到15000 Ω以上,这说明离子液体与金属锂之间的界面很不稳定,反应不断进行,导致电荷传递阻抗不断增大.从图3(b)中可以发现,添加EC、PC之后的谱图发生了明显变化.其中,阻抗谱由两个半圆构成,高频区的半圆通常表示钝化膜,这说明加入的EC、PC在金属锂和电解质膜之间形成了钝化膜,从而在一定程度上抑制离子液体与金属锂之间的相互反应.其次,中频区的电荷传递阻抗要远远小于没有添加EC、PC的体系,并且存储7天以后,电荷传递电阻趋于稳定,这表示EC、PC形成的钝化膜有利于提高金属锂/电解质界面的稳定性.由于ILGPE-4的室温电导率、电化学稳定窗口、锂离子迁移数以及与金属锂的界面稳定性均最优,因此采用ILGPE-4进行后续的研究.

表1 离子液体/凝胶聚合物电解质组成与性能的关系(25℃)Table1 Relationship between the performance of ILGPEs and the compositions(25℃)

2.3 Li/ILGPE-4/LiFePO4的电化学性能


图4为Li/ILGPE-4/LiFePO4的循环伏安(CV)曲线.由图可知,锂离子在橄榄石结构的LiFePO4中的脱出/嵌入电压分别出现在3.67和3.25 V附近,这与该材料在常用的有机电解液中的脱/嵌锂电位[16]相一致,说明LiFePO4在该电解质体系下的电化学行为与有机电解液体系相一致.随着扫描循环次数的增加,氧化还原电位峰的位置并没有发生明显的变化,说明LiFePO4在该电解质体系下也具有较好的脱/嵌可逆性.
图5为Li/ILGPE-4/LiFePO4的充放电循环曲线.表2给出了相应的充放电数据.从图中可知,Li/ ILGPE-4/LiFePO4的首次充电平台大约为3.50 V,放电平台大约为3.34 V,这与循环伏安曲线中的脱/嵌锂电位接近.在第2次循环中,充放电平台略有变化.其中,充电平台增加到3.52 V,而放电平台略微下降至3.32 V.但是从第2次到第20次的充放电循环中,充放电电压平台几乎完全重合.由表2可知, Li/ILGPE-4/LiFePO4的首次充电容量为130.0 mAh· g-1,首次放电容量为116.5 mAh·g-1,库仑效率仅为89.6%.相对较低的首次库仑效率可能与首次充放电循环过程在电极表面形成钝化膜有关.随着循环次数的增加,库仑效率逐渐增大至99%以上.该现象说明经过首次循环之后,极片表面形成的钝化膜提高了电极/电解质界面的稳定性,从而使得锂离子脱/嵌的可逆性大大增加.

表2 Li/ILGPE-4/LiFePO4的充放电循环数据Table 2 Charge-discharge data of Li/ILGPE-4/LiFePO4


图6为Li/ILGPE-4/LiFePO4循环前后电极表面的SEM图像.充放电循环之前(图3a),电极表面的颗粒清晰可见,颗粒棱角分明.充放电循环之后,极片表面发生了明显变化,原先清晰可见的颗粒已经看不到,极片表面被一层钝化膜覆盖,这证实了图5中有关在电极表面形成钝化膜的推测.钝化膜覆盖在电极表面上,将颗粒之间的间隙填充,把活性颗粒连接起来,这在一定程度上减小了颗粒之间的接触电阻和电极/电解质的界面阻抗.
图7是Li/ILGPE-4/LiFePO4不同循环次数后的电化学阻抗图和等效电路图.利用图7(b)的等效电路图可以拟合得到充放电循环过程中相关参数的变化.在等效电路图中,Re表示电解质的电阻;CPE为恒相位角元件,通常容抗弧偏离标准电容时可以用它来代替;Rf表示钝化膜电阻,它的数值变化反应了钝化膜的变化情况;Rct表示电荷转移电阻;Zw表示由半无限扩散控制的Warburg阻抗.从图7(a)中可以看出,拟合数据和实验数据十分吻合,说明所用的等效电路可信度较高.表3是拟合得到的相关数据.从表中可以看出,在前3次循环过程中,Rf和Rct数值都逐渐增大,这说明钝化膜随着循环次数增加逐渐增厚,而钝化膜增厚也影响了锂离子的扩散,从而进一步影响了后续的电荷转移反应,使得Rct逐渐增大.到第10次循环时,Rf数值达到最大值353.5 Ω,并在后续的10次循环过程中基本保持在352 Ω附近不变,这说明经过10次充放电循环之后,钝化膜的生长达到稳定.此外,Rct数值从第10次之后呈逐渐减小的趋势,结合Rf的变化情况可知,这可能是由于在循环过程中,钝化膜的膜结构不断得到完善,使得钝化膜的离子传输性能有所提高,降低了离子传输阻力,进而使得电荷转移反应的阻力也随之降低,进而使得锂离子脱/嵌反应的活性增加[17],这与表2中放电容量随着循环次数的增加逐渐增加的结果相一致.
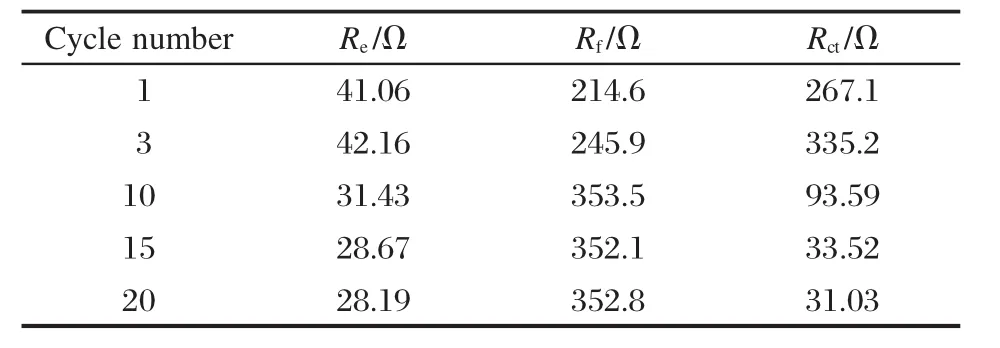
表3 电化学阻抗谱拟合结果Table 3 Fitting result of the electrochemical impedance spectrum
3 结论
采用溶液浇铸法制备了EMIPF6/P(VDF-HFP)离子液体/凝胶聚合物电解质,并对其进行了性能测试.结果表明,LiFePO4在该电解质体系中表现出较好的循环可逆性.电化学测试分析表明,在上述电解质中加入EC、PC添加剂,可以改善离子传输,增大电化学稳定窗口,在充放电循环过程中,电极表面形成了良好的钝化膜,从而改善了电极/电解质的界面性质和锂离子脱/嵌可逆性.综上所述,P(VDF-HFP)/ EMIPF6/LiPF6离子液体/凝胶聚合物电解质有望作为锂离子电池的优良电解质.
1 Appetecchi,G.B.;Dautzenberg,G.;Scrosati,B.J.Electrochem. Soc.,1996,143:6
2 Tobishma,S.I.;Yamaki,J.I.J.Power Sources,1999,81-82:882
3 Welton,T.J.Chem.Rev.,1999,99:2071
4 Zhang,Q.S.Foundations of organic synthesis reaction.Beijing: Higher Education Press,2004:1 [张青山.有机合成反应基础.北京:高等教育出版社,2004:1]
5 Fuller,J.;Breda,A.C.;Carlin,R.T.J.Electrochem.Soc.,1997,
144:L67
6 Fuller,J.;Breda,A.C.;Carlin,R.T.J.Electroanal.Chem.,1998, 459:29
7 Shin,J.H.;Henderson,W.A.;Passerini,S.Electrochem. Commun.,2003,5:1016
8 Shin,J.H.;Henderson,W.A.;Appetecchi,G.B.;Alessandrini,F.; Passerini,S.Electrochim.Acta,2005,50:3859
9 Cheng,H.;Zhu,C.;Huang,B.;Lu,M.;Yang,Y.Electrochim. Acta,2007,52:5789
10 Fortunato,R.;Branco,L.C.;Afonso,C.A.M.;Benavente,J.; Crespo,J.G.J.Membrane Science,2006,270:42
11 Sutto,T.E.J.Electrochem.Soc.,2007,154:P101
12 Sirisopanaporn,C.;Fernicola,A.;Scrosati,B.J.Power Sources, 2009,186:490
13 Ollinger,M.;Kim,H.;Sutto,T.;Piqué,A.Applied Surface Science,2006,252:8212
14 Jiang,J.;Su,G.Y.;Wang,Y.;Li,Z.H.;Gao,D.S.;Wang,C.W. Chinese Journal of Power Sources,2006,30:219 [蒋 晶,苏光耀,王 毅,李朝晖,高德淑,王承位.电源技术,2006,30:219]
15 Ye,H.;Huang,J.;Xu,J.J.;Khalfan,A.;Greenbaum,S.G. J.Electrochem.Soc.,2007,154:A1048
16 Atef,Y.S.;Hua,K.L.J.Alloy.Compd.,2009,477:498
17 Qi,Z.;Wu,F.Modern Chemical Industry,2004,24:40 [齐 智,吴 锋.现代化工,2004,24:40]
October 14,2009;Revised:January 4,2010;Published on Web:April 6,2010.
Preparation of an Ionic Liquid Gel Polymer Electrolyte and Its Compatibility with a LiFePO4Cathode
CUI Wen-Yu AN Mao-Zhong*YANG Pei-Xia
(School of Chemical Engineering and Technology,Harbin Institute of Technology,Harbin 150001,P.R.China)
An ionic liquid gel polymerelectrolyte(ILGPE)based on 1-ethyl-3-methyl-imidazolium hexafluorophosphate (EMIPF6),poly(vinylidenefluoride-hexafluoropropylene)(P(VDF-HFP)and LiPF6was prepared by a solution casting method.Its ion transport characteristics and compatibility with LiFePO4were investigated by cyclic voltammetry(CV), chronoamperometry,galvanostatic charge-discharge and electrochemical impedance spectroscopy(EIS).The results show that the ionic conductivity and electrochemical window at room temperature are 1.650×10-3S·cm-1and 5.0 V, respectively.The lithiation/delithiation reversibility was improved because of the formation of a passivation layer on the surface of the electrode during the charge-discharge cycles.
Lithium-ion battery; Ionic liquid gel polymer electrolyte; EMIPF6; Cathode materials; Compatibility
[Article] www.whxb.pku.edu.cn
*Corresponding author.Email:mzan@hit.edu.cn;Tel:+86-451-86413721.
The project was supported by the Natural Science Foundation of Heilongjiang Province,China(B2007-05).
黑龙江省自然科学基金(B2007-05)资助项目
O646;TM912.9
