基因组原位杂交技术在大麻育种中的初步应用
2010-12-05张利国
张利国
(黑龙江省农业科学院经济作物研究所,黑龙江 哈尔滨 150086)
荧光原位杂交技术(fluorescence in situ hybridization,FISH)是在已有的放射性原位杂交技术的基础上发展起来的一种非放射性分子细胞遗传学技术,是分子生物学和组织化学、细胞学相结合的产物,该技术在20世纪80年代末首先用来分析黑麦(Rye)的野生杂种双亲基因组的分布。
基因组原位杂交技术(genomic in situ hy-bridization,GISH)是荧光原位杂交技术进一步的发展,它是利用标记物标记基因组总DNA,以其作探针与染色体制片进行原位杂交检测目标DNA的一种技术。广泛应用于对不同物种之间的基因组进行研究[1];研究基因组结构及其空间排布规律[2];研究物种的起源与进化[3];检测外源渗入染色体或染色体片段[4]等生物学研究的各领域。
荧光原位杂交技术是分子细胞遗传学建立的基础,具有其它分子生物学和细胞方法无法比拟的直观性、准确性,这一技术将为大麻亲缘关系的演化研究,特别是为大麻性染色体的研究发挥重要作用。影响染色体原位杂交成功与否的因素有很多,如染色体制片的质量、探针的长度及与封阻的比例以及染色体的变性温度与时间等都影响着荧光原位杂交的效果。本研究以大麻为材料,确定这些因素的最佳组合,建立大麻的基因组原位杂交体系,并应用于亚麻基因组导入大麻染色体组的鉴定。
荧光原位杂交技术对研究花粉管通道法的转化途径和转化机制具有重要意义。目前,研究者利用荧光原位杂交等技术,已能检测转移结果,如检查外源基因是否存在于受体细胞核内,是否整合于染色体上,整合在哪一条染色体上以及外源基因是否表达等[5]。
1 实验材料与方法
1.1 实验材料
亚麻品种戴安娜,大麻品种五常40。2008年采用花粉管导入法将亚麻品种戴安娜的DNA导入大麻品种五常40,2009年经大田鉴定,获得形态变异明显的导入实验材料9份。
1.2 染色体制片
采用植物染色体去壁低渗法[6]。种子用蒸馏水浸泡24h,在25℃恒温保湿培养,等待根尖长出1cm左右,切取放入1.5%的对二氯苯溶液中,在10℃条件下预处理5h,卡诺溶液固定12h,转入70%酒精中4℃备用。制片前,将根尖置于双蒸水中低渗20min,用混合酶液(4%纤维素酶与1%果胶酶)37℃处理30min,不染色,采用火焰干燥法制片,在相差显微镜下镜检,将分散良好清晰的染色体标本置于液氮中15分钟,用于原位杂交实验。
1.3 总基因组DNA的提取与探针的标记
采用常规CTAB法提取戴安娜和五常40基因组,用分光光度计测量所提取DNA的纯度和浓度,分装,放-20℃保存。取亚麻总DNA100微升(浓度在50ng/ul以上即可),用超声波碎仪处理30秒到1分钟。用生物素标记探针十分稳定,可在TE缓冲液、-20℃条件下保存至少一年。
1.4 原位杂交
1.4.1 预处理
载片在60℃恒温箱中处理3小时或过夜,每张载片加100ul Rnase,37℃湿盒中处理1小时。室温下,2×SSC清洗10分钟。每张载片加200ul胃蛋白酶(含0.01%胃蛋白酶的10mol/LHCL),37℃温浴5分钟。1×PBS洗涤2×5min,然后放入4%的多聚甲醛中10min。2×SSC洗涤2min。在40ml的70%甲酰胺(溶于2×SSC,pH7.0)70℃变性2分钟。依次在冷的70%、85%、95%、100%乙醇中脱水,各3分钟,气干。
1.4.2 杂交混合液制备
制备杂交混合液:按每张标本加20ul配置杂交液,在冰上制备,含探针DNA 30~60ng,封阻DNA,鲑精DNA,10%SDS,20%硫酸葡聚糖/甲酰胺。封阻DNA的制备:大麻总基因组DNA,1.05Mpa灭菌5分钟。
用于探针的DNA纯度很重要,因为对任何标记系统来说,提取的DNA越纯,经标记形成探针的质量越好。经紫外分光度计测定,DNA的纯度值在1.8~2.0之间才符合要求。
本研究以亚麻总DNA为探针进行杂交,选用缺口平移法,因它产生的探针片段大小(300~600bp)易于穿透组织。但标记的时间要严格控制,时间不宜过长,否则由于DNA聚合酶本身的外切酶活性会导致标记效率的降低。本实验采用15-16℃温育2个小时。
影响荧光原位杂交成功与否的另一重要因素是探针与封阻DNA比例及封阻DNA片段长度大小。封阻DNA的作用是通过优先与靶染色体上共有保守序列杂交,使剩下的特异性序列为标记探针所杂交。探针DNA与封阻DNA的比例也是影响原位杂交信号强度的关键因素之一。封阻DNA的浓度过高或过低均不会获得较好的原位杂交效果。一般来说,两个物种的亲缘关系越近,则要采用较高浓度的封阻DNA;亲缘关系越远,封阻DNA的浓度降低,甚至可不用。实验结果表明,标记基因组总DNA与封阻基因组总DNA(200~400 bp)的浓度比例为1:200时,能有效分开大麻与亚麻的基因组。
1.4.3 变性与杂交
将杂交混合液置于95~100℃下处理10分钟,立刻置于冰上冷却。将杂交混合液加在已变性的载片上(预热37℃),每张18ul,盖上盖玻片,玻片四周用胶水封住,防止长时间高温杂交液成分变化。置于80℃下共变性6分钟。将载片放入湿盒中,37℃下杂交过夜。
对原位分子杂交来说变性包括两部分:染色体变性和杂交混合液变性。现在普遍采用的是热变性,但温度过高会使染色体严重变形,膨胀或边缘模糊不清。解决这一矛盾的方法是采用70℃、70%甲酰胺变性2分钟,为更好保持染色体形态,载片可在变性后经系列冷乙醇脱水。杂交混合液的变性不涉及形态问题,因此这一变性条件变动很大。本实验采用95~100℃变性10分钟,变性后迅速冰浴10分钟。
1.4.4 检测和观察
(1)用洗液1(50%甲酰胺),42℃冲洗三次,每次5分钟;再用0.1×SSC 60℃冲洗三次,每次5分钟。
(2)在37℃100ul 3%BSA中温浴20分钟(以下步骤避光操作);
(3)在 37℃ 90ul FITIC-AvidinD(Vecter;A-2001)温浴 30-40 分钟;
(4)用洗液2(0.1%Tween20)42℃冲洗三次,每次3分钟;
(5)在 37℃ 100ul Biotinylated goat anti-avidinD(Vecter;BA-0300)中温浴 30-40 分钟;(6)用洗液2 42℃冲洗三次,每次3分钟;
(7)在 37℃ 90ul FITIC-AvidinD(Vecter;A-2001)温浴 30-40 分钟;
(8)用洗液2 42℃冲洗三次,每次3分钟
(9)用蒸馏水快速冲洗,在每张载片上滴加40ul DABCO和PI的混合液,暗处保存30分钟;
(10)用蒸馏水冲洗干净,滴加18ul抗褪变剂。
(11)用OlympusBH-2荧光显微镜观察。FITIC和PI的荧光信号分别采用B激发滤光片和G激发滤光片组检测。将观察到的信号输入计算机数字化,用相应的计算机软件调节对比度和亮度,进行图像处理。
2 结果与分析
在荧光显微镜下,用PI反染的染色体呈红色荧光,生物标记的探针经用荧光剂FITC检测之后呈现黄绿色。
使用亚麻探针与亚麻染色体杂交,结果如图1,30条染色体均呈现出黄绿色信号,而对照(杂交液中不含探针)只有红色荧光,表明标记的探针是有效的。
使用亚麻探针与正常大麻染色体杂交,均只呈现出红色荧光信号如图2。使用亚麻探针与9份导入亚麻DNA的大麻染色体杂交,其中7份只有红色荧光信号,2份材料08-31,08-34有绿色荧光信号,如图3和图4,材料08-31有4个染色体出现绿色荧光信号(箭头处),08-34有2条染色体检出绿色荧光信号(箭头处)。
实验结果表明9份将亚麻戴安娜DNA导入大麻五常40的材料中,有2份材料含有亚麻的遗传物质,并且导入部位都是染色体端部,这可能与大麻的基因多集中在染色体端部有关。
3 讨论与展望
染色体原位杂交,实验过程复杂,影响的因素较多,除受探针的制备、探针与封阻DNA的比例和变性因素的影响外,染色体制片也是重要的影响因素。
首先保证较高的中期分裂相能提高杂交的成功率,一般每张载片要求10个分裂相以上,同时要求染色体从细胞膜中分散出来并可以计数,以便去除残余细胞质和细胞壁对染色体的遮盖。此外,染色体长度及凝聚状态是影响原位杂交分辩率的又一重要因素,在决定原位杂交分辨率的因素中,最重要的是所使用的靶DNA在染色体或DNA纤维上的浓缩,亦即DNA在染色体结构或DNA纤维上的三维空间包裹程度,浓缩度越高,分辨率越低,如染色体过短则DNA致密,可能无法确定重复序列在染色体上的不同位置的空间关系;在基因组原位杂交中,由于染色体的高度凝聚,将使杂交信号缩小,不利于小片段DNA序列的辨别。因此,今后研究重点之一就是如何另外提高染色体的伸展程度,目前Fiber-fish的出现已显著提高了原位杂交的分辨率。此外,能否获得清晰图像,与洗脱强度有很大的关系,因此在杂交过程中每个步骤要保证适当的洗脱强度。
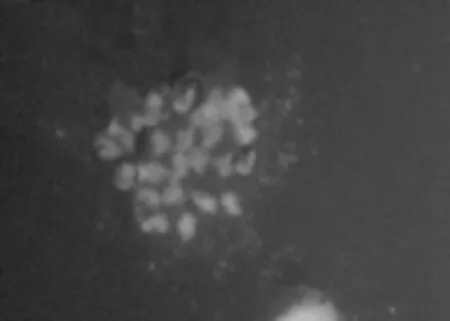
图1 亚麻探针与亚麻染色体杂交Fig.1 The hybrid offlaxprobe and flaxchromosome

图2 亚麻探针与正常大麻染色体杂交Fig.2 The hybrid offlaxprobe and normal hemp chromosome

图3 亚麻探针对材料08-31的检测Fig.3 The hybrid offlaxprobe and 08-31

图4 亚麻探针对材料08-34的检测Fig.4 The hybrid offlaxprobe and 08-34
利用原位杂交进行DNA序列的定位具有实验周期短、灵敏度高、分辨率高、直观可见等优点。大麻的性别分化是制约大麻发展的重要因素,利用原位杂交技术可以将大麻性别相关基因或序列定位于染色体上,对其具体功能进行深入的研究,同时原位杂交的在研究大麻的亲缘关系、以及大麻转基因的检测和遗传图谱的构建上都将发挥重要作用。
[1]宁顺斌,金危危,丁毅,等.基因组原位杂交比较玉米和水稻基因组同源性[J].科学通报,2000,45(22):2431-2434.
[2]忠华,李旭晨,夏英武.荧光原位杂交技术在植物学中的应用[J].植物学通报,2001,18(1):40 45.
[3]CaoM,Sleper DA,DongF,et al.Genomicin situ hybridization (GISH)reveals high chromosome pair-ingaffinitybetweenLolium perenneandFestuca mairei[J].Genome,2000,43:398 403.
[4]Choi Y A,Tao R,Yonemori K,et al.Multi-color genomicin situhybridization identifies parental chro-mosomes in somatic hybrids ofDiospyros kakaiand D.glandulosa[J].HortScience,2002,37:184-186.
[5]Ana Paula Santos,Eva Wegel,George C Allen,et al.In situ me-thods to localize transgenes and transcripts in interphase nuclei:a tool for transgenic plant research[J].Plant Methods.2006(2):18.
[6]朱徽.植物染色体及染色体技术[M].北京:科学出版社,1982.
