苗木离体叶片水分状况的叶绿素荧光参数定量诊断
2010-12-05段爱国杨文忠张建国张俊佩何彩云
段爱国,杨文忠,张建国,张俊佩,何彩云
(1.中国林业科学研究院 林业研究所 国家林业局林木培育重点实验室,北京 100091;2.新疆林业科学研究院,新疆 乌鲁木齐 830000)
叶绿素荧光分析技术能有效地了解逆境条件下叶片光系统对光能的吸收、传递、转换、耗散、分配等内在性特点[1-2]。当植物离体或自然生长状况下的叶片受到大气或土壤水分胁迫时,植物叶片叶绿素荧光参数就会发生规律性变化,从而间接地指示不同干旱胁迫强度时植物光合生理的变化[3-9]。在定量分析方面,有研究指出,干旱胁迫条件下,叶绿素荧光参数的变化程度与抗旱性指标存在显著相关性,可作为抗旱树种筛选的评定指标[10-11]。总体而言,以往的研究较为侧重于叶绿素荧光参数与水分胁迫程度间的定性分析,而相对缺乏胁迫过程中叶绿素荧光参数与水分胁迫程度的定量相关分析,不利于水分胁迫条件下荧光参数变化机制的系统揭示,进而一定程度上限制了荧光参数的说理性和指示性。基于此,本研究以云南省元谋县金沙江干热河谷区10种主要植被恢复树种苗木离体叶片为试材,探讨离体叶片室内自然失水过程中的叶绿素荧光反应机制,以期建立特定环境下苗木叶片水分动态与叶绿素荧光参数的内在相关关系,探索并初步实现植物叶片水分动态的荧光诊断。
1 材料与方法
1.1 植物材料
2006年4月初将采自云南省元谋县干热河谷区的10个主要植被恢复树种种子播种在中国林业科学研究院温室内,于2007年6月选取各树种生长良好的单株盆栽苗木——印楝Azadirachta indica,山合欢Albizia kalkora,新银合欢 Leucaena glauca,苏门答腊金合欢 Acacia glauca,木豆 Cajanus cajan,赤桉Eucalyptus camaldolensia,柠檬桉Eucalyptus citriodora,大叶相思Acacia auriculiformis,小桐子Jatropha curcas和蓝桉Eucalyptus globulue,连续浇水3 d,使苗木叶片充分吸水至饱和含水量,带回实验室。种子采集地的自然环境条件见参考文献[15]。
1.2 试验方法
剪取各苗木长30 cm带6~12片叶的枝条,包扎切口处,置放于实验平台上,在室温条件下自然失水 ,保持4盏日光灯的持续照射,叶面处光强约为320 μmol·m-2·s-1。分别在失水0,2,4,6,8,10,12,24,26,28,30,32,34,36,48,50,52,54,56,58,60 h 时,采用精确度达0.000 1 g的天平称取各树种枝条的质量,为适时鲜质量Mt(g),0 h的质量即为各个树种枝条的饱和质量Ms(g),并在每一个树种的离体枝条上固定3个叶片,采用美国产的OS1-FL便携式调制叶绿素荧光仪(Fv/Fm模式和Yield模式)测定叶绿素荧光参数[16]。Fv/Fm模式是用强作用光激发产生固定荧光Fo,最大荧光Fm,可变荧光Fv及PSⅡ最大光化学效率Fv/Fm,并计算电子传递效率Fm/Fo和PSⅡ潜在活性Fv/F[2]。测定前对每一叶片均暗适应8 min左右;Yield模式是用饱和闪光脉冲激发最大稳态荧光Fms,稳态荧光Fs及PSⅡ有效光化学量子产量Fmv/Fms(Fmv=Fms-Fs),测定时不需暗适应。当各树种枝条叶片完全枯萎或含水量基本保持不变时即停止测定。最后实验结束时,在WMK-02型电热恒温培养箱中进行烘干,测定枝条干质量Md(g),并计算整个自然失水过程中枝叶的相对含水量CRW(%)及失水率 RWL(%)的变化,各指标计算公式如下:RWC=(Mt-Md)/(Ms-Md),RWL=(Ms-Mt)/(Ms-Md)。另取各树种苗木一定量叶片,使其室温条件下自然失水。在失水过程中,隔0.5 h采用精确度达0.000 1 g的天平称取质量,同时采用WP4露点水势仪测定各树种叶水势,至少记录7个数据点,绘制各苗木叶片相对含水量与水势的关系图。
2 结果与讨论
2.1 10种苗木叶片保水力比较
叶片保水力通常用来表示植物组织抗脱水的能力大小,与维持体内水分平衡的能力相关[17]。从表1可知,10种苗木离体叶片失水率随失水时间的发展进程具有明显差异。在失水2 h时,新银合欢和木豆失水率已在20%以上,山合欢、大叶相思及柠檬桉失水率为15%~20%,大于其余5种苗木。这说明这几个树种早期失水控制能力较弱。在失水12 h时,10种苗木失水率大小排序为:小桐子<印楝<蓝桉<大叶相思<赤桉<柠檬桉<木豆<苏门答腊金合欢<新银合欢<山合欢,其中,小桐子等前5种苗木的失水率控制在50%以下,后5种失水率均在50%以上,且差距较大。失水率越低,说明苗木保水能力越强。在失水24 h时,失水率的大小排序与失水12 h时基本一致。此后,小桐子与印楝的失水率一直低于大叶相思和3种桉树。温室播种苗叶片保水力分析结果表明,小桐子与印楝的叶片保水力高于另外8个树种,大叶相思与3种桉树保水力其次,3种合欢的叶片保水力最差,木豆保水力居于3种桉树与3种合欢之间。
2.2 苗木叶片相对含水量与叶水势的关系
叶片相对含水量与叶水势为描述植物叶片水分状况的2个特征参数,但由于叶片构造的不同,相同叶片含水量的不同树种苗木的叶水势往往具有很大差异。图1描述了10种苗木叶片含水量与叶水势的关系。从图1可以看出,苗木叶水势均随叶片含水量的降低而下降,苗木叶水势与含水量的关系可由2次抛物线予以准确拟合,相关系数相当高,均为极显著相关(P<0.01),除蓝桉为0.968 1外,其余9种苗木均达0.990 0以上。这表明通过相对简单的叶片含水量的测定即可对苗木叶水势作出有效的预测。从抛物线的形状分析,赤桉、木豆、柠檬桉、大叶相思、小桐子、山合欢、新银合欢和蓝桉等8种苗木均表现为上 “凸”状,这说明这几种苗木叶水势在叶片含水量下降初始阶段的下降速度相对较慢,而在叶片含水量下降后期的下降趋势更为显著。苏门答腊金合欢的叶片含水量与叶水势关系曲线表现为下 “凸”状,即其叶水势随叶片含水量的下降呈现先快后慢的下降趋势。印楝叶水势与叶片含水量的关系居于上述2种类型之间,其叶水势随叶含水量以0.668 9为斜率呈近乎直线状下降。由于植物叶水势测量往往是破坏性的,故以往探讨两者间连续相关关系的研究较少,但为便于不同研究间的比较分析,建立苗木叶片含水量(RWC)与叶水势(ψwp)的关系深为必要。

表1 10种苗木离体叶片失水率随失水时间的变化Table 1 Change of water losing rate with water losing timeabout body-leaved leaves of ten species of seedlings

图1 10种苗木叶片相对含水量与叶水势的关系Figure 1 Relationship between relative water content and leaf potential of ten species of seedlings
2.3 持续失水条件下苗木叶片荧光参数的响应
2.3.1 Fo对水分胁迫的响应 固定荧光参数Fo的降低与上升可分别作为非光化学能量耗散和光合机构被破坏的重要指示性指标[15]。从图2可以看到,Fo随失水率(RWL)的变化规律可大致分为2种类型。第1种类型表现为Fo随RWL的增大呈先下降后上升的变化趋势,即在失水初期,处于安全含水量范围的叶片以增加热耗散的方式来保护光合机构免受伤害,而在失水一定程度后,叶片Fo上升,表明光合机构开始受到破坏。小桐子、印楝、大叶相思及赤桉属于此一类型,蓝桉与柠檬桉在失水2 h时Fo较为稳定,而在失水4 h时存在一个明显下降点,此后Fo上升,总体上亦属于第1种类型。第2种类型表现为Fo随RWL的增大先维持不变而后上升的发展规律。属于这一类型的树种有新银合欢、山合欢、苏门答腊金合欢及木豆,它们在失水初期光合机构未启动热耗散机制亦未发生明显可逆性失活现象,而是表现为一种忍耐干旱的适应特征。当失水至某一限度,光合机构发生失活现象。不同树种光合机构失活的时刻不同,如新银合欢出现在失水4 h,失水率达41.95%时刻,山合欢则出现在失水8 h,失水率达66.28%时刻。由于山合欢Fo在8 h时上升的速度非常迅速且失水率过大,不能肯定说其光合机构发生了可逆性失活,而很可能产生了不可逆性失活现象。第1种类型可谓主动防御型,而第2种类型则属被动抵抗型。值得注意的是,第1种类型的树种保水力较第2种类型大,这说明保水力越强的树种,其启动热耗散机制保护光合机构免受干旱胁迫伤害的能力越强,且水分胁迫条件下发生可逆性失活的时刻越晚。可以很明显地看到,在失水最后阶段,各树种荧光参数Fo均出现下降现象,此时,Fo的下降应已与热耗散机制的启动无关,因Fo反映了PSⅡ天线色素受激发后的电子密度,它与叶片叶绿素浓度有关[16],故而很可能是因为离体叶片过度失水后叶绿素含量降低的缘故。除定性方面的紧密关系外,荧光参数Fo与失水率间亦具有很强的数量关系,除蓝桉外,其余9种苗木Fo随失水率的变化曲线均可由二次抛物线予以恰当的描述,相关系数均达显著或极显著相关水平。
2.3.2 Fm,Fv及Fs对水分胁迫的响应 从图3可以明显看到,稳态荧光产量参数Fs随失水率RWL的变化表现较为稳定,而荧光参数Fm和Fv随失水率的增大总体上呈显著下降趋势,由于Fm和Fv分别指示最大荧光产量与PSⅡ原初电子受体QA的还原状态,故这一结果表明PSⅡ反应中心处于完全关闭时的最大荧光产量与QA的可还原强度均随叶片失水率的增大而下降。当Fm下降且逐渐接近Fo时,Fv逐渐下降至0。与Fo相同,Fm和Fv随失水率的变化亦可分为2种类型。一种类型为Fm和Fv随失水率的增大而一直呈明显下降趋势,另一类型为Fm和Fv随失水率的增大呈先维持稳定而后下降的规律。2种类型所包含的树种与Fo随失水率的变动类型基本一致。这说明水分胁迫条件下,保水力强的树种具有更灵敏的Fm和Fv响应机制,而保水力弱的树种在胁迫初期具有更高的最大荧光产量和QA还原状态的持续能力。

图2 10种苗木离体叶片荧光参数Fo随失水率的动态变化规律Figure 2 Dynamic change of fluorescence parameter Fowith water losing rate about body-leaved leaves of ten species of seedlings
2.3.3 Fv/Fm和Fmv/Fms与水分参数的定性与定量关系 从图4可知,荧光参数Fv/Fm和Fmv/Fms随失水率RWL的增大总体上呈逐渐下降的趋势,但不同于Fm/Fo和Fv/Fo,其下降轨迹近似于一条水平抛物线,即在失水初期,Fv/Fm和Fmv/Fms变化较为平缓,而在失水后期,Fv/Fm和Fmv/Fms下降较为迅速。2个荧光参数在失水初期变化不明显,表明一定范围内的持续失水不能够立即引起PSⅡ反应中心光化学效率的下降,这与轻度水分胁迫条件下植物叶片净光合速率一般变化较小的现象相符[14]。Fv/Fm和Fmv/Fms的下降表明水分胁迫降低了PSⅡ反应中心的光化学效率和有效光化学量子产量[15]。当然,树种不同,快速下降时刻与下降幅度亦不同。在整个失水过程中,荧光参数Fv/Fm一直略高于Fmv/Fms,生动地表明了PSⅡ有效光化学量子产量是PSⅡ最大光化学效率的主要组成部分。可以发现,在Fv/Fm和Fmv/Fms下降的过程中,各树种均存在一个突降点,即荧光参数随失水率的下降而快速下降的时刻,该时刻为PSⅡ反应中心失活过程中的关键点。不同树种突降点出现的时刻不同,光化学效率Fv/Fm第1次降幅在0.10以上时,小桐子、大叶相思、印楝、新银合欢、山合欢、赤桉、木豆、柠檬桉、苏门答腊金合欢和蓝桉等10树种突降点对应的失水率依次降低,分别为83.93%,64.99%,63.73%,53.45%,48.03%,46.92%,43.42%,40.37%,37.31%和33.32%。且PSⅡ有效光化学量子产量参数Fmv/Fms的突降点出现的时刻较PSⅡ最大光化学效率参数Fv/Fm的突降点出现的时刻早,这意味着荧光参数Fmv/Fms比Fv/Fm能更灵敏地指示叶片光合机构遭受水分胁迫的重大伤害状况,也就是说,极度的水分胁迫首先引起了PSⅡ有效光化学量子产量的严重下降。对于水分胁迫条件下Fv/Fm存在突降点的问题,以前的研究亦有发现[8],但由于荧光测定时间间隔过长,且不够均匀,致使未能得到可靠结论,而本研究无疑再一次证明了该现象的存在。而突降点出现时刻所对应的失水率越大是否意味着树种叶片光合机构忍耐干旱的能力愈强,则需要得到进一步的深入探讨。表2定量地描述了离体叶片荧光参数Fv/Fm和Fmv/Fms随失水率的数量变化关系。从表2及图4可知,荧光参数Fv/Fm和Fmv/Fms与失水率存在极显著的相关关系(P<0.01),二次抛物线方程的相关指数均在0.85以上,绝大部分超过了0.95。这表明荧光参数Fv/Fm和Fmv/Fms与叶片含水量具有很强的数量相关关系,且由于叶片含水量与叶水势相关关系紧密,故Fv/Fm和Fmv/Fms与叶水势亦应具有很强的相关关系。很明显,荧光参数Fv/Fm和Fmv/Fms具有量化诊断叶片水分状况的潜在功能,因此,除遥感方法外[17],叶绿素荧光参数亦可望成为植物叶片失水率无损伤测定的指示性指标。根据图1中叶水势与相对含水量的关系以及表2可建立荧光参数Fv/Fm和Fmv/Fms与叶水势的关系式。当叶水势为-1.5 MPa时,10种苗木离体叶片PSⅡ有效光化学量子产量Fmv/Fms由大到小依次为:赤桉(0.79)>小桐子(0.77)=大叶相思(0.77)>新银合欢(0.68)>印楝(0.67)和山合欢(0.63)>木豆(0.62)>苏门答腊金合欢(0.61)>柠檬桉(0.58)>蓝桉(0.53)。Fmv/Fms越大,表明水分胁迫条件下苗木叶片光合机构实际光能捕获效率越高,苗木潜在耐旱生产能力越强。

图3 10种苗木离体叶片荧光参数Fm,Fv,Fs随失水率的动态变化规律Figure 3 Dynamic change of fluorescence parameter Fm,Fv,Fswith water losing rate about body-leaved leaves of ten species of seedlings
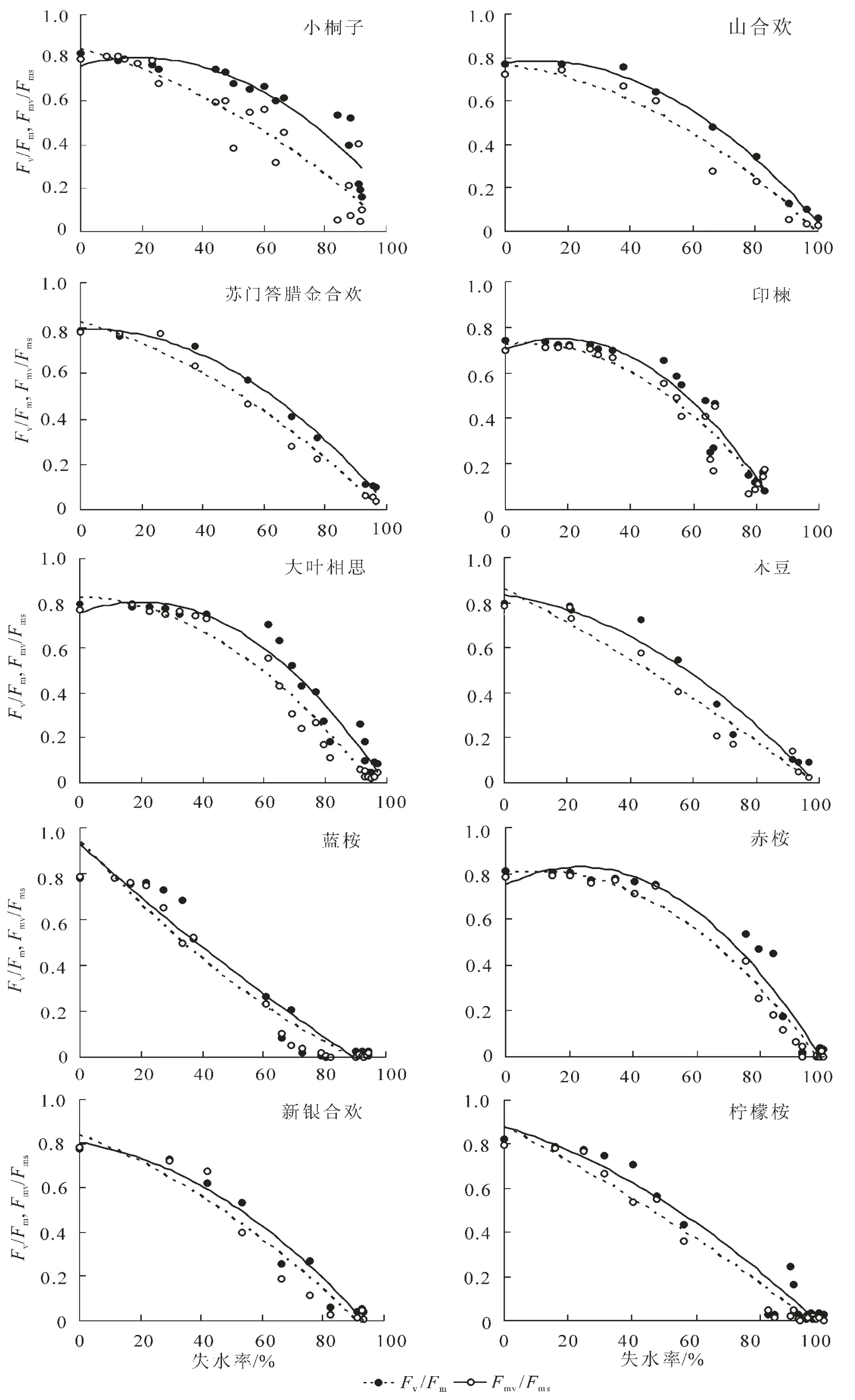
图4 10种苗木离体叶片荧光参数Fv/Fm和Fmv/Fms随失水率的动态变化规律Figure 4 Dynamic change of fluorescence parameter Fv/Fm,Fmv/Fmswith water losing rate about body-leaved leaves of ten species of seedlings
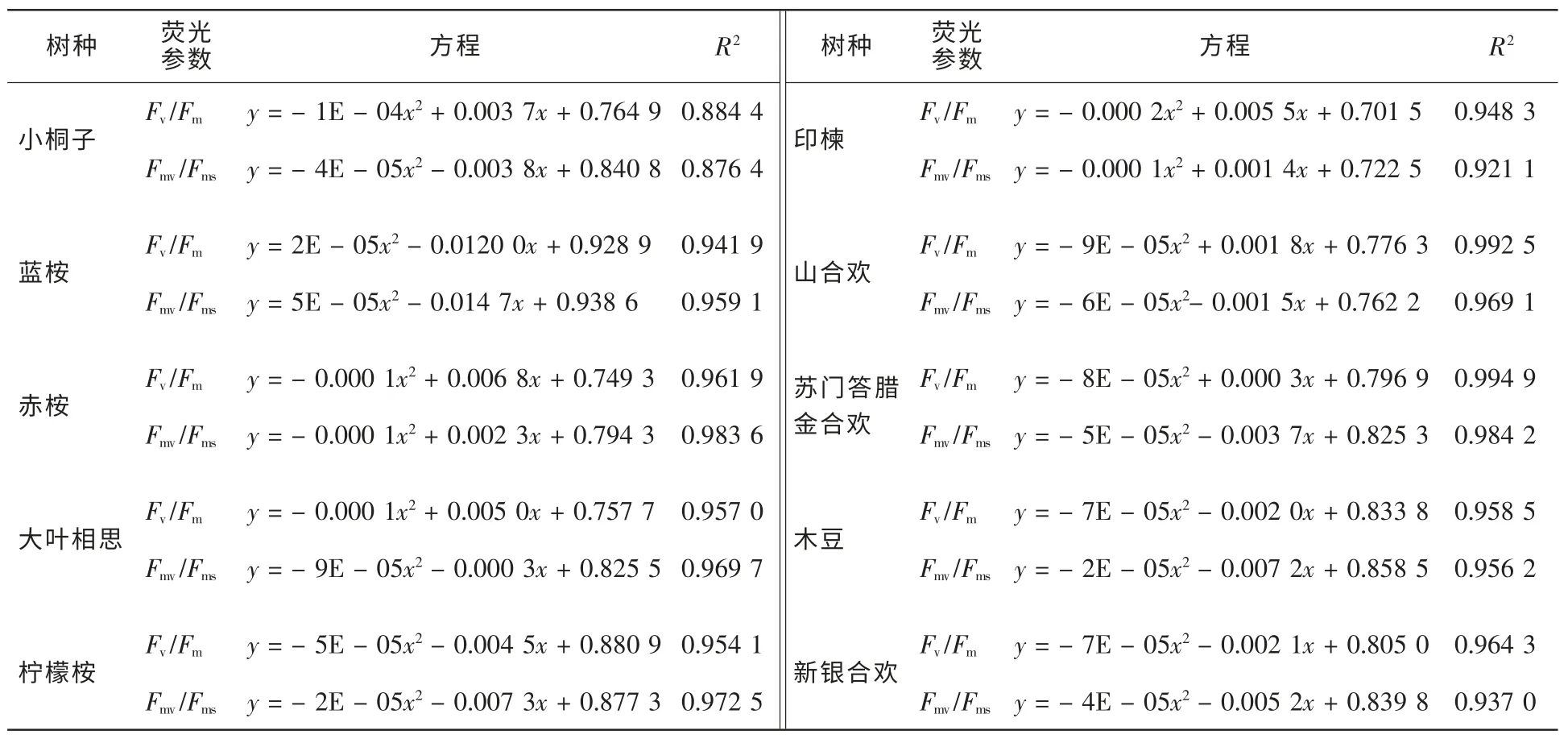
表2 10种苗木离体叶片荧光参数Fv/Fm和Fmv/Fms与失水率的数量关系式Table 2 Mathematical model of fluorescence parameters Fv/Fm,Fmv/Fmsand water losing rate about body-leaved leaves of ten species of seedlings
3 结论
离体叶片水分状况与叶绿素荧光参数的数量关系研究对于揭示供试树种干旱逆境条件下的内在光合作用机制和活体诊断叶片水分状况具有重要参考价值。笔者以干热河谷区10种主要植被恢复树种为材料,探讨了苗木离体叶片室内自然失水条件下叶绿素荧光参数的响应特征,主要结论有:①小桐子与印楝的叶片保水力最高,大叶相思与3种桉树保水力其次,3种合欢的叶片保水力最差,木豆保水力居于3种桉树与3种合欢之间。②不同树种苗木叶水势均随叶片含水量的降低而下降,两者的关系可由二次抛物线予以准确拟合,相关指数均在0.95以上,可通过相对简单的叶片含水量的测定对苗木叶水势作出有效的预测。③荧光参数Fo随失水率的变化规律大致可分为主动防御型和被动抵抗型等2种类型,主动防御型表现为Fo随失水率的增大呈先下降后上升的变化趋势,被动抵抗型表现为Fo随失水率的增大先维持基本不变而后上升的发展规律,主动防御型树种的叶片保水力较被动抵抗型大。这说明保水力越强的树种,其启动热耗散机制保护光合机构免受干旱胁迫伤害的能力越强,且水分胁迫条件下发生可逆性失活的时刻越晚。④荧光参数Fm和Fv随失水率的增大总体上呈显著下降趋势,Fv/Fm和Fmv/Fms随失水率的增大总体上呈逐渐下降的趋势,下降轨迹近似于一条水平抛物线,在Fv/Fm和Fmv/Fms下降的过程中,各树种均存在一个突降点,即荧光参数随失水率的下降而快速下降的时刻,该时刻为PSⅡ反应中心失活过程中的关键点。⑤荧光参数Fmv/Fms比Fv/Fm能更灵敏地指示叶片光合机构遭受水分胁迫的重大伤害状况,荧光参数Fv/Fm和Fmv/Fms与叶片水分参数呈现很强的数量相关关系,具有作为植物叶片水分状况诊断指标的广阔前景。
[1]HORTON P,RUBSN A V,WALTERS R G.Regulation of light harvesting in green plants:indication by nonphotochemical quenching of chlorophyll fluorescence[J].Plant Physiol,1994,106:415-420.
[2]许大全,张玉全.植物光合作用的光抑制[J].植物生理学通讯,1992,28(4):237-243.XU Daquan,ZHANG Yuquan.Photoinhibition of photosynthesis in plants[J].Plant Phys Commun,1992,28(4):237-243.
[3]GOVINDJEE D,FORK D C,ARMOND P A.Chlorophyll afluorescence transient as an indicator of water stress in maize plants[J].Plant Sci Lett,1981,20:191-194.
[4]谭新星,许大全.叶绿素缺乏的大麦突变体的光合作用和叶绿素荧光[J].植物生理学报,1996,22(1):51-57.TAN Xinxing,XU Daquan.Leaf photosynthesis and chlorophyll fluorescence in a chlorophyll deficient mutant of barley[J].Acta Phytophys Sin,1996,22(1):51-57.
[5]王可玢,赵福洪,王孝宣,等.用体内叶绿素a荧光诱导动力学鉴定番茄的抗冷性[J].植物学通报,1996,13(2):29-33.WANG Kefen,ZHAO Fuhong,WANG Xiaoxuan,et al.In vivo chlorophyll a fluorescence induction kinetics as a tool for chilling-tolerance detect in tomato[J].Chin Bull Bot,1996,13(2):29-33.
[6]赵会杰,邹琦,于振文.叶绿素荧光分析技术及其在植物光合机理研究中的应用[J].河南农业大学学报,2000,34(3):248-251.ZHAO Huijie,ZOU Qi,YU Zhenwen.Chlorophyll fluoresence analysis technique and its application to photosynthesis of plant[J].J Henan Agric Univ,2000,34(3):248-251.
[7]李树华,许兴,郑国琦.牛心朴子叶绿素荧光参数日变化及其与气象因子的关系[J].干旱地区农业研究,2003,21(2):91-94.LI Shuhua,XU Xin,ZHENG Guoqi.The daily change in chla fluorescence parameters and the relationship between it and weather factors[J].Agric Res Arid Areas,2003,21(2):91-94.
[8]段爱国,保尔江,张建国.水分胁迫下华北地区主要造林树种离体枝条叶片的叶绿素荧光参数[J].林业科学研究,2005,18(5):578-584.DUAN Aiguo,BAO Erjiang,ZHANG Jianguo.Response of fluorescence parameters in detached leaves of several tree species in Huabei district to drought stress[J].For Res,2005,18(5):578-584.
[9]王利英,楼炉焕,王超,等.3种冬青属植物气体交换参数及叶绿素荧光特性[J].浙江林学院学报,2009,26(1):27-31.WANG Liying,LOU Luhuan,WANG Chao,et al.Leaf gas exchange and chlorophyll fluorescence parameters in three species of Ilex[J].J Zhejiang For Coll,2009,26(1):27-31.
[10]林世青,许春辉,张其德.叶绿素荧光动力学在植物抗性生理学、生态学和农业现代化中的应用[J].植物学通报,1992,9(1):1-16.LIN Shiqing,XU Chunhui,ZHANG Qide.Some application of chlorophyll fluorescence kinetics to plant stress physiology phytoecology and agricultural modernization[J].Chin bull Bot,1992,9(1):1-16.
[11]蒲光兰,周兰英,胡学华,等.干旱胁迫对金太阳杏叶绿素荧光动力学参数的影响[J].干旱地区农业研究,2005,23(3):44-48.PU Guanglan,ZHOU Lanying,HU Xuehua,et al.Effect of soil drought stress on characteristics of chlorophyll fluorescence in Jintaiyang apricot variety[J].Agric Res Arid Areas,2005,23(3):44-48.
[12]段爱国,张建国,张俊佩,等.金沙江干热河谷主要植被恢复树种叶水势的时空变化规律[J].林业科学研究,2007,20(2):151-159.DUAN Aiguo,ZHANG Jianguo,ZHANG Junpei,et al.Spatial and temporal variations of water potential of the main tree species for vegetation restoration in the dry-hot valleys of the Jinsha River[J].For Res,2007,20(2):151-159.
[13]HAVAUX M,LANNOYE R.Chlorophyll afluorescence induction:a sensitive indicator of water stress in maize plants[J].Irrig Sci,1983,4:147-151.
[14]张建国,李吉跃,沈国舫.树木耐旱特性及其机理研究[M].北京:中国林业出版社,2000:31-54.
[15]张守仁.叶绿素荧光动力学参数的意义及讨论[J].植物学通报,1999,16(4):444-448.ZHANG Shouren.A discussion oil chlorophyll fluorescence kinetics parameters and their significance[J].Chin Bull Bot,1999,16(4):444-448.
[16]KRAUSE G H,WEIS E.Chlorophyll fluorescence as a tool in plant physiology(Ⅱ)interpretation of fluorescence signals[J].Photosynth Res,1984,5:139-157.
[17]王纪华,赵春江,郭晓维,等.利用遥感方法诊断小麦叶片含水量的研究[J].华北农学报,2000,15(4):68-72.WANG Jihua,ZHAO Chunjiang,GUO Xiaowei,et al.Study on the water content of wheat leaves by the remote sensing[J].Acta Agric Bor Sin,2000,15(4):68-72.
