V3TiNi0.56Al0.2Crx(x=0 ~ 0.3)贮氢合金的微结构及电化学性能
2010-11-30周上祺刘守平梁国明孙宇阳
李 荣, 周上祺, 刘守平, 梁国明, 孙宇阳
(1. 重庆师范大学 功能材料实验室,重庆 400047;2. 重庆大学 材料科学与工程学院,重庆 400044)
V3TiNi0.56Al0.2Crx(x=0 ~ 0.3)贮氢合金的微结构及电化学性能
李 荣1, 周上祺2, 刘守平2, 梁国明1, 孙宇阳1
(1. 重庆师范大学 功能材料实验室,重庆 400047;2. 重庆大学 材料科学与工程学院,重庆 400044)
采用自蔓延高温合成法制备V3TiNi0.56Al0.2Crx(x=0~0.3) 贮氢合金,经XRD和电化学测试等研究Cr添加量对合金微结构及电化学性能的影响。结果表明: 当x为0、0.1和0.2时,V3TiNi0.56Al0.2Crx合金均由V基固溶体主相和TiNi相组成;当x=0.3时,合金由V基固溶体主相和具有六方结构的C14型Laves相组成;随着Cr含量的增加,合金主相的晶胞常数和晶胞逐渐减小;添加 Cr以后,合金电极的最大放电容量降低,对活化性能基本没有影响;此外,添加Cr可使合金循环性能得到明显改善,V3TiNi0.56Al0.2Cr0.3合金经过10次充放电循环后,容量保持率为99%,大电流放电性能最好;随着Cr含量的增加,合金中氢的扩散系数逐渐增大。
贮氢合金;V3TiNi0.56Al0.2Crx合金;自蔓延高温合成;组织结构;电化学性能
钒基固溶体合金作为一种新型的贮氢合金,具有可逆贮氢量大、氢在合金中的扩散速度快等优点,得到广泛的研究[1−5]。由于钒及钒基固溶体本身在碱性溶液中缺乏电催化活性,不具备可逆的电化学吸放氢能力,因而钒基固溶体单相合金一直未能在电化学体系中得到应用。20世纪90年代,TSUKAHARA等[6−7]研究发现,在V-Ti固溶体合金中加入适量Ni元素,使合金中生成具有导电集流和电催化作用的 TiNi基第二相,能有效地改善V基固溶体型合金的充放电特性。另有研究发现[8−12],通过添加合金元素 Al、Si、Mn、Fe、Co、Nb、Mo、Pd和 Ta等可提高V3TiNi0.56Mx电极的循环稳定性, 特别是添加Nb、Ta和Co可在不影响电极容量和活性的情况下,有效提高合金的循环寿命。此外,添加元素Hf 可使TiNi相转化为C14 相,使合金高倍率放电性能大大提高。PAN等[13]报道添加Cr可以显著提高Ti-V-Ni合金电极的循环寿命;KIM等[14]报道添加Cr可以抑制 V0.87−xTi0.13Crx合金电极在充放电过程中V在电解液中的溶解损失。但Cr对自蔓延高温合成法制备的钒基固溶体贮氢合金性能的影响还未见报道。因此,本文作者在前期用自蔓延高温合成法制备钒基固溶体贮氢合金 V3TiNi0.56Al0.2的基础上[15−16],选用 Cr作为合金化改性的添加元素,系统地研究Cr添加量对V3TiNi0.56Al0.2Crx(x=0~0.3)储氢合金微结构及电化学性能的影响。
1 实验
实验用的 V3TiNi0.56Al0.2Crx(x=0~0.3)合金以偏钒酸铵、二氧化钛、铝和镍等为原料,采用自蔓延高温合成法制备,具体制备方法见文献[15]。将制得的贮氢合金,先机械破碎成小粒,再用球磨机在氩气保护下磨成粉末粒径小于 74 µm 待用。取部分合金粉在D/MAX-1200型X射线衍射仪上以Cu Kα为衍射束测量合金的晶体结构。另取部分块状铸态样品经抛光和腐蚀后,在Olympus金相显微镜上观察合金的金相形貌组织。
电化学测试在三电极系统中进行,负极是由 1 g贮氢合金粉与1 g镍粉混合均匀后冷压(压力12 MPa)而成面积为0.50 cm2的电极;正极为高容量的烧结式Ni(OH)2/NiOOH;参比电极为 Hg/HgO;电解液为 6 mol/dm3的KOH溶液。测试温度298 K,所用仪器为美国生产的CHI660A电化学工作站。以100 mA/g的电流充电5 h,用60 mA/g电流放电到相对于Hg/HgO参比电极为−0.6V。每次充放电结束均停止20 min。
2 结果与讨论
2.1 V3TiNi0.56Al0.2Crx(x=0~0.3)合金的组织结构
图1所示为 V3TiNi0.56Al0.2Crx(x=0~0.3)合金的XRD谱。从图1中可以看出,所有合金的主相均为体心立方结构(bcc)的钒基固溶体,第二相的组成与铬含量有关,当Cr含量为0、0.1和0.2时,第二相为TiNi相;而当x=0.3时,第二相则为具有六方结构的C14型Laves相,TiNi相消失。这与黄太仲等[17]的研究结果一致。
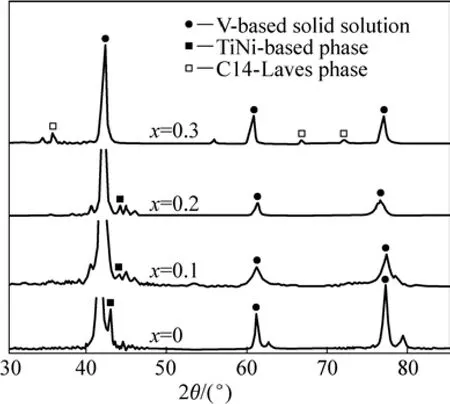
图1 V3TiNi0.56Al0.2Crx(x=0~0.3)合金的XRD谱Fig.1 XRD patterns of V3TiNi0.56Al0.2Crx(x=0−0.3) alloys
从图1中还可以看出,随合金含Cr量的增加,V基固溶体主相向高角度方向移动,说明合金相的晶胞体积逐渐减小。根据上述晶体结构特征,对XRD谱进行定量分析,计算出不同Cr含量合金中V基固溶体主相(BCC)的晶胞参数(见表1)。由表1可见,V基固溶体主相的晶胞参数和晶胞体积都随合金中Cr含量的增加而减小。这是因为Cr的原子半径(0.127 nm)小于V(0.135 nm)、Ti(0.145 nm)和Al(0.143 nm)的原子半径,与Ni(0.124 nm)的原子半径相当,Cr含量的增加将使两相中V、Ti、Al和Ni含量减少,导致晶胞体积逐渐减小。
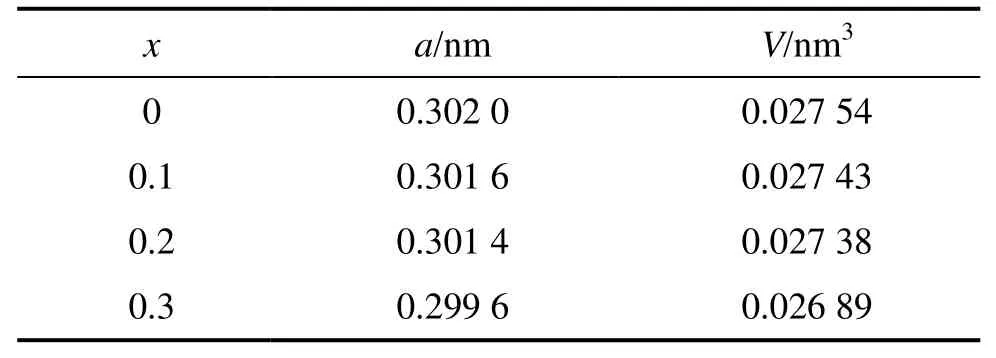
表1 V3TiNi0.56Al0.2Crx合金中BCC 相的晶胞参数Table 1 Crystal cell parameters of BCC phase of V3TiNi0.56Al0.2Crx alloys
图2所示为贮氢合金 V3TiNi0.56Al0.2Crx(x=0~0.3)的显微组织。从图2中可以看出,合金主要是由钒基固溶体相和第二相组成,第二相呈网状分布在钒基固溶体相的晶界处。且随Cr含量的增加,合金中主相晶粒尺寸减小。
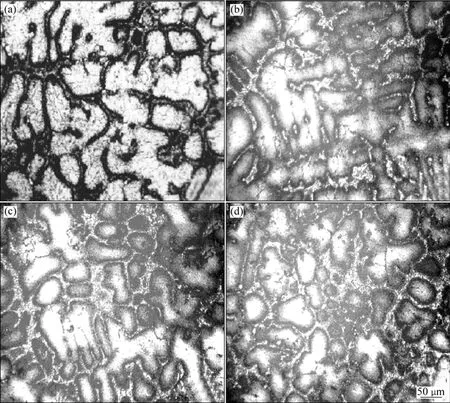
图2 V3TiNi0.56Al0.2Crx(x=0~0.3)合金的显微组织Fig.2 Microstructures of V3TiNi0.56Al0.2Crx(x=0−0.3) alloys: (a) x=0; (b) x=0.1; (c) x=0.2; (d) x=0.3
2.2 V3TiNi0.56Al0.2Crx(x=0~0.3)合金的电化学性能
图3所示为放电电流为 60 mA/g时 V3TiNi0.56-Al0.2Crx(x=0~0.3)合金电极在298 K时的活化性能和最大放电容量。从图3中可以看出,V3TiNi0.56Al0.2合金电极第2次活化就达到最大放电容量(320 mA·h/g);当在V3TiNi0.56Al0.2合金中加入Cr以后,钒基固溶体贮氢合金电极 V3TiNi0.56Al0.2Crx在第 4次充放电循环时基本上也已经活化,最大放电容量分别为280(x=0.1)、242 (x=0.2)和 195 mA·h/g(x=0.3)。这说明添加 Cr以后,合金电极的最大放电容量降低,对活化性能基本没有影响。研究表明[18],V基固溶体相中存在的具有催化和导电集流作用的第二相(如TiNi基相或Lavse相等),可使V基固溶体相在碱性溶液中被催化激活并实现电化学可逆吸放氢过程。但随着Cr含量x进一步增加,合金的最大放电容量逐渐降低。这是可能是由于 Cr添加量使得合金中第二相析出量过多,导致高容量的V基固溶体相主相含量减少,从而引起合金放电容量的降低,说明添加Cr对合金的最大放电容量不利。其次,在V3TiNi0.56Al0.2合金中加入Cr以后,V3TiNi0.56-Al0.2Crx(x=0.1、0.2、0.3)合金晶胞体积逐渐减少,从而提高合金氢化物的放氢压力[19]。由此可认为这两点是造成在V3TiNi0.56Al0.2合金中加入Cr后合金最大放电容量降低的主要原因。
从图3中还可以看出,V3TiNi0.56Al0.2Crx(x=0.1、0.2、0.3)合金的循环稳定性大大优于V3TiNi0.56Al0.2合金的。通过计算表明,合金经过10次充放电循环后的容量保持率 C10/Cmax分别为 14%(x=0)、92%(x=0.1)、98%(x=0.2)和 99%(x=0.3)。V3TiNi0.56Al0.2合金第 2次达到最大放电容量,然后放电容量降低很快,说明V3TiNi0.56Al0.2合金的循环性能差,但在V3TiNi0.56Al0.2合金中加入Cr以后,合金的循环性能得到很大幅度的改善。这是因为合金中Cr含量的增加,易在合金表面形成一层较致密的Cr氧化物钝化膜,这层钝化膜有利于抑制合金中Ti和V等元素的氧化和脱溶,有效抑制合金元素(尤其是V和Ti)在碱液中的腐蚀溶出,延缓合金元素的氧化腐蚀和合金双相结构的破坏失效,使合金的循环容量衰减速度减慢,因此提高合金电极的循环稳定性[20]。

图3 V3TiNi0.56Al0.2Crx(x=0~0.3)合金的活化性能Fig.3 Activation energies of V3TiNi0.56Al0.2Crx (x=0−0.3)alloys
图4所示为V3TiNi0.56Al0.2Crx(x=0~0.3)合金电极以不同放电电流时的最大放电容量。从图4中可以看出,所有合金的放电容量均随放电电流的增大而降低,而在相同放电电流下,合金的高倍率放电能力随Cr含量的增加先降低而后升高。当放电电流为 100 mA/g时,V3TiNi0.56Al0.2合金的最大放电容量为350 mA·h/g,V3TiNi0.56Al0.2Cr0.3合金的最大放电容量为210 mA·h/g;而当放电电流为800 mA/g时,V3TiNi0.56Al0.2Cr0.3合金的最大放电容量为130 mA·h/g,而V3TiNi0.56Al0.2合金的最大放电容量仅为40 mA·h/g。由此可见,加入Cr对提高合金的高倍率放电性能是有利的。这与贾彦敏等[20]的研究结果一致。

图4 V3TiNi0.56Al0.2Crx(x=0~0.3)合金在不同放电电流时的放电容量Fig.4 Discharging capacities of V3TiNi0.56Al0.2Crx(x=0−0.3)alloys discharged at different discharge current
2.3 V3TiNi0.56Al0.2Crx(x=0~0.3)中氢的扩散系数
在放电电流为 60 mA/g下对 V3TiNi0.56Al0.2Crx(x=0~0.3)贮氢合金电极进行充放电实验,当合金电极充分活化后,再分别以 10、20、30、40、50、60和80 mV/s的扫描速度测得贮氢合金电极的循环伏安曲线如图5所示。从图5中可以看出,V3TiNi0.56Al0.2合金电极中在循环伏安曲线阳极分支上,在−0.3 V(vs Hg/HgO)附近均出现氢的氧化峰,其峰电流随扫描速度的增加而增加,峰电位随扫描速度的增加而略有正移。在阴极分支上,出现氢在电极表面的吸附平台和氢的析出峰。而在V3TiNi0.56合金中加入Cr以后,氢的氧化峰出现在循环伏安曲线阳极分支上−0.55~−0.60 V(vs Hg/HgO)附近。
根据图5计算的氧化峰电流与跟扫描速度的关系示于图6。从图6中可以看出,贮氢合金电极循环伏安曲线的氧化峰电流与扫描速度的平方根之间存在线性关系。因此,可以根据下式计算氢的扩散系数[21]:

式中:c0是反应物初始浓度;ν为电位扫描速度,V/s;Ip为峰值电流;α是一个常数;S表示电化学反应的有效面积,cm2。可求得合金 V3TiNi0.56Al0.2Crx(x=0~0.3)中氢的扩散系数D如表2所列。
从表2中可以看出,随着合金中Cr含量增加,合金中氢的扩散系数也增加。电极电化学反应的交换电流密度和氢在合金本体中的扩散系数是决定金属氢化物电极倍率放电能力的两个重要影响因素。表明V3TiNi0.56Al0.2Crx合金的大电流放电性能随着Cr含量的增加而增强。
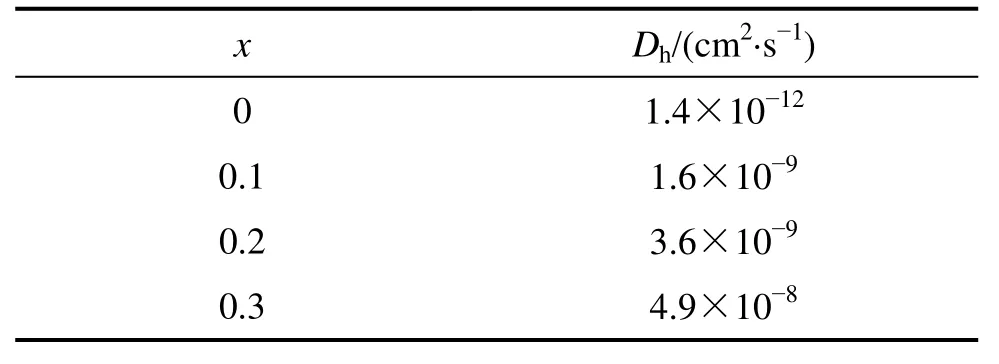
表2 氢在V3TiNi0.56Al0.2Crx合金中的扩散系数Table 2 Diffusion coefficients of hydrogen in V3TiNi0.56Al0.2-Crx alloys

图5 V3TiNi0.56Al0.2Crx(x=0~0.3)合金在不同扫描速度时的循环伏安曲线Fig.5 Cyclic voltammograms of V3TiNi0.56Al0.2Crx (x=0−0.3) at different scanning rates: (a) x=0; (b) x=0.1; (c) x=0.2; (d) x=0.3
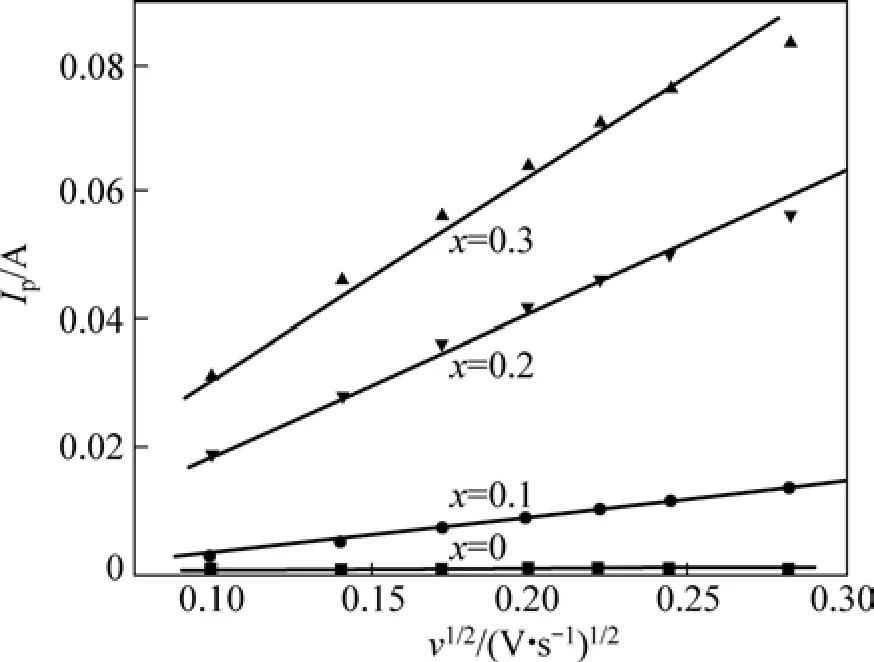
图6 V3TiNi0.56Al0.2Crx合金的氧化峰电流Ip与扫描速度v1/2之间的关系Fig.6 Relationship between anodic peak current Ip and v1/2 for V3TiNi0.56Al0.2Crx
3 结论
1) 在钒基固溶体贮氢合金 V3TiNi0.56Al0.2Crx(x=0~0.3)中,当x为0、0.1和0.2时,合金由主相V基固溶体相和第二相TiNi相组成;当x=0.3时,合金由主相V基固溶体相和具有六方结构的C14型Laves相组成。且随合金Cr含量的增加,V基固溶体相的晶胞常数和晶胞体积逐渐减小。
2) 随着 Cr含量增加,钒基固溶体贮氢合金V3TiNi0.56Al0.2Crx(x=0~0.3)的最大放电容量逐渐降低,而Cr添加量对合金活化性能的影响较小。
3) 添加Cr可以提高合金的高倍率放电能力,合金的充放电循环稳定性有所改善。
4) 随着Cr含量增加,氢的氧化峰向更负的方向移动,钒基固溶体贮氢合金电极中氢的扩散系数逐渐增大。
REFERENCES
[1] ITOH H, ARASHIMA H, KUBO K, KABUTOMORI T,OHNISHI K. Improvement of cyclic durability of BCC structured Ti-Cr-V alloys[J]. J Alloys Comp, 2005, 404/406:417−420.
[2] YOUNG K, FETCENKO M A, LI F, OUCHI T, KOCH J. Effect of vanadium substitution in C14 Laves phase alloys for Ni-MH battery application[J]. J Alloys Comp, 2009, 468(1/2): 482−492.
[3] SINGH B K, CHO S W, YOON H S. Influence of Cu addition on structure and hydrogen desorption characteristics of Ti0.16Zr0.05Cr0.22V0.57alloy[J]. Materials Chemistry and Physics,2008, 112(2): 686−689.
[4] PAN Hong-ge, LI Rui, LIU Yong-feng, GAO Ming-xia, MIAO He, LEI Yong-quan, WANG Qi-dong. Structure and electrochemical properties of the Fe substituted Ti-V-based hydrogen storage alloys[J]. J Alloys Comp, 2008, 463(1/2):189−195.
[5] ZHU Yun-feng, LIU Yan-fang, HUA Feng, LI Li-quan. Effect of rapid solidification on the structural and electrochemical properties of the Ti-V-based hydrogen storage electrode alloy[J].J Alloys Comp, 2008, 463(1/2): 528−532.
[6] TSUKAHARA M, TAKAHASHI K, MISHIMA T, SAKAI T,MIYAMURA H, KURIYAMA N, UEHARA I. Metal hydride electrodes based on solid solution type alloy TiV3Nix(0≥x≥0.75)[J]. J Alloys Comp, 1995, 226: 203−208.
[7] TSUKAHARA M, KAMIYA T, TAKAHASHI K, KAWABATA A, SAKURAI S, SHI J. Hydrogen storage and electrode properties of V-based solid solution type alloys prepared by a thermic process[J]. J Electrochem Soc, 2000, 147: 2941−2946.
[8] ELANSKI D, LIM J W, MIMURA K, ISSHIKI M. Impurity removal from Fe, Cr, Ti, and V metals by hydrogen plasma arc melting and thermodynamic estimation of hydride and sulfide formation[J]. J Alloys Comp, 2006, 421(1/2): 209−216.
[9] LI Shu-cun, ZHAO Min-shou, WANG Li-min, LIU Yan, WANG Yan-zhi. Structures and electrochemical characteristics of Ti0.26Zr0.07V0.24Mn0.1Ni0.33Mox(x=0−0.1) hydrogen storage alloys[J]. Mater Sci Eng: B, 2008, 150(3): 168−174.
[10] BASAK S, SHASHIKALA K, SENGUPTA P,KULSHRESHTHA S K. Hydrogen absorption properties of Ti-V-Fe alloys: Effect of Cr substitution[J]. International Journal of Hydrogen Energy, 2007, 32(18): 4973−4977.
[11] CHO S W, YOO J H, SHIM G, PARK C N, CHOI J. Effects of B addition on the hydrogen absorption-desorption property of Ti0.32Cr0.43V0.25alloy[J]. International Journal of Hydrogen Energy, 2008, 33(6): 1700−1705.
[12] YOO J H, SHIM G, CHO S W, PARK C N. Effects of desorption temperature and substitution of Fe for Cr on the hydrogen storage properties of Ti0.32Cr0.43V0.25alloy[J]. International Journal of Hydrogen Energy, 2007, 32(14): 2977−2981.
[13] PAN Hong-ge, LI Rui, GAO Ming-xia, LIU Yong-feng, WANG Qi-dong. Effects of Cr on the structural and electrochemical properties of TiV-based two-phase hydrogen storage alloys[J].Journal of Alloys and Compounds, 2005, 406(12): 669−674.
[14] KIM J H, LEE H, LEE P S, SEO C Y, LEE J Y. A study on the improvement of the cyclic durability by Cr substitution in V-Ti alloy and surface modification by the ball-milling process[J].Journal of Alloys and Compounds, 2003, 348(1/2): 293−300.
[15] 李 荣, 周上祺, 梁国明,刘守平, 付文升. 贮氢合金V3TiNi0.56Al0.2的电化学性能研究[J]. 中国有色金属学报, 2007,17(2): 222−227.LI Rong, ZHOU Shang-qi, LIANG Guo-ming, LIU Shou-ping,FU Wen-sheng. Electrochemical properties of V3TiNi0.56Al0.2hydrogen storage materials[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(2): 222−227.
[16] 余祖孝, 李 荣, 周上祺, 刘守平. 热处理对储氢合金V3TiNi0.56Al0.2电化学性能的影响[J]. 无机材料学报 2009,24(1): 157−160.YU Zu-xiao, LI Rong, ZHOU Shang-qi, LIANG Guo-ming, LIU Shou-ping. Effects of heat treatment on electrochemical properties of V3TiNi0.56Al0.2hydrogen storage alloy[J]. Journal of Inorganic Materials, 2009, 24(1): 157−160.
[17] 黄太仲, 吴 铸, 冯尚龙, 陈金舟, 夏保佳, 徐乃欣. V 取代TiCr 基储氢合金中部分 Cr对储氢性能的影响[J]. 中国有色金属学报, 2005, 15(1): 141−144.HUANG Tai-zhong, WU Zhu, FENG Shang-long, CHEN Jin-zhou, XIA Bao-jia, XU Nai-xin. Influence of partial substitution of vanadium for chromium on hydrogen storage performance of TiCr based alloys[J]. The Chinese Journal of Nonferrous Metals, 2005, 15(1): 141−144.
[18] 刘飞烨, 陈立新, 李 露, 贾彦敏, 雷永泉. V2.1TiNi0.4Zr0.06Cux(x=0−0.12)储氢合金的微结构及电化学性能[J]. 物理化学学报, 2008, 24(9): 1694−1698.LIU Fei-ye, CHEN Li-xin, LI Lu, JIA Yan-min, LEI Yong-quan.Microstructure and electrochemical properties of V2.1TiNi0.4Zr0.06Cux(x=0−0.12) hydrogen storage alloys[J]. Acta Phys Chim Sin, 2008, 24(9): 1694−1698.
[19] YAN Yi-gang, CHEN Yun-gui, LIANG Hao, ZHOU Xiao-xiao,WU Chao-ling, TAO Ming-da, PANG Li-juan. Hydrogen storage properties of V-Ti-Cr-Fe alloys[J]. J Alloys Comp, 2008,454(1/2): 427−431.
[20] 贾彦敏, 刘飞烨, 肖学章, 杭州明, 雷永泉, 陈立新.V2.1TiNi0.4Zr0.06Cu0.03M0.10(M=Cr, Co, Fe, Nb, Ta)储氢合金的微结构及电化学性能[J]. 物理化学学报, 2009, 25(2): 247−252.JIA Yan-min, LIU Fei-ye, XIAO Xue-zhang, HANG Zhou-ming,LEI Yong-quan, CHEN Li-xin. Microstructure and electrochemical properties of V2.1TiNi0.4Zr0.06Cu0.03M0.10(M=Cr,Co, Fe, Nb, Ta) hydrogen storage alloys[J]. Acta Phys Chim Sin,2009, 25(2): 247−252.
[21] KHALDI C, MATHLOUTHI H, LAMLOUMI J, PERCHERON G A. Electrochemical study of cobalt-free AB5-type hydrogen storage alloys[J]. J Alloys Comp, 2004, 29: 307−311.
Microstructure and electrochemical properties of V3TiNi0.56Al0.2Crx(x=0−0.3) hydrogen storage alloys
LI Rong1, ZHOU Shang-qi2, LIU Shou-ping2, LIANG Guo-ming1, SUN Yu-yang1
(1. Functional Material Laboratory, Chongqing Normal University, Chongqing 400047, China;2. College of Materials Science and Engineering, Chongqing University, Chongqing 400044, China)
The V3TiNi0.56Al0.2Crx(x=0−0.3) hydrogen storage materials were prepared by self-propagating high-temperature synthesis. The influences of Cr content on the microstructure and electrochemical properties of these alloys were studied by X-ray diffraction and electrochemical measurement. The results show that when x are 0, 0.1 and 0.2, the alloys are composed of V-based solid solution as main phase and TiNi phase. When x=0.3, the alloys are composed of V-based solid solution as main phase and laves phase of C14with hexagonal structure. The unit cell constant and the quantity of unit cell both reduce gradually with increasing Cr addition. The maximum discharge capacity of the alloy electrode is decreased by introduction of Cr, whereas the activation behavior is almost not affected. The cycling capability of the alloys are improved obviously, the capacity of V3TiNi0.56Al0.2Cr0.3alloy keeps 99% after ten times of charge, and discharge, and good discharge properties can be got under heavy current. The diffusion coefficient of hydrogen in the alloys increases with increasing Cr addition.
hydrogen storage materials; V3TiNi0.56Al0.2Crxalloy; self-propagating high-temperature synthesis;constitution microstructure; electrochemical properties
TG132.25
A
1004-0609(2010)04-0706-06
教育部科学技术研究重点资助项目(208116);重庆市自然科学基金资助项目(CSTC2009BB4243);重庆市教委科学技术资助项目(KJ090810)
2009-05-19;
2009-09-28
李 荣,教授,博士;电话:023-65910300;E-mail:rongli258@163.com
(编辑 李艳红)
