Akt/PKB对哮喘小鼠Fas表达的调节作用
2010-11-29张宝辉朱小兵刘晓湘方秀斌
张宝辉,朱小兵,刘晓湘,方秀斌
支气管哮喘是由非特异性炎症引起的以气道高反应性和气道炎症为主要特征的慢性炎症疾病。其发病机制比较复杂,许多炎性细胞因子、介质等均参与其发病过程。研究证明,神经营养因子(nerve growth factor,NGF)是通过作用于炎症细胞、神经元,参与哮喘时的气道炎症反应、气道收缩和气道高反应性的。最近有研究报道,Akt/PKB参与了哮喘发病机制中NGF介导的信号传导通路,我们既往的实验[1]也证明了Akt/PKB能上调肺及C7-T5段脊神经节及相应脊髓后角IL-1β的表达,以及肺组织内血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)的表达[2],说明 Akt/PKB 很可能通过对细胞因子IL-1β和VEGF的表达来参与NGF介导的哮喘发病机制,而Akt/PKB作为磷酸肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)的一个重要的下游调节激酶,在细胞抗凋亡过程中亦起着重要的作用,它是否通过调节细胞凋亡信号的转导来参与NGF介导的哮喘发病机制呢?凋亡因子Fas分子可在多种细胞广泛表达,具有介导细胞凋亡、调节炎症反应及多种免疫生理病理作用,有研究证明[3],皮质激素及平喘灵均可通过调节Fas的表达来诱导哮喘模型肺组织嗜酸性粒细胞、淋巴细胞等炎症细胞的凋亡,进而实现支气管哮喘的治疗,咳喘罗通过上调EOS内Fas蛋白、肺组织内FasL以及下调EOS内Bcl-XL的表达来诱导或加速EOS凋亡[4],T细胞表达Fas不足可以导致小鼠形成长期过敏性气道炎症,提示人的T细胞内缺少Fas受体也能够导致哮喘[5],炎症期和纤维化期大鼠肺组织细胞凋亡率增加,Fas/FasL表达增多,而灯盏花素能明显降低肺组织的凋亡率,下调Fas/FasL的阳性表达[6]。但Akt/PKB能否通过调节Fas分子的表达参与哮喘仍未见文献报道,本研究利用免疫荧光、Western blot方法检测Fas的表达,了解Akt/PKB在哮喘的发病中能否调节Fas分子的表达。
1 材料与方法
1.1 实验动物分组及模型制备 ♂BALB/c小鼠30只,由首都医科大学实验动物中心提供。按随机数字表法分为:①哮喘组10只,d1每只小鼠腹腔注射20 μg OVA(Sigma公司)和2 mg氢氧化铝混合于0.5 ml PBS中,d 8、d 15每只小鼠腹腔注射10 μg OVA和1 mg氢氧化铝混合于0.5 ml PBS中,d16开始将小鼠置于封闭容器中,给予4%OVA(PBS配成)雾化吸入激发哮喘发作,每天1次,每次25 min,连续7 d;②Akt/PKB阻断组,d19开始雾化吸入前3 h鼻腔给Akt/PKB阻断剂-LY-294002(0.3 mg·kg-1),其余均与哮喘组相同;③ 正常对照组,以PBS代替OVA注射和雾化吸入,其余均与哮喘组相同。各组最后1次激发后24 h处死。
1.2 肺功能仪测气道反应性 用0.4%的戊巴比妥钠腹腔麻醉小鼠(80 mg·kg-1),疼痛反射消失后固定在小鼠体描箱内操作台上,气管插管,呼吸比15∶10,呼吸频率90次/分,游离颈外静脉,行静脉穿刺,固定针柄,封闭体描箱。乙酰甲胆碱(mACh)用磷酸缓冲液(0.1 mol·L-1pH 7.4)配成0.025、0.05、0.075、0.1 mg·ml-1经颈外静脉各注射 0.1 ml记录波形和数据。
1.3 免疫荧光 动物用0.4%的戊巴比妥钠腹腔麻醉(40 mg·kg-1体质量),用4%多聚甲醛灌流固定,将组织后固定24 h,移入30%蔗糖缓冲液中至标本下沉,OCT包埋,恒冷箱切片机连续切片(片厚8 μm),冷风干燥后,室温下血清封闭20 min,甩干,滴加一抗Fas(购自武汉博士德生物公司)工作浓度为1∶150,4℃孵育过夜,PBS充分洗涤,滴加工作浓度为1∶100 FITC标记的二抗(购自Sant Crutz公司),孵育40 min,PBS充分洗涤,甘油封片,用 O-lympus BX51型荧光显微镜进行观察。绿色荧光为阳性表达。
1.4 Western blot免疫蛋白印记 动物用0.4%戊巴比妥钠腹腔麻醉(40 mg·kg-1),取C7-T5节段脊神经,置于裂解液中机械匀浆,4℃ 17 000 r·min-1离心1 h,吸出上清液,弃去沉淀。用考马斯亮蓝G250结合法,根据已知牛血清白蛋白溶液的浓度及其吸光度和样品吸光度计算出样品蛋白浓度和加样量。加入样品缓冲液,然后将样品置于沸水浴中加热5 min使蛋白质变性。将制备好的样品置于-20℃冰箱备用。制备12%分离胶,4%浓缩胶,用微量加样器将样品加在凝胶表面样品槽中。电泳后湿转至硝酸纤维素膜上。5%脱脂奶粉TTBS缓冲液4℃过夜。一抗Fas、β-actin(1∶200)室温孵育2 h,洗膜,辣根酶标记羊抗兔 IgG-HRP(1∶5 000,Santa Cruz)室温孵育1 h,洗膜后加入 ECL(enhanced chemiluminescence)试剂(Santa Cruz)反应1 min,暗室曝光显影后冲洗胶片。凝胶成像分析系统上摄像分析,测得目标带的IDV,进而计算出各组样品Fas目标带的IDV与内参照β-actin IDV的比值。
1.5 统计学处理 采用SPSS 13.0统计软件对数据进行统计分析,结果用±s表示,组间比较进行t检验。
2 结果
2.1 哮喘模型制作结果 本实验中正常对照组雾化吸入生理盐水后无明显哮喘反应,哮喘组动物在雾化吸入卵蛋白3次后,大部分哮喘发作,表现为呼吸频率加深加快,肋间隙凹陷,刺激性呛咳;Akt/PKB阻断组动物,前3次雾化吸入卵蛋白后,大部分哮喘发作,应用阻断剂后,诱喘反应不明显。
2.2 肺功能仪测气道阻力 哮喘组小鼠对mACh的浓度反应曲线明显上移,其呼气阻力和吸气阻力明显高于正常组(P<0.01),证明哮喘模型建立成功;Akt/PKB阻断组对mACh的浓度反应曲线明显低于哮喘组(P<0.01),提示Akt/PKB对哮喘的气道高反应有调节作用。

Fig 1 Values of inpiratory resistence(Ri)measured by AniRes 2005 meter
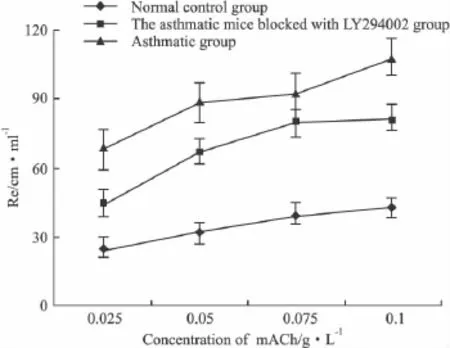
Fig 2 Values of expiratory resistence(Re)measured by AniRes 2005 meter
2.3 免疫荧光结果 从图片上可以看出,哮喘组小鼠的C7-T5节段脊神经节(Fig3 1b)和相应节段脊髓后角(Fig3 2b)的Fas蛋白表达量明显低于正常对照组,显微图像分析也证明,哮喘组Fas阳性反应产物MOD值明显低于对照组。Akt/PKB阻断组小鼠C7-T5节段脊神经节(Fig3 1c)、C7-T5节段脊髓后角(Fig3 2c)的Fas的表达量明显高于哮喘组的表达量。显微图像分析表明,Akt/PKB阻断组Fas阳性反应产物MOD值明显高于哮喘组(P<0.01,Tab 1)。
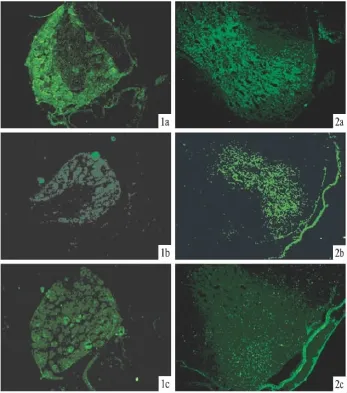
Fig 3 The expression of Fas was observed by immunofluorescenceThe expression of Fas in the C7-T5spinal ganglia of(1a):normal control group;(1b):asthmatic group;(1c):Akt/PKB blocked with LY294002 group.The expression of Fas in the C7-T5spinal dorsal horn of(2a):normal control group;(2b):asthmatic group;(2c):Akt/PKB blocked with LY294002 group
Tab 1 Comparison of MOD values of Fas immunoreactivity in all group±s)

Tab 1 Comparison of MOD values of Fas immunoreactivity in all group±s)
**P<0.01 vs control group;##P<0.01 vs asthmatic group
Group Spinal ganglia of C7-T5 Spinal dorsal horn of C7-T5 Normal control 37.68 ±1.15## 20.16 ±1.46##Asthmatic 18.25 ±0.76** 9.52 ±0.83**Akt/PKB blocked with LY294002 24.36 ±1.21**## 13.18 ±0.52**##
2.4 Western blot结果 与正常对照组相比,哮喘组小鼠C7-T5脊神经的Fas蛋白表达量明显减少(P<0.05),而Akt/PKB阻断组Fas蛋白表达量比哮喘组明显增加(P<0.05),说明经鼻腔滴入Akt/PKB阻断剂(LY-294002)效果比较确切(Fig 4),各组样品Fas目标带的IDV与内参照IDV的比值见Tab 2。
Tab 2Comparison of Fas(IDV)/β-actin(IDV)±s)

Tab 2Comparison of Fas(IDV)/β-actin(IDV)±s)
*P<0.05 vs control group;#P<0.05 vs asthmatic group
Group C7-T5spinal cord Normal control 2.527 ±0.021#Asthmatic 2.011 ±0.020*Akt/PKB blocked with LY294002 2.256 ±0.018#*

Fig 4 The expression of Fas and β-actin was detected by Western blot.1:Normal control group;2:Asthmatic group;3:The asthmatic mice blocked with LY-294002 group
3 讨论
本室以往的实验发现[7-9],NGF 能够上调哮喘小鼠体内SH2-Bβ和Akt的表达,提示在NGF介导的哮喘发病机制中,NGF上调其下游底物SH2-Bβ和Akt的表达是它参与哮喘发病机制调节的途径之一,以往的研究证明Akt/PKB能上调肺及C7-T5段脊神经节及相应脊髓后角内IL-1β的表达,也能上调肺组织内VEGF的表达,说明Akt/PKB很可能通过对细胞因子IL-1β和VEGF的表达来参与哮喘的发病机制。
从免疫荧光结果可以看出,哮喘组小鼠的C7-T5节段脊神经节和相应节段脊髓后角的Fas的荧光表达量明显低于正常对照组,而Akt/PKB阻断组小鼠的Fas的荧光表达量亦明显高于哮喘组,但较对照组则明显降低,而Western blot结果也证明,哮喘组小鼠C7-T5脊神经的Fas蛋白表达量与正常对照组相比明显减少(P<0.05),而Akt/PKB阻断组Fas蛋白表达量比哮喘组明显增加(P<0.05),结果提示Akt/PKB很可能是通过上调Fas的表达来参与NGF介导的哮喘发病机制。
本实验的结果提示利用Akt阻断剂直接或间接调节Fas的表达可能是治疗哮喘的新途径。
[1]张宝辉,刘玉丽,方秀斌,等.Akt对哮喘小鼠下呼吸道及内脏感觉传入部位IL-1β表达的影响[J].解剖科学进展,2007,13(4):289-92.
[1]Zhang B H,Liu Y L,Fang X B,et al.The upregulatory effect of Akt/PKB on IL-1β in the lower respiratory tract and viscerosensory afferent sites of the asthmatic mice[J].Progr Anat Sci,2007,13(4):289-92.
[2]张宝辉,刘玉丽,方秀斌,等.Akt对哮喘小鼠肺组织VEGF表达的上调作用[J].解剖科学进展,2008,14(1):39 -42.
[2]Zhang B H,Liu Y L,Fang X B,et al.The upregulative effect of Akt/PKB on vegf in the lung of the asthmatic mice[J].Progr Anat Sci,2008,14(1):39 -42.
[3]刘永琦,李金田,李 娟,等.平喘灵对哮喘大鼠血浆环磷酸腺苷、环磷酸鸟苷含量及气道炎症细胞Fas表达的影响[J].中医杂志,2007,48(1):72 -4.
[3]Liu Y Q,Li J T,Li J,et al.Effect of pingchuanling on the content of serum cAMP and cGMP and expression of Fas in tracheal inflammatory cells in asthma rats[J].J Tradit Chin Med,2007,48(1):72-4.
[4]张英兰,吴银根.咳喘落口服液对哮喘模型小鼠肺组织中嗜酸性粒细胞凋亡及调控因素的影响[J].中西医结合学报,2008,6(6):600-5.
[4]Zhang Y L,Wu Y G.Effects of Kechuanluo oral liquid on eosinophil apoptosis and its regulation factors in lung tissues of asthmatic mice[J].Zhong Xi Yi Jie He Xue Bao,2008,6(6):600 - 5.
[5]Tong J,Bandulwala H S,Clay B S,et al.Fas-positive T cells regulate the resolution of airway inflammation in a murine model of asthma[J].J Exp Med,2006,203(5):1173 -84.
[6]柴文戍,翟声平,武素琳,等.灯盏花素对实验性肺纤维化大鼠的干预作用[J].中国药理学通报,2008,24(1):113 -6.
[6]Chai W S,Zhai S P,Wu S L,et al.The effect of breviscapine on pulmonary fibrosis induced by bleomycin in rats[J].Chin Pharmacol Bull,2008,24(1):113 - 6.
[7]刘玉丽,曹国龙,方秀斌,等.NGF对哮喘小鼠气道阻力和肺组织Akt/PKB表达的影响[J].解剖科学进展,2006,12(04):304-6.
[7]Liu Y L,Cao G L,Fang X B,et al.The regulatory effect of NGF on airway resistance and the expression of Akt/PKB in the lung of the asthmatic mouse[J].Progr Anat Sci,2006,12(4):304 -6.
[8]Liu Y L,Zhang B H,Fang X B,et al.NGF mediated SH2-bβ/Akt signal pathway activated in allergic airway challenge in mice[J].Respirology,2010,15(1):80 -4.
[9]齐金萍,王巧玲,金 韵,等.地塞米松抑制哮喘小鼠SH2-Bβ蛋白表达[J].中国药理学通报,24(11):1501-4.
[9]Qi J P,Wang Q L,Jin Y,et al.The inhibitory effect of dexamethasone on the expression of SH2-Bβ protein in a murine model of asthma[J].Chin Pharmacol Cull,2008,24(11):1501 - 4.
