甘薯果胶单糖构成及黏度分析*
2010-11-28梅新木泰华
梅新,木泰华
(中国农业科学院农产品加工研究所,北京,100193)
甘薯果胶单糖构成及黏度分析*
梅新,木泰华
(中国农业科学院农产品加工研究所,北京,100193)
以甘薯渣为原料制备果胶,采用高效离子交换色谱测定果胶单糖构成,滴定法测定果胶酯化度(DE),并利用扫描电镜对果胶粉及果胶凝胶显微结构进行观察,进而探讨了温度、pH值、剪切速率、Ca2+浓度对果胶溶液黏度的影响。结果表明:果胶单糖含量高低顺序为半乳糖醛酸(79.23%)>半乳糖(9.48%)>鼠李糖(7.38%) > 葡萄糖醛酸(3.76%) > 木糖(3.74%) > 葡萄糖(1.47%) > 阿拉伯糖(1.23%),DE 为 31.71%。甘薯果胶粉呈不规则片状,而其凝胶则具有多孔网状结构。随着温度升高,果胶溶液黏度均呈下降趋势;pH值对黏度的影响较大,pH值5.0和9.0时,果胶溶液黏度最高,分别为3.82mP·s和3.65mP·s;随着剪切速率增大果胶溶液黏度迅速降低后趋于稳定;Ca2+能显著提高果胶溶液黏度,且在0~50 mmol/L内,Ca2+浓度与果胶溶液黏度值间存在一定正相关。
甘薯果胶,单糖构成,酯化度,黏度特性
甘薯渣作为淀粉生产过程中产生的副产物,通常被当作废物丢弃或作为饲料简单利用,造成资源的浪费和环境污染。甘薯渣中富含的果胶,约占干渣质量的20%[1],如何开发利用薯渣中果胶资源已成为当前重要研究课题。
果胶是一类富含半乳糖醛酸的多糖的总称,主要存在于植物的细胞壁中[2]。根据主链和侧链的不同,果胶存在3种不同结构类型:(1)半乳糖醛酸聚糖(HGA),它是一种线状多聚体,由半乳糖醛酸通过α-1,4糖苷键链接而成[3];(2)鼠李半乳糖醛酸聚糖Ⅰ(RG-Ⅰ),主链由重复的二糖(1,4-α-半乳糖-1,2-α-鼠李糖)构成,其中鼠李糖残基的O-4被由阿拉伯糖和半乳糖组成的中性糖侧链取代[4];(3)鼠李半乳糖醛酸聚糖Ⅱ(RG-Ⅱ),它的主链由较短聚半乳糖醛酸组成,其侧链由多种单糖构成[5]。果胶链中有部分半乳糖醛酸与甲氧基、乙酰基和酰胺基通过酯键相连而被酯化,被酯化的半乳糖醛酸占果胶中总的半乳糖醛酸比例称为酯化度(DE),按DE高低可以将果胶分为高DE果胶(DE>50%)和低DE果胶(DE<50%)[6],未被酯化的半乳糖醛酸残基使得果胶在水溶液中带一定量负电荷。
单糖构成可间接反映果胶结构,目前,果胶单糖测定方法主要有高效阴离子交换色谱法(HPAEC)[7]和气液相色谱法(GLC)[8],与 HPAEC法相比,GLC法步骤较为繁琐,单糖水解后需要衍生才能测定,而不完全衍生会造成单糖含量测定值偏低于实际值[9]。Salvador等[10]和 Noda 等[11]以草酸铵法制备的甘薯果胶为材料,采用HPEAC法测定了其单糖构成,结果表明甘薯果胶主要由糖醛酸(包括半乳糖醛酸和葡萄糖醛酸)、半乳糖、阿拉伯糖、鼠李糖构成,其糖醛酸含量分别60.4%和47.0%。目前,在食品工业中,尤其是在乳制品行业中[12-14],果胶主要作为增稠剂和稳定剂使用,黏度是衡量果胶增稠或稳定效果的一个重要指标。此外,果胶黏度特性还与其降血脂的效果有关,高黏度果胶具有更好降血脂效果[15]。果胶溶液黏度不仅与果胶本身特征(DE、分子质量)及浓度有关,还受到溶液pH值、溶剂中离子强度、温度及外界剪切力影响[16]。在前人研究中,果胶黏度特性研究主要集中于分子质量、DE、温度对果胶固有黏度影响[17-18],较少涉及果胶溶液表观黏度研究。本研究采用酸提法制备甘薯果胶,并在对甘薯果胶单糖组成和DE进行分析基础上,探讨了温度、pH值、剪切速率和Ca2+浓度对果胶溶液表观黏度的影响。
1 材料与方法
1.1 材料
新鲜甘薯由北京市密云县原种场提供,品种为密选1号,提取淀粉后废渣,水洗,60℃烘干,粉碎,过100目筛,4℃下密封放置备用。经测定本试验所用干薯渣中总果胶含量为10.36%。
1.2 主要仪器与试剂
1.2.1 主要仪器
LXJ-IIB低速大容量多管离心机,上海安亭科学仪器厂;LGJ-10型冷冻干燥机,北京四环科学仪器厂;Ro(NaF-40)-UF-4010实验用膜分离超滤装置,上海亚东核级树脂有限公司;S-570型扫描电子显微镜,日立;离子色谱 ICS-3 000,Dionex;Physica MCR301流变仪,Anton Paar;TA.XT2质构仪:Stable Micro System。
1.2.2 主要试剂
α-淀粉酶、半乳糖醛酸、葡萄糖醛酸、鼠李糖、阿拉伯糖、半乳糖、木糖、葡萄糖标品,均购自Sigma公司,Viscozyme L9复合多糖酶购自诺维信,其他试剂均为化学纯。
1.3 实验方法
1.3.1 果胶制备
取一定量薯渣,糊化去淀粉后,残渣干燥,粉碎过100目筛。取过筛残渣按1∶20的比例(g∶mL)加水悬浊,1 mol/L的 HCl调节 pH值至1.5,悬浮液于95℃下水浴振荡2.2 h,离心收集上清,1 mol/L的NaOH调节上清液pH值至中性,并用截留分子质量为10 ku的超滤膜浓缩上清,浓缩液与3倍体积无水乙醇混合,静置1h沉淀果胶,离心收集沉淀,冻干粉碎后得果胶粉。
1.3.2 果胶单糖构成测定
果胶水解和单糖测定均参照Garna等[19]方法。先用三氟乙酸水解果胶,水解液再用Viscozyme L9复合多糖酶继续水解成单糖,单糖构成用带有脉冲安培检测器的HPAEC(离子色谱 ICS-3000)进行测定,中性糖采用等度洗脱,糖醛酸采用梯度洗脱。用浓度为0.1~10 mg/kg的标准溶液用于制作标准曲线,标准溶液中含有鼠李糖、阿拉伯糖、木糖、葡萄糖、半乳糖等中性糖以及糖醛酸(半乳糖醛酸、葡萄糖醛酸)。
1.3.3 果胶DE测定
参照Pinheiro等的[6]方法测定DE值。
1.3.4 果胶溶液黏度测定
探讨不同温度(10 ~90℃)、pH 值(2,3,4,5,6,7,8,9,10)、Ca2+浓度(1,5,10,20,30,40,50 mmol/L)、剪切速率(1~1 000 s-1)对果胶溶液黏度的影响。
不同条件下甘薯果胶溶液黏度测定采用应变控制流变仪(Physica MCR301 Anton Paar)进行,锥板直径50 mm,锥角1°,锥板和平板间距为0.047 mm,果胶浓度10 g/L。在不探讨测定温度、pH值、剪切速率和Ca2+浓度对果胶溶液黏度影响的条件下,温度、pH值、剪切速率和 Ca2+浓度分别为 25℃,5.0,50 s-1和0 mmol/L。
本研究中,没有特殊说明,所有黏度值均为果胶溶液的表观黏度。
1.3.5 果胶凝胶质构及扫描电镜分析
果胶凝胶制备参照 Takamine等[1]方法,0.7 g 果胶和6.0 g蔗糖加入45 mL蒸馏水中,完全溶解后加入1.75 mL乳酸缓冲液(pH值3.5),混合液加热至沸腾后立即加入15.0 g蔗糖,再缓慢加入6.3 mL 0.1mol/L的 CaCl2,同时以5 000 r/min转速均质混合液至其混合均匀,继续煮沸至混合液净重(70±0.5)g,后去除表面泡沫,迅速将其倒入无菌培养皿(直径40mm,高15mm)中,封口冷却。凝胶形成后于5℃下放置16 h,采用TA.XT2质构仪测定凝胶硬度、胶黏性、咀嚼性、黏结性、弹性和回复性等质构参数。
采用日立S-570型扫描电子显微镜将果胶粉及冻干后果胶凝胶样品经过黏台、喷金等步骤后,在加速电压为12 kV的条件下用扫描电子显微镜进行观察。
1.3.6 统计分析
所有试验均重复3次,试验数据采用平均数±标准差(mean±SD)表示,用DPS 7.55统计软件进行方差分析,以P<0.05为显著性检验标准。
2 结果与讨论
2.1 果胶单糖组成及酯化度
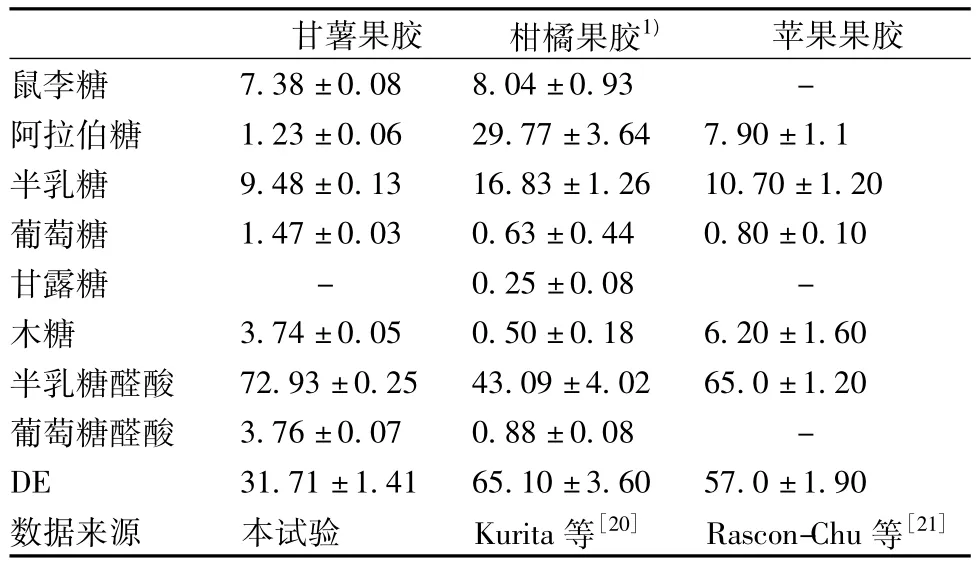
表1 三种不同果胶单糖构成及酯化度的比较 %
表1中比较了酸法制备的甘薯、柑橘和苹果果胶的单糖构成。结果表明,与其他2种果胶相比,甘薯果胶半乳糖醛酸含量最高为72.93%,中性糖含量最低为23.3%,中性糖由高到低的顺序分别为半乳糖9.48%、鼠李糖7.38%、木糖3.74%、葡萄糖1.47%、阿拉伯糖1.23%,另外还含有3.76%葡萄糖醛酸。柑橘果胶半乳糖醛酸含量最低43.09%,中性糖含量最高56.03%,中性糖由高到低顺序分别为阿拉伯糖29.77%、半乳糖 16.83%、鼠李糖 8.04%、葡萄糖0.63%、木糖 0.50%、甘露糖 0.25%。此外,葡萄糖醛酸含量为0.88%;苹果果胶半乳糖醛酸和中性糖含量处于前两者之间,分别为65.0%和33.5%,中性糖由高到低分别为半乳糖10.70%、阿拉伯糖7.9%、木糖 6.2%、葡萄糖 0.80%。甘薯果胶酯化度为31.71%,属于低DE果胶,而柑橘果胶和苹果果胶酯化度分别为65.10%和57.0%,属于高DE果胶。由此可见,不同材料,其果胶单糖构成和DE明显不同。
果胶单糖构成上的差异,可间接反映果胶产品结构上差异。鼠李糖含量较多说明甘薯果胶中RG-Ⅰ含量可能较高;阿拉伯糖和半乳糖含量高低则与侧链有关[5]。与 Salvador等[10]采用草酸铵法提取的甘薯果胶相比,在本试验中采用酸提法制备的甘薯果胶半乳糖醛酸含量较高,阿拉伯糖和半乳糖含量低,鼠李糖含量相近,说明本试验制备的果胶侧链较少,这可能是由于制备果胶时高温低pH值的条件导致侧链水解。此外,相同提取方法制备甘薯果胶单糖构成之间也存在差异,与Salvador等结果相比,Noda等[11]采用草酸铵法提取的甘薯果胶中糖醛酸、半乳糖含量较低,阿拉伯糖含量相近,葡萄糖和鼠李糖含量较高,这两者间差异可能与各自所用甘薯品种有关,Koubala等[8]的研究证实提取方法和芒果品种均对芒果果胶单糖构成有明显影响。
2.2 温度对果胶溶液黏度的影响
如图1所示,pH值5.0条件下,果胶浓度10 g/L时,随着温度升高,果胶溶液黏度明显呈下降趋势,温度超过50℃,黏度下降速率减缓。温度为10℃时,果胶溶液黏度高达13.0 mP·s,而温度升高到90℃时,黏度降至1.66 mP·s。这可能是随着温度升高,果胶分子热运动加剧,分子间相互作用力减弱,在恒定的剪切速率下,黏度也随之下降。
2.3 pH值对果胶溶液黏度的影响
图2结果显示,pH值从2.0升高到10.0过程中,果胶溶液黏度呈“M”型变化。在3个拐点中,pH值5.0和9.0处于顶点,黏度较高,黏度分别为3.82 mP·s和 3.65 mP·s,而 pH 值 7.0 处于底点,黏度低,仅为3.17 mP·s。较低pH值下,果胶中半乳糖醛酸的羧基电离受到抑制,溶液中分子间静电作用减弱,伸展的果胶分子发生卷曲,溶液黏度降低。较高pH值条件下,溶液中较高的离子浓度屏蔽了果胶分子间静电作用,同样造成果胶分子卷曲和黏度降低。在中性pH值下,溶液中几乎没有离子存在,静电作用较弱,黏度降低。在pH值5.0和9.0时,可能是果胶分子带净电荷较多,分子间静电作用较强,果胶分子在溶液中较为伸展,黏度大[22]。
2.4 剪切速率对果胶溶液黏度的影响
图3结果表明,剪切速率对果胶溶液黏度有明显影响。在1~1 000s-1范围内,随着剪切速率升高,果胶溶液出现剪切变稀现象,呈现非牛顿流体的特征。剪切速率为1 s-1时,果胶溶液黏度为15.0 mP·s,当剪切速率上升到1 000 s-1时,黏度只有3.72 mP·s。剪切速率超过35 s-1时,剪切速率对果胶溶液黏度影响较小,溶液黏度趋于稳定,这可能是由于剪切速率超过35 s-1所形成的剪切力远远超过溶液中果胶分子间相互作用力。
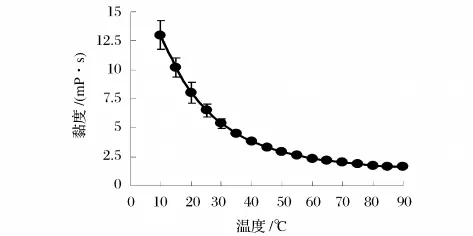
图1 温度对果胶溶液黏度的影响
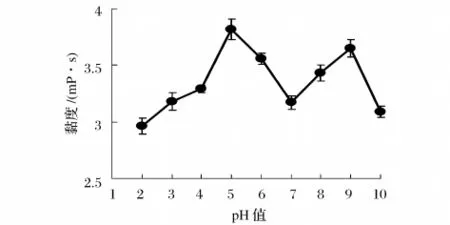
图2 pH值对果胶溶液黏度的影响
2.5 Ca2+浓度对果胶溶液黏度的影响
图4结果表明,Ca2+明显影响果胶溶液黏度,随着Ca2+浓度升高,溶液粘滞性明显增强,黏度增大。在Ca2+浓度为0~50 mmol/L范围内,Ca2+浓度与果胶溶液黏度呈一定相关性,相关系数R2=0.88。没有Ca2+存在条件下,果胶溶液黏度为3.83 mP·s,而Ca2+浓度为50 mmol/L时,果胶溶液黏度达到了1 067.64 mP·s。甘薯果胶属于低 DE果胶(31.71%),果胶链上仍有部分半乳糖醛酸未被酯化,未酯化的半乳糖醛酸因电离而形成带负电荷的羧基,它能与Ca2+之间形成离子键,一个Ca2+能与2个半乳糖醛酸残基结合,由此,导致果胶分子之间因Ca2+存在而相互交联[23],溶液黏度随之增加。
2.6 果胶凝胶质构特性及显微结构

图3 剪切速率对果胶溶液黏度的影响

图4 Ca2+浓度对果胶溶液黏度的影响

图5 果胶粉形态(左)及果胶显微结构(右)
低DE的甘薯果胶溶液加入30%蔗糖和0.1%CaCl2后,能形成稳定凝胶。经测定,凝胶的硬度、胶黏性、咀嚼性、黏结性、弹性和回复性分别为46.09 g、26.09、24.98、0.57、0.96 以及 0.013。除回复性外,其余各项质构指标均高于高DE的苹果果胶形成的凝胶[21]。冻干粉碎后甘薯果胶粉末很膨松,白色,有光泽,堆积密度为0.1 g/cm ,扫描电镜结果(图5)显示,放大100倍后果胶粉呈不规则的片状结构,而冻干后的果胶凝胶则呈多孔的网状结构,水分子被包裹在内,这可能是果胶和Ca2+相互交联而成,这种多孔网状结构也存在于其他低DE果胶的凝胶结构中[23]。
3 结论
为了充分合理利用甘薯资源,以淀粉生产废弃物甘薯渣为原料,采用酸提法制备的甘薯果胶呈白色,有光泽,呈不规则的片状显微结构。单糖构成分析结果表明,甘薯果胶主要由半乳糖醛酸、半乳糖、鼠李糖、葡萄糖醛酸、木糖、葡萄糖、阿拉伯糖组成,其含量分别为 72.93%、9.48%、7.38%、3.76%、3.74%、1.47%、1.23%,DE 为31.71%,属于低 DE 果胶。
温度、pH值、剪切速率和Ca2+浓度均对果胶溶液黏度有显著地影响,温度升高,黏度降低,pH值5.0和9.0 时黏度最高,黏度分别为 3.82 mP·s和3.65 mP·s,随着剪切速率增加,果胶溶液出现剪切变稀现象,Ca2+可与果胶中未酯化的半乳糖醛酸结合,显著提高溶液黏度。当果胶浓度10 g/L,溶液中分别添加30%蔗糖和0.1%CaCl2时,能形成具有多孔网状显微结构的凝胶。
[1] Takamine K,Abe J,Shimono K,et al.Physicochemical and gelling characterization of pectin extracted from sweet potato pulp[J].Journal of Applied Glycoscience,2007,54:211-216.
[2] Faravash R S,Ashtiani F Z.The effect of pH,ethanol volume and acid washing time on the yield of pectin extraction from peach pomace[J].International Journal of Food Science and Technology,2006,42:1 177-1 187.
[3] Willats W G T,McCartney L,Mackie W,et al.Pectin:cell biology and prospects for functional analysis[J].Plant Molecular Biology,2001,47:9-27.
[4] Westereng B,Michaelsen T E,Samuelsen A B,et al.Effects of extraction conditions on the chemical structure and biological activity of white cabbage pectin[J].Carbohydrate Polymers,2008,72:32-42.
[5] Mohnen D.Pectin structure and biosynthesis[J].Plant Biology,2008,11:266-277.
[6] Pinheiro E R,Silva I M D A,Gonzaga L V,et al.Optimization of extraction of high-ester pectin from passion fruit peel(Passiflora edulis flavicarpa)with citric acid by using response surface methodology[J].Bioresource Technology,2008,99:5 561-5 566.
[7] Yapo B M,Wathelet B,Paquot M.Comparison of alcohol precipitation and membrane filtration effects on sugar beet pulp pectin chemical features and surface properties[J].Food Hydrocolloids,2007,21:245-255.
[8] Koubala B B,Kansci G,Mbome L I,et al.Effect of extraction conditions on some physicochemical characteristics of pectins from “Améliorée”and “Mango”mango peels[J].Food Hydrocolloids,2008,22:1 345-1 351.
[9] Garna H,Mabon N,Nott K,et al.Kinetic of hydrolysis of pectin galacturonic acid chains and quantification by ionic chromatography[J].Food Chemistry,2006,96:477-484.
[10] Salvador L D,Suganuma T,Kitahara K,et al.Monosaccharide composition of sweetpotato fiber and cell wall polysaccharides from sweetpotato,cassava,and potato analyzed by the high-performance anion exchange chromatography with pulsed amperometric detection method [J].Journal of Agricultural and Food Chemistry,2000,48:3 448-3 454.
[11] Noda T,Takahata Y,Nagata T,et al.Chemical composition of cell wall material from sweet potato starch residue[J].Starch/Störke.1994,46(6):232-236.
[12] 何楚莹,郑小平,徐致远.几种单体胶在酸奶中的应用研究[J].乳业科学与技术,2008(5):219-221.
[13] 徐致远,周凌花,王荫榆.卡拉胶瓜尔豆胶与果胶复配在酸奶中的应用[J].乳业科学与技术,2009(6):259-262.
[14] 曾令平,常忠义,高红亮.水溶性大豆多糖和果胶作为酸性乳饮料稳定剂的研究[J].中国乳品工业,2008,36(11):25-28.
[15] Terpstra A H M,Lapre J A,de Vries H T,et al.Dietary pectin with high viscosity lowers plasma and liver cholesterol concentration and plasma cholesteryl ester transfer protein activity in hamsters[J].Nutrient Metabolism,1998,128(11):1 944-1 949.
[16] Arslan N,Kar F.Filtration of sugar-beet pulp pectin extract and flow properties of pectin solutions[J].Journal of Food Engineering,1998,36:113-122.
[17] Yoo S H,Fishman M L,Hotchkiss A T,et al.Viscometric behavior of high-methoxy and low-methoxy pectin solutions[J].Food Hydrocolloids,2006,20:62-67.
[18] Arslan N,Kar F.Effect of temperature and concentration on viscosity of orange peel pectin solutions and intrinsic viscosity-molecular weight relationship[J].Carbohydrate Polymers,1999,40:277-284.
[19] Garna H,Mabon N,Wathelet B,et al.New method for a two-step hydrolysis and chromatographic analysis of pectin neutral sugar chains[J].Journal of Agricultural and Food Chemistry.2004,52(15):4 652-4 659.
[20] Kurita O,Fujiwara T,Yamazaki E.Characterization of the pectin extracted from citrus peel in the presence of citric acid[J].Carbohydrate polymers,2008,74(3):725-730.
[21] Ras?on-Chu A,Martínez-Lóp,A L,Carvajal-Millán E,et al.Pectin from low quality 'Golden Delicious'apples:Composition and gelling capability[J].Food Chemistry,2009,116:101-103.
[22] Cho S S,Dreher M L.Hand book of dietary fiber[M].New York:Marcel Dekker,2001:195-199.
[23] Lootens D,Capel F,Durand D,et al.Influence of pH,Ca concentration,temperature and amidation on the gelation of low methoxyl pectin [J].Food Hydrocolloids,2003,17:237-244.
Analysis on Sugar Composition and Its Viscosity Properties of Sweet Potato Pectin
Mei Xin,Mu Tai-hua
(Institute of Agro-Food Science and Technology,CAAS,Beijing 100193,China)
Pectin was extracted from sweet potato residues.Sugar composition and degree of esterification(DE)of pectin were determined by high performance anion exchange chromatography and titration method respectively.Microstructure of pectin powder and pectin gel was observed by scanning electron microscope.The effect of temperature,pH,shear rate and Ca2+concentration on viscosity of pectin solution were also investigated.The results showed that The order of sugar composition in sweet potato pectin was galacturonic acid(79.23%) >galactose(9.48%) >rhamnose(7.38%) >glucuronic acid(3.76%) >xylose(3.74%) > glucose(1.47%) >arabinose(1.23%),DE was 31.71%.The microstructure of pectin powder was irregular flake-like,whereas the pectin gel had a porous network form.The viscosity of pectin solution decreased when the temperature was increasing;pH affected viscosity obviously,pectin solution had higher viscosity at the pH 5.0 and 9.0,and the value were 3.82mP·s and 3.65mP·s respectively.With increasing the shear rate,viscosity decreased rapidly,and then trended to steady;Ca2+could improve the viscosity of pectin solution remarkably,in the extent of 0~50 mmol/L,there was positive relationship between Ca2+concentration and viscosity of pectin solution.
sweet potato pectin,sugar composition,degree of esterification,viscosity properties
硕士研究生(木泰华研究员为通讯作者,E-mail:mutaihuacaas@126.com)。
*现代甘薯农业技术体系建设专项(nycytx-16-B-16)
2010-04-01,改回日期:2010-06-23
