外周血间充质干细胞移植对球囊损伤兔血管平滑肌细胞凋亡的影响
2010-11-27王正龙王冬梅许官学
郭 艳 石 蓓 王正龙 王冬梅 许官学
(遵义医学院第一附属医院心血管内科,遵义 563003)
引言
经皮冠状动脉介入治疗(percataneous coronary artery interventional therapy,PCI)是临床上治疗冠心病最有效的血运重建手段,但其术后再狭窄问题一直是影响其远期疗效的重要因素;目前认为PCI术后再狭窄的发生可能与内皮损伤、平滑肌细胞增殖和迁移致新近内膜增生等病理损伤修复反应有关。研究发现间充质干细胞(mesenchymal stem cells,MSCs)除具有多向分化潜能外,还能分泌血管内皮生长因子(vascular endothelial growth factor,VEGF)等多种细胞因子,在干细胞分化成心肌细胞及血管内皮中发挥积极作用,但其是否参与血管损伤修复及在其中扮演的角色目前尚不清楚。本研究拟通过观察MSCs移植后的归巢情况,以及模型兔血管内膜增生过程中平滑肌细胞凋亡率的变化,初步探讨MSCs对模型兔球囊成形术后内膜增生的抑制作用及可能机制。
1 材料与方法
1.1 材料
1.1.1 动物模型与分组
60只新西兰雄性大白兔,体重(2.0±0.5)kg。随机分为MSCs移植组(n=30);对照组(n=30)。其中两组动物均构建动脉粥样硬化狭窄模型并接受球囊成形术,移植组接受MSCs移植,对照组接受同等体积的无血清培养液注射。两组均分别于术后7、14、28 d(n=10)分别采集外周血标本(用于另一部分实验内容),留取病变侧及作为对照的对侧血管段标本,分别截取每份标本前后两端及中部约3~4 mm的血管组织进行石蜡包埋待用。
1.1.2 试剂与仪器
L-DMEM培养液(Sigma公司 货号:D5523)。胎牛血清(FBS)(天津 灏洋生物制品科技责任有限公司)。胰蛋白酶、二甲基亚枫(北京拜尔迪生物公司)。淋巴细胞分离液(上海恒信化学试剂有限公司)。G-CSF(长春 金赛药业批号:S10980099);鼠抗兔 CD34、CD45、CD44 抗体(USBiological公司,美国);Ad-GFP包装病毒液为Dr.Tuet I(USA)惠赠;HEK293细胞为本院中心实验室保存。GFP一抗(CHEMICON Inter-national公司,加拿大)、α-平滑肌肌动蛋白一抗(abcam公司美国)、TUNEL细胞凋亡检测试剂盒(R&D Systems,美国)、CD31一抗(武汉博士德公司)、通用型免疫组化二抗试剂盒(武汉博士德公司),其它试剂为国产分析纯,正压不锈钢过滤器为星光机械制造厂生产。CO2孵育箱(Thermo,美国)、光学倒置显微镜 (TMS-1015型)(OLYMPUS,日本)、倒置荧光显微镜(TE2000-S 型)(Nikon,日本)、流式细胞计数仪(FACS Calibur)(Becton-Dickinson,美国),2.5 mm 直径的球囊导管购自Cordis公司,微量注射泵购自 Terumo公司(日本)。病理图像分析系统(Leica Qwin,德国)等。
1.2 方法
1.2.1 MSCs的动员、分离及培养
以 G-CSF30 μg/kg·d连续 5 d于种兔腹壁皮下注射给药,于第6 d在接受干细胞动员兔的耳中央动脉无菌采血20 mL,密度梯度离心法分离出其中的单个核细胞,新鲜无血清培养液洗涤两次,然后接种于含15%胎牛血清、青霉素、链霉素各100 U/mL的DMEM完全培养液中,置于37℃、5%CO2浓度、饱和湿度的孵育箱中培养。每天在倒置显微镜下观察细胞生长情况。原代培养4~5 d后初次换液,弃去非贴壁细胞,以后每3 d换液一次,大约10 d左右可传代,此后每3~4 d传一代,生长不良的细胞弃去,传到第3代长至80% ~90%融合时用于移植。移植时用0.25%胰蛋白酶进行消化,无血清及抗生素的新鲜DMEM培养液重悬,调整密度为1×107/mL备用。
1.2.2 MSCs的鉴定
分别用第3代 MSCs先后与 CD34、CD44、CD45抗体及异硫氰酸荧光素 (FITC)标记的二抗37℃孵育30 min,然后用1%的多聚甲醛固定后进行流式细胞仪检测。
1.2.3 GFP载体腺病毒(Ad-GFP)的扩增及滴度测定
待HEK293细胞生长至70% ~80%融合时,弃培养液以Ad-GFP包装病毒液进行感染,4 h后加入完全培养液继续培养。在293细胞出现明显的致病变效应同时发出强烈荧光(约3~5 d)时收集细胞,通过反复冻融法得到高滴度的重组腺病毒,可反复扩增。用空斑形成实验测定病毒滴度。
1.2.4 MSCs的标记
取第3代长至80% ~90%融合的 MSCs,在含2%血清培养液中加入感染复数为300(预实验得出的最佳感染复数)的Ad-GFP孵育细胞过夜,换新鲜完全培养液继续培养,每天监测荧光情况和生长情况。
1.2.5 动脉粥样硬化模型的建立及细胞移植
按课题组已成功构建的方法和标准[1]建立兔动脉粥样硬化模型,在严格无菌条件下行右颈总动脉球囊成形手术:动物经3%戊巴比妥1 mL/kg静脉麻醉,颈部用5%硫化钠脱毛后清洁消毒皮肤,作颈正中切口暴露气管,分离右侧颈内、外动脉和颈总动脉。肝素100 U/kg抗凝,在距离颈总动脉分叉处约0.5 cm处结扎颈外动脉,在结扎线近心侧进行穿刺,送入直径2.5 mm球囊至颈总动脉,600 kPa充盈球囊后缓慢拖动,持续1 min,间歇1 min后重复,总共3次,使颈总动脉损伤长度大约3 cm,撤出球囊,在穿刺点近心端处结扎颈外动脉,关闭术口。将事先准备好的MSCs按107个/kg的总量通过耳缘静脉注入模型兔体内,对照组注入同等体积的无血清及抗生素培养液。青霉素80万单位/只/d连用3 d预防感染。
1.2.6 免疫组化
MSCs移植后分别于 7、14、28 d取材的血管组织石蜡切片用SABC法进行GFP、CD31免疫组化染色;内皮化程度通过测定CD31染色阳性细胞吸光度及阳性率,并计算其吸光度值与阳性率的乘积,得出阳性指数。平滑肌细胞凋亡检测:先以α-actin(α平滑肌肌动蛋白)染色标记血管平滑肌细胞,阳性指数=灰度×阳性面积/统计场总面积,以3个不同横截断面的平均数来表示该组织的免疫组化定量的最后数值;再用TUNEL法标记凋亡细胞,双阳性细胞为凋亡的血管平滑肌细胞,计算阳性细胞核占同类总细胞核的百分比,以3个不同横截断面的平均值表示该组织的细胞凋亡率。通过光学显微镜和计算机图像分析系统(leica Qwin,德国),分析MSCs移植后的归巢、平滑肌细胞凋亡率及损伤血管再内皮化情况。
1.2.7 形态学分析
MSCs移植后28 d时空气栓塞法处死动物,留取病变血管标本(取未损伤侧做正常对照)常规处理后制成4 μm厚的血管横断面切片。切片进行weigert弹力纤维染色及HE染色,通过光学显微镜、Leica Qwin病理图像分析系统测算内膜面积、内膜中膜面积比、再狭窄率。
1.2.8 数据处理
应用SPSS13.0统计软件进行分析。定量资料实验结果以表示,均数间差异采用方差分析和t检验。
2 结果
2.1 G-CSF动员骨髓 MSCs
在兔身上 G-CSF30 μg/kg·d连续应用 5 d后采集的外周血中,能够分离出MSCs并进行体外扩增(见图1)。

图1 体外培养的外周血 MSCs(倒置相差显微镜,100×)(a)原代培养第7 d;(b)传代培养(第3代)Fig.1 Peripheralblood mesenchyme stem cells cultured in vitro.(Inverted phase contrast microscope 100×).(a)primary cells cultured for 7days;(b)passaged cells.(passage 3)
2.2 MSCs的鉴定
形态:生长较稀时胞体呈长梭形,两端有长突起,胞质内颗粒较多,折光性差,核不清楚;长至融合时细胞变得扁平,胞体狭长,有长突起,核呈椭圆形,呈鱼群样、漩涡状、辐射状或网状排列。表面标志:流式细胞仪检测结果:CD34阳性率是0.57%;CD45阳性率是0.47%;CD44阳性率是92.4%。
2.3 携GFP腺病毒扩增、滴度测定及转染MSCs
HEK293细胞感染Ad-GFP后48 h可观察到微弱荧光表达,72 h可以观察到明亮的荧光,平均96 h出现完全病变效应同时监测到强烈的绿色荧光,此时收获细胞用反复冻融法可以得到高滴度的腺病毒,测得病毒滴度为1.38×1011pfu/mL。用感染复数为300的Ad-GFP转染 MSCs不影响细胞的生长和增殖,平均转染率为75%(见图2)。

图2 标记上GFP基因的MSCs(倒置荧光显微镜,100×)Fig.2 Mesenchyme stem cells labeled with enhanced green fluorescent protein genes (Fluorescence m icroscope,100 × )
2.4 免疫组化
于各个时间段均可见MSCs移植组血管近内膜附近有GFP阳性细胞分布,大部分分布在血管内膜,也有少部分在外膜,中膜偶见;但未损伤血管及对照组血管则无(见图3);各个时段的移植组平滑肌细胞凋亡率均显著高于对照组(P<0.01)(见图4及表1);而再内皮化情况分析显示移植组明显优于对照组(P<0.01)(图5及表2)。
表1 MSCs移植后不同时间点血管平滑肌细胞凋亡率 (¯x± s,n=10)Tab.1 The apoptosis ratio of the vascular smooth muscle cell after MSCs transplantation(,n=10)

表1 MSCs移植后不同时间点血管平滑肌细胞凋亡率 (¯x± s,n=10)Tab.1 The apoptosis ratio of the vascular smooth muscle cell after MSCs transplantation(,n=10)
注:*P<0.01,移植组与同一时间点对照组比较;&P<0.01,7 d与同组14 d比较;s P<0.01,#P<0.05,14 d与同组28 d比较
移植后时间/d 移植组/% 对照组/%71.62±1.25*& 0.41±0.20&0.33±0.1814 3.66±1.52*# 0.98±0.3028 2.03±1.05*
2.5 血栓情况
MSCs移植组无血栓形成,对照组有 2例(6.67%)先后在7 d及14 d内发生颈动脉内血栓形成 (见图6)。
2.6 形态学分析
术后28 d血管形态学分析显示移植组弹力纤维基本完好,中膜厚度变化不大,有少量新生内膜形成;而对照组弹力纤维多数断裂,中膜变薄,有明显的内膜增殖。定量测量内膜面积及再狭窄率显著低于对照组(P<0.01)(见表2及图7)。
表2 兔血管成形术后28 d各组血管形态学分析结果(,n=10)Tab.2 The morphology analysis of blood vessels 28 days in rabbits postangioplasty(,n=10)

表2 兔血管成形术后28 d各组血管形态学分析结果(,n=10)Tab.2 The morphology analysis of blood vessels 28 days in rabbits postangioplasty(,n=10)
注:与对照组比较*P<0.01#P<0.05
阳性指数移植组 0.037±0.006* 0.223±0.037# 16.85±3.79* 22.54±2.80* 0.037±0.006内膜面积/mm2 中膜面积/mm2 (内膜/中膜)/% 再狭窄率/% CD31*.73 0.021±0.006对照组 0.086±0.009 0.183±0.041 48.94±8.98 44.02±3
2.7 实验动物情况
在实验期间两组均无一例死亡;无手术切口感染或不愈合等情况;所有动物实验期间饮食及排便情况均正常。
3 讨论
PCI是目前冠状动脉疾病最普及的血运重建方法。再狭窄问题则是影响其远期疗效的关键。其机制包括早期血管弹性回缩、内皮细胞损伤和平滑肌细胞的迁移与增殖、新生内膜增生及晚期血管重塑。药物洗脱支架(drug-eluting stents,DES)的应用直接针对平滑肌细胞增殖和新内膜增生,大大减少了临床再狭窄率。然而,当前应用的DES不针对炎症和血栓而且可能抑制再内皮化,暗藏增加血管支架内晚期血栓形成的风险[2-4]。因此,针对血管成形术和支架术损伤血管的应答反应,仍然迫切需要寻找合理有效具有特异性的治疗手段。
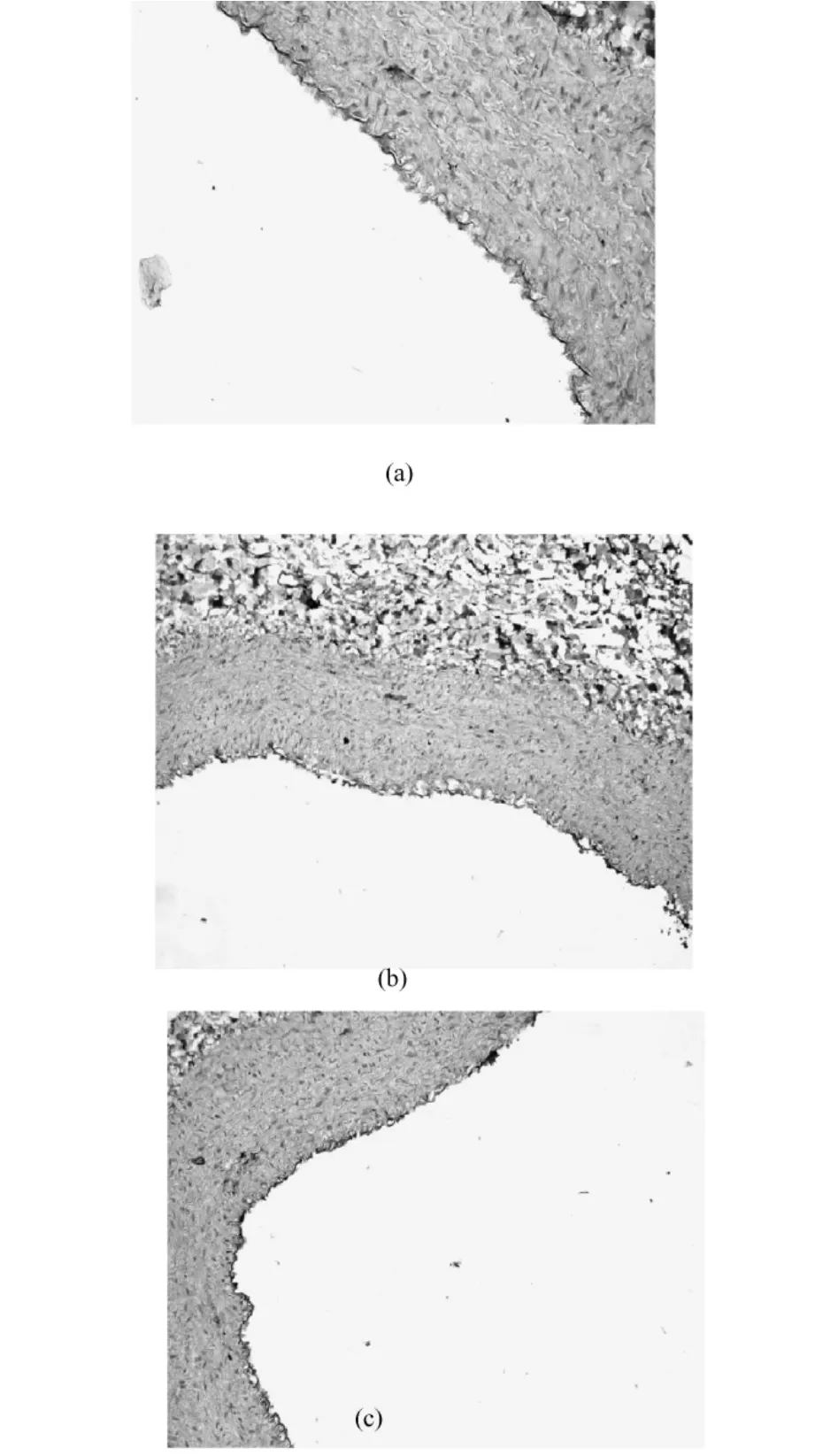
图3 血管成形术后GFP的表达(免疫组化染色,100×).(a)术后7 d;(b)术后14 d;(c)术后28 dFig.3 The expression ofGFP in artery after angioplasty.(Immunohistochemisty staining 100×).(a)7daysafterangioplasty.;(b)14daysafter angioplasty.(c)28 days after angioplasty
研究发现,PCI导致的血管损伤诱导血管平滑肌细胞(vascular smooth muscle cells VSMCs)的大量增殖,其发生与肿瘤发生有相似的分子生物学机制。因此,抑制平滑肌细胞增殖诱导平滑肌细胞凋亡成为治疗再狭窄的重要途径。有人曾测定正常人和动脉粥样硬化行腔内旋磨术病人的颈动脉组织中促凋亡基因BAX的表达,结果发现正常动脉中无BAX表达,但在病变组织中有30%表达BAX,这提示血管组织中的凋亡可能是对抗各种损害因素诱导的细胞过度增殖的一种代偿方式[5]。另有研究发现,在原发性动脉粥样硬化组织中凋亡程度是低于再狭窄组织的[6],而大量体内外实验研究都提示,血管再狭窄组织中细胞增殖活性明显高于原发性动脉粥样硬化。可见在增殖活性强的组织中凋亡相应上调亦是其代偿的一种表现。但是,相对于血管成形术后损伤血管的细胞增殖活性,凋亡的代偿显然是不足的:Kamenz等[7]的研究发现,在血管损伤后28 d内,尤其是1周内,平滑肌细胞增殖和内膜面积的增长最明显,而细胞凋亡率持续于低水平,均低于1%,提示在血管损伤后细胞增殖能力增加的同时并无相应的凋亡上调,这为新内膜中的细胞数量和后继的内膜面积的持续增长提供了可能。可见,平滑肌细胞凋亡在内膜增厚中起了重要作用,而其凋亡不足是内膜损伤后动粥样硬化进展及导致管腔狭窄的重要因素。
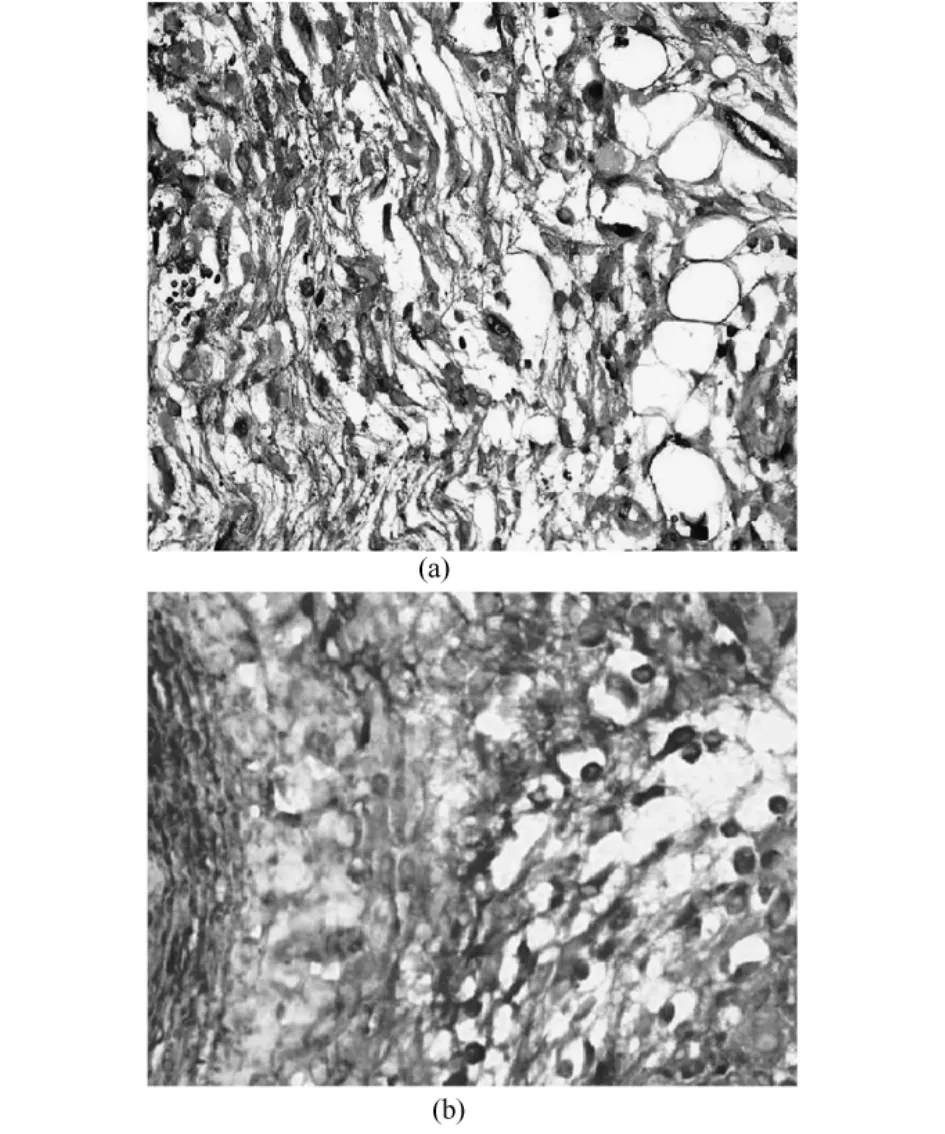
图4 平滑肌细胞凋亡的标记(免疫组化双染色,200×).(a)移植组;(b)对照组Fig.4 Smooth muscle cell labeledapoptosis(immuneohistochemisty double dyeing,200 ×)(a)transplantation groups;(b)control groups
上述研究表明,促使血管成形术后早期损伤血管平滑肌细胞凋亡可能是阻止再狭窄的一个重要靶点。而新近利用干细胞改善心肌梗死后心功能和左心室重塑已经被众多研究者所认同,但是,其对血管成形术后血管损伤的修复作用如何尚无定论;其是否对上述靶点起作用尚未见报道。本研究前期的实验利用MSCs干预颈动脉粥样硬化球囊成形术模型兔,发现其能够促进再内皮化,减少内膜面积,其中也发现归巢到损伤部位的MSCs部分分化为内皮细胞,但是在术后28 d内测得最高分化效率为29.63%,推测血管获益此并非全部因素。因此,我们又平行观察了外周血MSCs移植在干预模型兔颈动脉粥样硬化球囊成形术过程中,对术后血管平滑肌细胞凋亡的影响。结果发现外周血MSCs在体外可以大量扩增,以病毒介导增强型绿色荧光蛋白基因的转染有较高的效率。MSCs移植后7,14、28 d的平滑肌细胞凋亡率均显著高于对照组,其中移植后14 d达峰,到28 d有所下降但是仍然高于移植后7 d水平。对照组各时期凋亡率均较低,但是消长规律与移植组类似。此外,移植MSCs后28 d测定的内膜面积,再狭窄率同样显著低于对照组,内皮化程度高于对照组。本研究结果表明,经过G-CSF动员的外周血MSCs经过耳缘静脉注入后可以归巢到血管损伤部位,并可能通过促进平滑细胞凋亡以调节其过度增殖,从而显著抑制术后新内膜形成、减少再狭窄率。
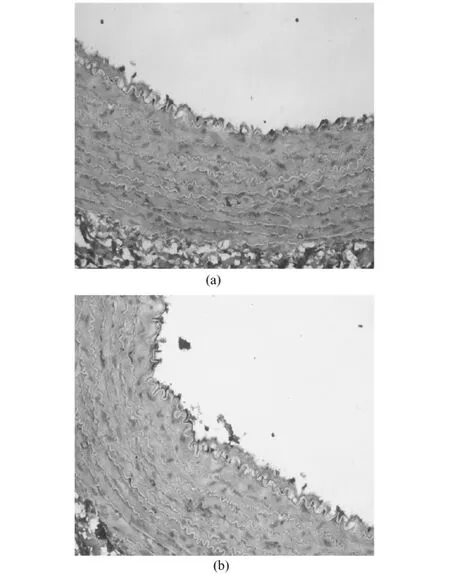
图5 球囊成形术后28天CD31表达(免疫组化染色,100×)(a)移植组;(b)对照组Fig.5 Theexpressionof CD31 in artery 28 days afterangioplasty.(Immunohistochemisty staining,200×).(a)transplantation groups (b)control groups
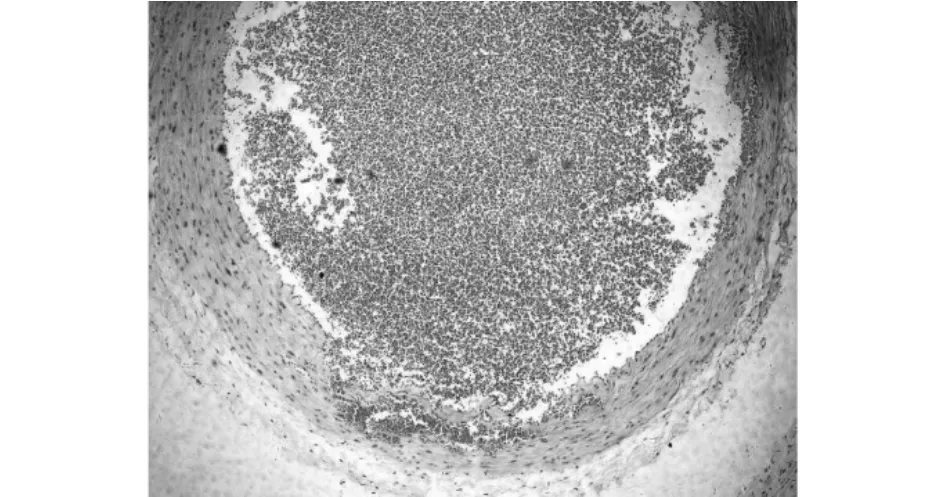
图6 颈动脉内血栓形成(HE染色,×100)Fig.6 Thrombopoiesis in carotid arteries(HE dyeing,×100)
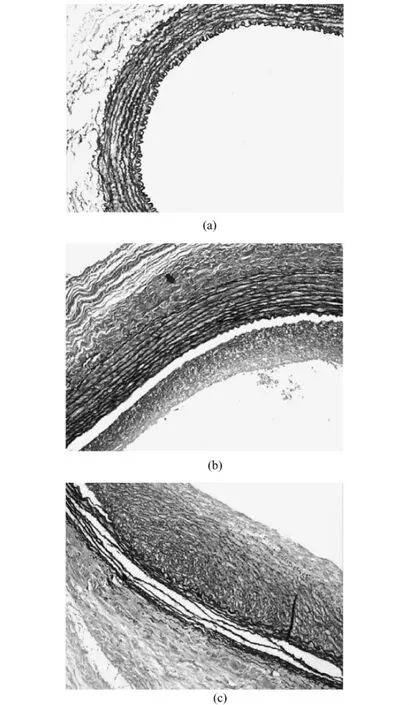
图7 正常及损伤血管术后28 d的内膜增殖情况(weigert染色,200×)(a)正常血管;(b)移植组;(c)对照组Fig.7 Intimal thickness of the injuried blood vessel 28 days after angioplasty.(weigert elastic fibers staining,200×)(a)normal blood vessel;(b)transplantation groups;(c)control groups.
新近对于MSCs通过旁分泌效应[8]以及对体内局部微环境的影响[9-10]发挥有益效应的研究正在受到越来越多的关注。动脉损伤后VSMCs的迁移、增殖和凋亡受到多种复杂因素的调节和影响。在血管损伤后炎症细胞与内皮、平滑肌细胞和细胞外基质之间发生复杂的应答反应,伴随着粘附分子,生长因子和细胞因子的表达增加,这些细胞因子的持续增加又反过来和血管功能障碍与疾病有关。Orlandi等发现[11],动脉损伤后早期,VSMCs表达flt-1、c-kit等表面标志的比率明显暂时性增加,而表达α-actin的比率急剧减少,但在损伤后期,VSMCs又恢复表达 α-actin,其间使用 flt-1封闭抗体可以部分减少VSMCs的增殖和迁移。这种VSMCs表型改变即是其对局部微环境改变做出的应答。另外,Maciel等也发现[12]在血管紧张素Ⅱ、转化生长因子β1、血小板衍生的生长因子协同调节下,骨形态生成蛋白拮抗物Guemlin在血管损伤早期可发挥促VSMCs凋亡作用,减少VSMCs的迁移和增殖。可见,改变损伤血管局部的微环境或物质成分可能对调节VSMCs增殖与凋亡之间的平衡发挥重要作用。而且,已有体外实验证实完整的内皮细胞抑制VSMCs的迁移和增生,而内皮细胞缺损结果则反之,但是当加入MSCs共培养可一定程度上抑制这种反应[13]。结合本研究结果,推测 MSCs促进兔颈动脉血管成形术后VSMCs凋亡可能与其旁分泌效应改变损伤局部微环境有关,但详细机制有待进一步研究。
综上,本研究利用动脉粥样硬化兔模型进行研究,这比较相似于临床上从动脉粥样硬化到血管成形术后再狭窄的过程,在本模型上发现外周血MSCs移植到体内后促进损伤血管平滑肌细胞的凋亡率增加,这可能是其降低血管成形术后再狭窄的因素之一;曾有研究者担心诱导平滑肌细胞凋亡的措施会破坏粥样斑块纤维帽的结构,导致斑块破裂和血栓形成,本实验中移植组无一例发生血栓形成和斑块内出血,而对照组均有发生,这提示本动物模型中MSCs移植不会恶化血管病变。至于MSCs具体通过何种确切机制去调控平滑肌细胞增殖与凋亡之间的平衡,以及在人体内其是否能重复上述效应有待进一步深入研究。
[1]沈长银,石蓓,赵然尊,等.兔颈动脉粥样硬化狭窄动物模型的建立及病理学评价[J].遵义医学院学报,2008,31(4):345-348.
[2]Farb A,Heller PF,Shroff S,et al.Pathological analysis of local delivery of paclitaxel via a polymer-coated stent [J].Circulation,2001,104(4):473 -479.
[3]Kuchulakanti PK,Chu WW,Torguson R,et al.Correlates and long-term outcomes of angiographically proven stent thrombosis with sirolimus- and paclitaxel-eluting stents[J].Circulation,2006,113(8):1108 -1113.
[4]Takano M,Ohba T,Inami S,et al.Angioscopic differences in neointimal coverage and in persistence of thrombus between sirolimus-eluting stents and bare metal stents after a 6-month implantation[J].Eur Heart J,2006,27(18):2189-2195.
[5]Konstadoulakis MM,Kymionis GD,Karagiani M,et al.Evidence of apoptosis in human carotid atheroma[J].VascularSurgery,1998,27(4):733 -739.
[6]Isnei JM,Kearney M,Bortman S,et al.Apoptosis in human atherosclerosis and restenosis CJ3[J].Circulation,1995,91(11):2703-2711.
[7]Kamenz J,Seibold W,Wohlfrom M,et al.Incidence of intimal proliferation and apoptosis following ballo nangioplasty in an atheroscIerotic rabbit model[J].Cardiovasc Res,2000,45(3):766-776.
[8]Dai Wangde,Hale SL,Kloner RA.Role of a paracrine action of mesenchymal stem cells in the improvement of left ventricular function after coronary artery occlusion in rats[J].Regen Med,2007,2(1):63 -68.
[9]DingDC,Shyu WC,ChiangMF,etal.NeurobiolDis.Enhancement of neuroplasticity through upregulation of beta1-integrin in human umbilical cord-derived stromal cell implanted stroke model[J].Neurobiol Dis,2007,27(3):339 - 353.
[10]Aupperle H,Garbade J,Schubert A,et al.Effects of autologous stem cells on immunohistochemical patterns and gene expression of metalloproteinases and their tissue inhibitors in doxorubicin cardiomyopathy in a rabbit model[J].Vet Pathol,2007,44(4):494-503.
[11]Orlandi A,Di Lascio A,Francesconi A,et al.Stem cell marker expression and proliferation and apoptosis of vascular smooth muscle cells[J].Cell Cycle,2008,7(24):3889 - 3897.
[12]Maciel TT,Melo RS,Campos AH.The bone morphogenetic protein antagonist gremlin promotes vascular smooth muscle cell apoptosis[J].J Vasc Res,2009,46(4):325 - 332.
[13]Wu Xiaojing,Huang Lan,Zhou Qi,et al.Mesenchymal stem cells participating in ex vivo endothelium repair and its effects on vascular smooth muscle cells growth[J].Int J Cardiol,2005,105(3):274-282.
