一种新型多吡啶钴(Ⅲ)配合物的合成、表征与DNA的相互作用
2010-11-26谭年元肖小明陈立新颜炜伟黄赛金
谭年元,蒋 燕,肖小明 *,陈立新,颜炜伟,黄赛金
(1.湖南工程学院化学化工学院, 中国 湘潭 411104; 2.湖南师范大学化学化工学院, 中国 长沙 410081)
近年来,过渡金属多吡啶配合物与DNA的相互作用已成为无机生物化学领域十分活跃的研究课题[1-6].过渡金属多吡啶配合物广泛地被研究用作DNA结构探针、DNA分子光开关、DNA光裂解试剂以及抗癌药物等[1-4].含配体dppz(dipyrido[3,2-a; 2′,3′-c ]phenazine, 二吡啶吩嗪)的多吡啶钌配合物[RuL2dppz]2+(L=2,2′-bipyridine, 1,10-phenanthroline)在有机溶剂中可产生荧光,而在水溶液中,由于配体与水分子存在氢键作用,从而猝灭了插入配体的激发态.当加入DNA后,配体dppz插入DNA碱基对中,吩嗪N受到保护而脱去缔合水而又有荧光出现,此效应称为“光开关”[3-4].

图1 配体dpapz的结构
为进一步研究该类配合物与DNA的键合性质,吴宝燕等[7]合成了一种在dppz骨架上引入另一个氮原子的配体联吡啶并[3,2-a: 2′,3′-c ]6-氮杂-吩嗪(dpapz,结构如图1所示)的多吡啶钴配合物,他们发现该配合物与DNA键合作用较强,是一种良好的DNA嵌入键合试剂.本文合成了含该配体的多吡啶钴配合物,并测定了配合物的电化学行为,以及分别采用紫外、荧光和黏度法研究了配合物与小牛胸腺DNA的相互作用.
1 实验部分
1.1 仪器与试剂
AVATAR-370红外光谱仪(美国Nicolet公司)、Vario-EL Ⅲ元素分析仪(德国Elementar公司)、CHI660B电化学工作站(上海辰华仪器公司)、 Agilent-8453紫外可见分光光度计(美国Agilent公司)、F-4500荧光分光光度计(日立公司)、pHS-3C型精密酸度计(上海雷磁厂)、乌式黏度计.
[Co(bpy)2Cl2]Cl[8], dpapz[7]参照文献方法合成,小牛胸腺DNA(北京华美生化试剂试剂公司),三羟甲基氨基甲烷 (Tris) (日本和光纯药工业株式会社),高氯酸四丁基铵( Fluka公司).其它试剂均为AR级, 所用试剂除特别说明外均没有进一步处理.
研究配合物与DNA相互作用时, 样品均溶解在含5 mmol·L-1Tris·HCl和50 mmol·L-1NaCl的二次蒸馏水缓冲溶液(pH=7.2)中,小牛胸腺DNA的浓度以ε260=6 600 L·mol-1·cm-1来确定[9].
1.2 配合物的合成

1.3 分析方法
1.3.1 电化学测定 配合物的电极电位用循环伏安法测定.采用三电极系统,工作电极为玻碳电极,使用前先用0.05 μm的Al2O3糊在抛光垫上抛光,然后依次在丙酮、二次蒸馏水中超声清洗10 min,辅助电极为铂电极,参比电极为饱和甘汞电极(SCE).溶剂为乙腈,使用前用P2O5重蒸2次,支持电解质为高氯酸四丁基铵(TBAP,0.1 mol·L-1).测试前通高纯氮15 min除氧.
1.3.2 配合物与DNA作用的电子吸收光谱 在参比池加入2.5 mL Tris缓冲溶液,在样品池中加入相同体积的6 μmol·L-1的配合物溶液,用微量加样器每次往参比池和样品池中加入相同体积的DNA溶液,使DNA与配合物浓度比值不断增加,直至吸收峰不再减色.
1.3.3 配合物与DNA作用的荧光光谱 在样品池中加入2.5 mL 6 μmol·L-1的配合物溶液.用微量加样器每次往样品池中加入相同体积的DNA溶液,使DNA与配合物浓度比值不断增加,以适当波长激发光激发,测定配合物的发射光谱.
1.3.4 DNA黏度测定实验 温度恒定在(28±0.1)℃,小牛胸腺DNA浓度固定为0.4 mmol·L-1,依次增大配合物浓度.相对黏度按公式η= (t-t0)/t0[t0为缓冲溶液流经毛细管所需时间,t为DNA溶液(含浓度不等的钴配合物)流经毛细管所需的时间]计算[10].以(η/η0)1/3对结合比率r作图(r= [Co]/[DNA]),η0为未加配合物时DNA溶液的相对黏度.
2 结果与讨论
2.1 配合物的电化学性质
配合物在乙腈中的循环伏安曲线如图2所示.由图2可知,在-0.1~0.7 V电位范围内,配合物有一对氧化还原峰,其阳极峰电位和阴极峰电位分别为Ep,a=0.415 V和Ep,c=0.266 V, 对应的电极反应是Co(Ⅲ)/Co(Ⅱ)的氧化还原过程.阳极峰电位和阴极峰的电位差ΔEp=0.149 V,其峰电流对扫描速率(0.02~0.2 V/s)的平方根作图(图2),可得一条通过原点的直线,故认为该氧化还原反应为准可逆单电子过程.
2.2 配合物与DNA作用的电子吸收光谱
配合物与DNA相互作用的电子吸收光谱如图3所示.由图3可知,随着DNA浓度增加,配合物在221,274,307和368 nm处的吸收峰均发生明显的减色,减色率分别为24.2%、35.6%、13.2%和37.0%,表明得到的配合物可能以插入方式与DNA键合[11].这是因为插入配体与DNA碱基对发生π电子堆积之后,配体的π*空轨道与碱基的π电子轨道发生偶合,偶合后的π轨道因部分填充电子,使π→π*跃迁几率减小,产生减色效应.配合物与DNA的键合常数Kb可根据下列方程式求得[12]:
cDNA/(εf-εa)=cDNA/(εf-εb)+(1/Kb) (εf-εb),
其中,cDNA表示DNA的浓度,εa、εb和εf分别表示任意DNA浓度下、键合饱和以及未加DNA时配合物的摩尔吸光系数,以cDNA/(εf-εa)对cDNA作图(图3),所得直线的斜率与截距的比值即为配合物与DNA的键合常数Kb=1.49×105L·mol-1.
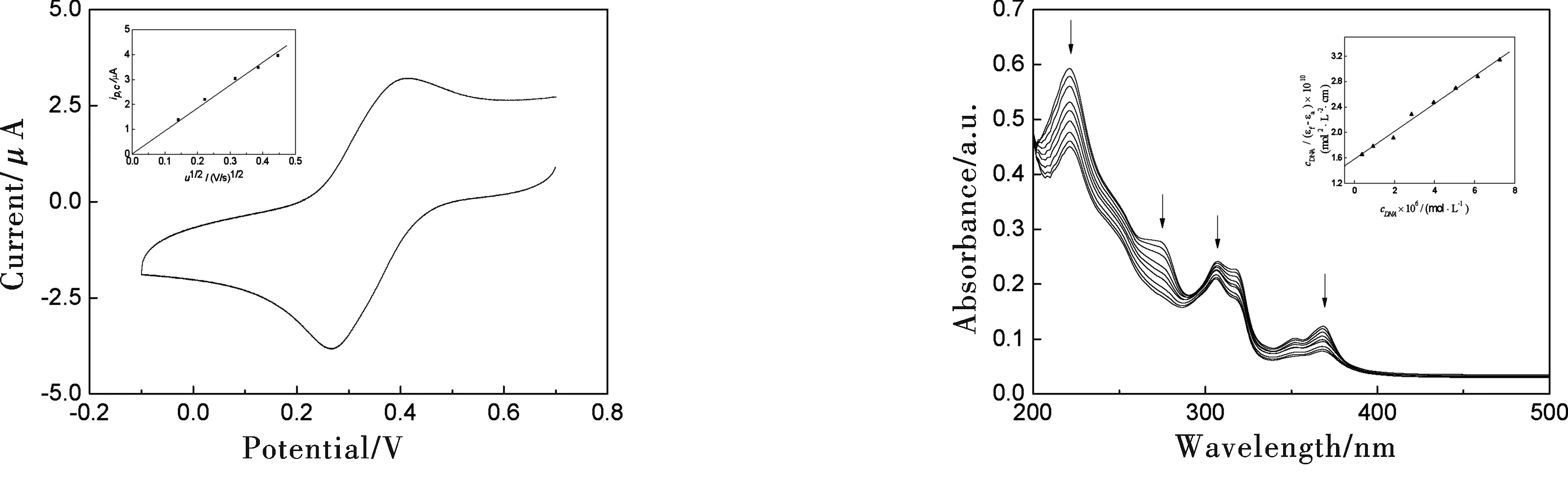
图2 配合物[Co(bpy)2dpapz]3+在乙腈中的循环伏安曲线,扫描速率为100 mV/s 图3 配合物[Co(bpy)2dpapz]3+在不同DNA浓度下的电子吸收光谱
2.3 配合物与DNA作用的荧光光谱
荧光光谱变化幅度的大小也能反映配合物与DNA作用的强度.以240 nm波长的光进行激发,测得配合物的荧光光谱如图4所示.在Tris溶液中,配合物没有荧光,这是由于配体dpapz与水分子之间存在氢键作用,从而猝灭了插入配体的激发态[7].加入DNA后,配合物的插入配体dpapz插入DNA碱基对中,吩嗪N受到保护脱去缔合水而产生发射波长为331 nm的荧光,且随DNA浓度的增大,强度明显增大,表明配合物与DNA作用较强,与紫外光谱结果一致.
2.4 配合物与DNA作用的黏度测定
黏度测定是确定配合物与DNA键合模式的最有效的方法之一.当配合物以静电、沟面结合等非插入方式与DNA作用时,DNA溶液的黏度无明显变化;当配合物通过经典插入方式与DNA作用时,DNA相邻碱基对的距离变大以容纳插入配体,导致DNA双螺旋伸长,DNA溶液的黏度增加;当配合物以部分插入方式与DNA作用时,则可能使DNA双螺旋发生扭结,使DNA溶液黏度减小[10].从图5可知,随着配合物浓度增加,DNA溶液的相对黏度增大,进一步证实该配合物是以经典插入方式与DNA结合.
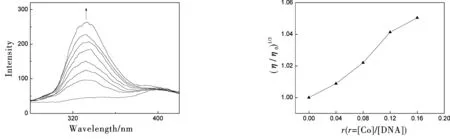
图4 配合物[Co(bpy)2dpapz]3+随DNA浓度增大的荧光光谱图 图5 DNA溶液的相对黏度随配合物[Co(bpy)2dpapz]3+加入量的变化
3 结论
合成了一种新型多吡啶钴配合物[Co(bpy)2dpapz](ClO4)3·H2O并对其进行了表征,用光学实验和黏度测试研究了该配合物与DNA的互相作用,结果显示该配合物以经典的插入方式与DNA结合,键合常数为1.49×105L·mol-1.
参考文献:
[1] 张蓉颖, 庞代文, 蔡汝秀. DNA与其靶向分子相互作用研究进展[J]. 高等学校化学学报, 1999, 20(8): 1 210-1 217.
[2] 刘 杰, 计亮年, 梅文杰. 金属钌配合物的抗肿瘤活性及其作用机理[J].化学进展, 2004,16(6): 969-974.
[3] FRIEDMAN A E, CHAMBRON J C, SAUVAGE J P,etal. Molecular “light switch” for DNA: [Ru(bpy)2(dppz)]2+[J]. J Am Chem Soc, 1990, 112(12): 4 960-4 962.
[4] HIORT C, LINCOLN P, NORDN B. DNA-binding of Δ- and Λ-[Ru(phen)2DPPZ]2+[J]. J Am Chem Soc, 1993, 115(9):3 448-3 454.
[5] TAN N Y, XIAO X M, Li Z L,etal. Microwave synthesis, characterization and DNA-binding properties of a new Cobalt(Ⅱ) complex with 2,6-Bis(benzimidazol-2-yl) pyridine[J]. Chin Chem Lett, 2004, 15(6): 687-690.
[6] WANG J L, SHUAI L, XIAO X M,etal. Synthesis, characterization and DNA binding studies of a zinc complex with 2,6-bis(benzimidazol-2-y1)pyridine[J]. J Inorg Biochem, 2005, 99(3): 883-885.
[7] 吴宝燕, 高丽华, 王科志. 一个新型(Ⅱ)钌配合物的合成、表征与DNA的键合及溶剂变色性质[J]. 高等学校化学学报, 2005, 26 (7): 1 206-1 209.

[9] REICHMANN M E, RICE S A,THOMAS C A,etal. A further examination of the molecular weight and size of desoxy-pentose nucleic acid[J]. J Am Chem Soc, 1954, 76(11):3 047-3 053.
[10] SATYANARYANA S, DABROWIAL J C, CHAIRES J B. Neither Δ- nor Λ- Tris(Phenanthroline) Ruthenium(Ⅱ) Binds to DNA by classical intercalation[J]. Biochemistry, 1992, 31(39): 9 319-9 324.
[11] LAKOWICZ J R, Weber G. Quenching of fluorescence by oxygen. Probe for structural fluctuations in macromolecules[J]. Biochemistry, 1973, 12(21): 4 161-4 170.
[12] WOLFE A, SHIMER G H, MEEHAN T. Polycyclic aromatic hydrocarbons physically intercalate into duplex regions of denatured DNA[J]. Biochemistry, 1987, 26(20): 6 392-6 396.
