红松树皮中原花青素提取工艺研究
2010-11-24宋应华罗小武
宋应华,陶 冶,罗小武
1重庆工商大学环境与生物工程学院,重庆 400067;2煤炭科学研究总院重庆研究院,重庆 400037
红松树皮中原花青素提取工艺研究
宋应华*,陶 冶2,罗小武1
1重庆工商大学环境与生物工程学院,重庆 400067;2煤炭科学研究总院重庆研究院,重庆 400037
采用溶剂回流提取的方法,以红松树皮中原花青素的提取率为考察指标,考察了提取溶剂种类、溶剂浓度、提取温度、料液比、提取时间、提取次数等因素对原花青素提取效果的影响。通过正交实验,确定红松树皮中原花青素的最佳提取工艺条件为:提取溶剂 60%乙醇,提取温度 50℃,料液比 1:7,提取时间 60 min。
红松;原花青素;提取
原花青素 (PC)是广泛存在于植物界中的聚多酚类物质,分布于植物的叶、花、果、皮内[1-6]。松树皮[7-9]提取物的主要成分是水溶性极高的 PC低聚物(OPC),同时还含有多种对人体有用的生物活性成分,具有显著的清除自由基、抗氧化、保护心血管、抗肿瘤、防辐射及抗突变等多种生理功效,具有良好的开发前景。本文以我国浙江地区引进种植的美国红松树皮为原料,采用溶剂回流提取法,对红松树皮中所含 PC进行提取。在单因素试验的基础上,采用正交试验方案,以 PC提取率为参考指标,对红松树皮 PC的溶剂回流提取工艺进行优选,得出了红松树皮 PC溶剂回流提取工艺的最佳参数组合。
1 材料与方法
1.1 材料及仪器
原料:美国红松树皮由湖州恩贝希生物原料有限公司友情提供。
试剂:PC标准品,成都曼思特生物科技有限公司;甲醇、乙醇、丙酮、乙酸乙酯、盐酸硫酸铁铵,均为分析纯。
主要仪器:9FZ-35A型多用植物粉碎机,四川国营简阳机械厂;UV1102型紫外/可见分光光度计,上海天美科学仪器有限公司;PL203型电子天平,瑞士梅特勒-托利多公司;HH型恒温水浴,江苏金坛市中大仪器厂。
1.2 实验方法
1.2.1 松树皮中 PC的提取方法
准确称取粉碎后的松树皮 10 g于 250 mL圆底烧瓶中,在一定料液比、溶剂浓度和温度条件下热回流提取一定时间,取出过滤,减压浓缩,将浓缩液定容,测定溶液中 PC含量。分别对溶剂浓度、提取温度、料液比、提取时间进行单因素试验。在单因素试验的基础上,以溶剂浓度、提取温度、时间、料液比设计L9(34)正交试验 (见表 1),探讨最佳提取工艺。为了提高试验精度,每号试验均重复两次。
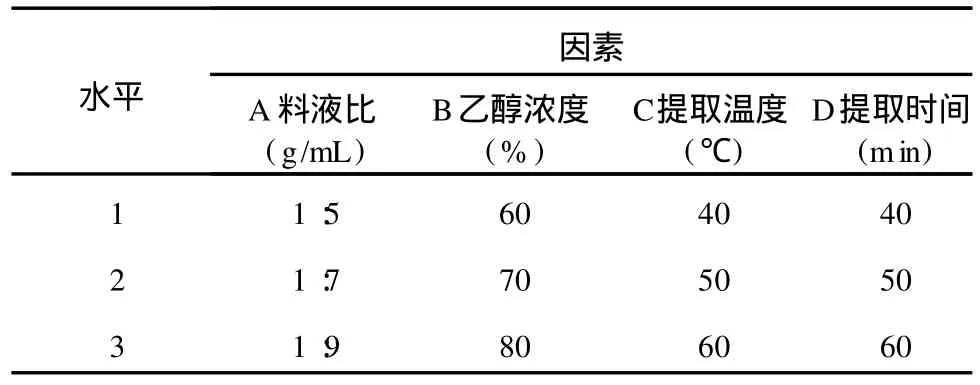
表 1 正交实验的因素和水平Table 1 Factors and levels of the orthogonal exper iment
本文以所提取 PC的质量分数表示提取率,即每 100 g松树皮中经提取得到的 PC量。
1.2.2 PC含量的测定——正丁醇-盐酸法[10]
1.2.2.1 标准曲线的绘制
精确称取一定质量 PC标准品,用无水乙醇溶解并定容,将其稀释成不同浓度,分别取 1 mL不同浓度的 PC标准品溶液于 25 mL具塞试管中,分别加入 6 mL正丁醇-浓盐酸 (v/v=95∶5)和 0.2 mL 2%盐酸-硫酸铁铵溶液,摇匀后,于 95℃水浴中加热 40 min,然后用自来水迅速冷却至室温。以空白为对照,用紫外分光光度计在 550 nm处测出其吸光度值,所取标准溶液的浓度和吸光度数据经回归处理,回归方程 Abs=0.0028c+0.0155,R2=0.9931。结果表明,PC在 22~110 ug/mL范围内具良好的线性关系。
1.2.2.2 PC含量测定
取1 mL粗提物样液进行稀释,定容。取上述溶液 1 mL于具塞试管中,分别加入 6 mL正丁醇-浓盐酸(v/v=95:5)和 0.2 mL2%盐酸-硫酸铁铵溶液,摇匀后,于 95℃水浴中加热 40 min,然后用自来水迅速冷却至室温。以 1 mL乙醇代替提取液重复上述操作,作为参比液,用紫外分光光度计在 550 nm处测出其吸光度值,并根据回归方程计算待测液中的 PC含量,从而根据式(1)计算出 PC提取率。
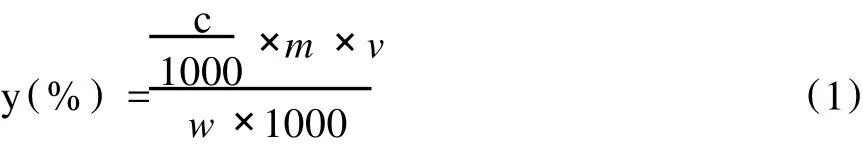
式中,c为由回归方程计算得到的浓度,ug/mL; m为稀释倍数;v为待测液体积,mL;w为称取松树皮质量,g。
2 结果与讨论
2.1 提取溶剂的确定
在热回流提取条件下,选用相同浓度的乙醇、乙酸乙酯、丙酮和蒸馏水进行提取,确定最佳提取溶剂,结果见图 1。
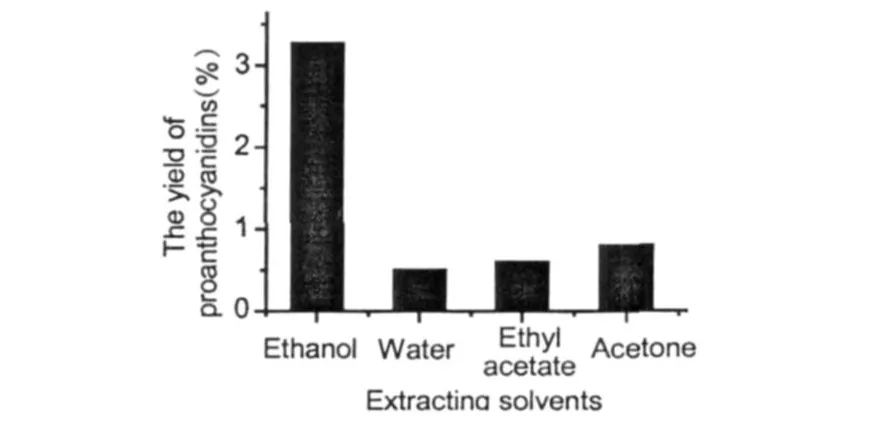
图 1 不同提取溶剂对提取效果的影响Fig.1 Effect of extracting solvents on the yield of proanthocyanidins
由图 1可知,采用蒸馏水提取的效果较差,而乙醇的效果最好。由于丙酮、乙酸乙酯等均有一定毒性,若去除不完全会对人体造成伤害,而水的提取效果太差,从安全、经济的角度考虑,本实验选择乙醇作为松树皮 PC的最佳提取溶剂。
2.2 单因素实验
考察了提取溶剂浓度、提取温度、固液比和提取时间等因素对 PC提取率的影响,以确定较佳工艺条件,结果如图 2~5所示。

图 2 乙醇浓度对提取效果的影响Fig.2 Effect of ethanol concentration on the yield of proanthocyanidins
由图 2可见,随着乙醇浓度增加,PC提取率增大。当乙醇浓度为 70%时,PC提取率最高,如继续增大乙醇浓度,则可能会使一些醇溶性杂质和亲脂性较强成分溶出增加,导致 PC提取率有所下降,同时,乙醇浓度过高,还会增加后续减压浓缩回流操作时间,增加原料和操作成本,因此,以 70%乙醇对PC进行提取较为适宜。
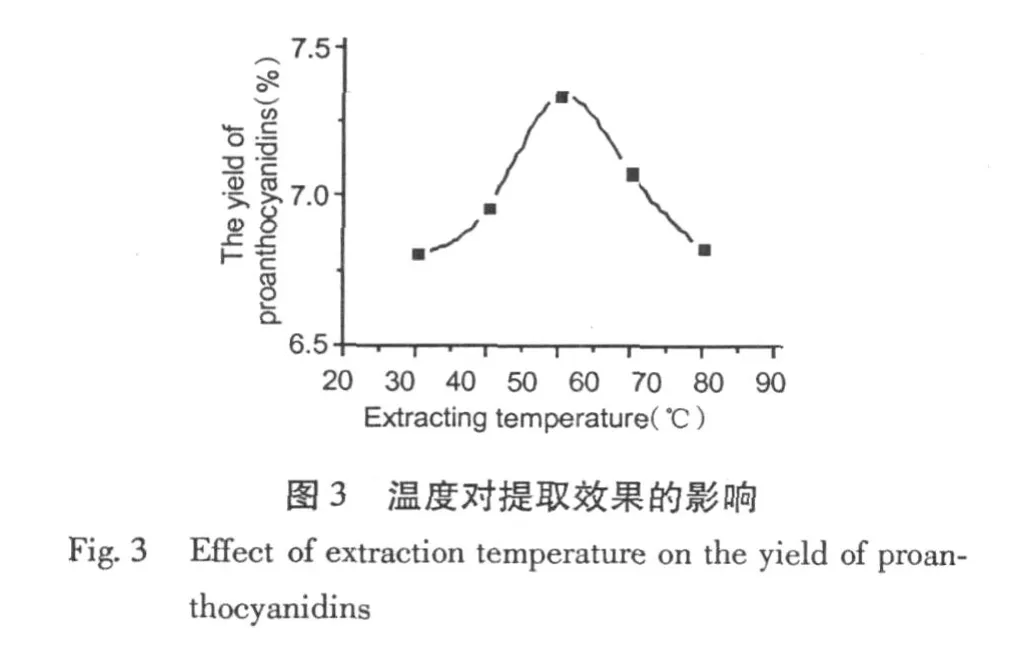
由图 3可见,随着温度的升高,PC的提取率呈先上升后下降的趋势,当温度为 50℃时,PC的提取率最高,如温度进一步升高,则将破坏活性成分,使PC的提取率下降。因此,确定50℃为松树皮 PC提取的最佳温度。
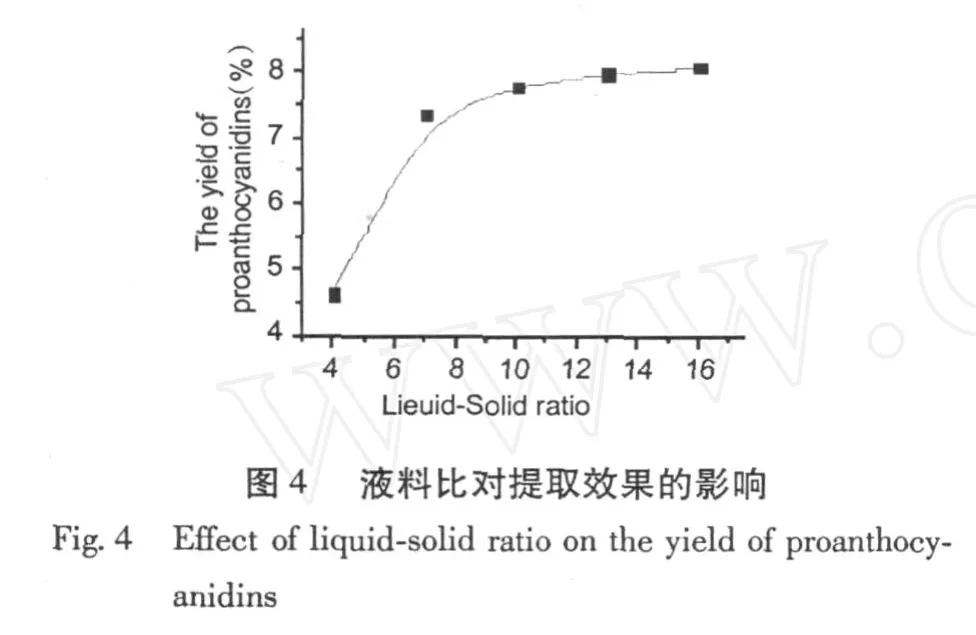
由图 4可以看出,随着提取溶剂用量的增加, PC提取率也会相应地增加,当料液比为 1:7(g/mL)时,如溶剂用量继续增加,则 PC的提取率增加并不明显。考虑到溶剂消耗,选用 1:7为适宜料液比。

图 5 提取时间对提取效果的影响Fig.5 Effect of extracting time on the yield of proanthocyanidins
由图 5可以看出,随着提取时间的延长,PC提取率也不断增大,当提取时间超过 50 min后,松树皮内外组分浓度逐渐趋于平衡,PC提取率增加得并不明显,同时,提取时间的延长还会导致其受热时间过长而变性,故选取 50 min为最佳提取时间。
2.3 正交实验
按 1.2.1所述 L9(34)正交实验设计因素水平安排,考察松树皮中原花素的提取效果。试验结果及分析见表 2和表3。

表 2 正交实验方案及结果Table 2 The project and result of the orthogonal experiment

2.09 0.63 0.85 0.53 K21+K22+K2 R 6860.88 6768.38 6775.85 6767.47 G=∑yi=142.42 CT=G2/(9×2)=1126.86 K21+K22+K2 3 3 3×2 1143.48 1128.06 1129.31 1127.91 Sj=K21+K22+K2 3 3×2 -CT 16.62 1.20 2.45 1.05优水平 A2 B1 C2 D3
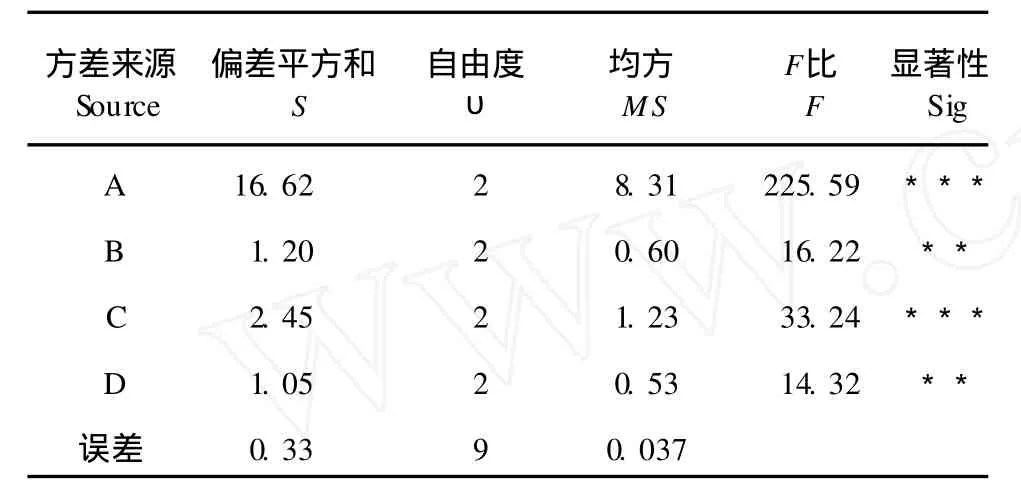
表 3 方差分析表Table 3 The analysis of variance
由表 3可知,料液比、乙醇浓度、提取温度和提取时间等四个因素对 PC的提取效果均有显著影响,而料液比和提取温度对其有着极显著影响。由表 2分析可得,影响 PC提取效果的顺序为:A>C >B>D,且 A2B1C2D3为最佳方案,即为正交实验设计表中的第 4号试验,在该试验条件下,PC的提取率为 9.84%,均高于其它各组试验所得提取率,试验结果合理可行。
2.4 提取次数的确定
由图 6可知,随着提取次数增加,PC提取率也有所增加。但当提取次数大于 3次时,曲线趋势已趋于平缓,即 PC提取率增加并不明显。从溶剂用量和操作时间综合考虑,确定提取次数为 3次。

图 6 提取次数对提取效果的影响Fig.6 Effect of extracting times on the yield of proanthocyanidins
3 结论
通过单因素和正交实验设计,考虑各因素对 PC提取效果的影响,红松树皮中 PC提取的最佳工艺条件为:提取溶剂 60%乙醇,提取温度 50℃,料液比 1∶7,提取时间 60 min,提取 3次。
1 Le Bourvellec,Picot C,RenardM,et al.Size-exclusion chromatography of procyanidins:comparison between apple and grape procyanidins and application to the characterization of fractions of high degreesof polymerization.Analytica Ch im ica Acta,2006,563(1/2):33-43.
2 Escarpa A,González MC.Identification and quantitation of phenolics from green beans by high performance liquid chromatography.Chrom atographia,2000,52(1/2):33-38.
3 Sprygin VG,Kushnerova NF.A method for evaluation and standardization of oligomeric proanthocyanidin complexes isolated from various raw plantmaterials.Phar m Chem J,2002, 36(3):139-143.
4 Yun Suk Huh,Tae Hee Hong,Won Hi Hong.Effective extraction of oligomeric proanthocyanidin (OPC)from wild grape seeds.B iotechnol B ioprocess Eng,2004,9:471-475.
5 Zhang XM(张兴茂),Lin SY(林松毅),Liu JB(刘静波), et al.Study on extracting process of proanthocyanidins for m fruit ofVaccinium uliginosumL..Food Sci(食品科学), 2007,28(11):186-189.
6 Zhang ZS(张泽生),Zhao CY(赵春艳),Xu Y(徐英),et al.Study on extracting procedure of proanthocyanidins for m hawthorn fruit.Nat Prod Res Dev(天然产物研究与开发), 2007,19:127-130.
7 Mun SP,Ku CS.Characterization of low molecular weight polyphenols from pine(Pinus radiata)bark.Food Sci B iotechnol,2006,15:424-430.
8 Chang Sub Ku,Sung PhilMun.Characterization of proanthocyanidin in hot water extract isolated from Pinus radiata bark.W ood Science and Technology,2007,41:235-247.
9 Li Y(李莹),ZhaoMM(赵谋明),Yu LM(于立梅),et al. Purification of proanthocyanidins from pinus massoniana’s bark on macroporous adsorption resins and studies on its antioxidant activities.Food and Fer mentation Indus(食品与发酵工业),2006,32(12):145-149.
10 Wang JR(王俊儒).The Methods of Extraction,Isolation and Assay ofNatural Products(天然产物提取分离和鉴定技术).Xianyang:Publishing House of Northwest A&F University,2006.122-123.
Extracting Process of Proanthocyan idins fromPinus koraiensisBark
SONG Ying-hua1*,TAO Ye2,LUO Xiao-wu11Institute of Environm ental and B iology Engineering,Chongqing Technology and Business University,Chongqing 400067,China;2Chongqing Research Institute of Chinese Coal Research Institute,Chongqing 400037,China
The solvent reflux extraction process for proanthocyanidins fromPinus koraiensisBark was optimized by orthogonal design with L9(34)model.The extraction yield of proanthocyanidinswas regarded as the index of examination. The influence of the extraction solvent concentration,temperature,solid-liquid ratio and extracting time were investigated herein.Optimum extraction conditionswere determined as follows:extracting solventwas60%ethanol,extracting temperature was 50℃,solid-liquid ratio was 1∶7,extracting time was 60 min and extracting thrice.
Pinus koraiensis;proanthocyanidins;extract
1001-6880(2010)02-0339-04
2009-09-02 接受日期:2009-10-27
重庆市科委自然科学基金计划资助项目 (CSTC, 2009BB7374);重庆工商大学青年科研基金项目(0752004)
*通讯作者 Tel:023-62769785;E-mail:yhs wjyhs@126.com
R284.2;TS202.3
A
