Ni-Cr-Al-Fe基合金粉末的高温抗氧化行为
2010-11-24李维杰汤慧萍
李维杰,刘 咏,王 岩,韩 朝,汤慧萍
Ni-Cr-Al-Fe基合金粉末的高温抗氧化行为
李维杰1,刘 咏1,王 岩1,韩 朝1,汤慧萍2
(1. 中南大学 粉末冶金国家重点实验室,长沙 410083;2. 西北有色金属研究院 金属多孔材料国家重点实验室,西安 710016)
研究Ni-Cr-Al-Fe基合金粉末在600 ℃空气中的高温抗氧化性能,分析铝含量和预氧化处理对合金粉末高温抗氧化行为的影响。利用水雾化法制备不同铝含量的 Ni-Cr-Al-Fe基合金粉末,利用静态质量增加法研究不同铝含量合金粉末的氧化动力学,分别利用FE-SEM(EDS)和XRD观察分析不同合金粉末氧化膜的形貌及成分,结合氧化动力学及氧化膜的组成进一步分析不同合金粉末的高温氧化机理。结果表明:Ni-Cr-Al-Fe基合金粉末在600 ℃时的氧化质量增加遵循抛物线规律,铝含量的增加及预氧化处理均可提高合金粉末的抗氧化能力;铝含量的增加使氧化膜的组成由Cr2O3和Al2O3的混合结构转变为单一的Al2O3氧化膜结构,这有利于提高合金粉末的抗氧化性能;预氧化处理所形成的氧化膜有效地抑制Ni-Cr-Al-Fe基合金粉末的进一步氧化。
Ni-Cr-Al-Fe基合金粉末;高温抗氧化性;预氧化;氧化机理
高温气体净化是目前煤气化技术面临最大的技术难题之一[1],其目的是将燃烧合成气与燃烧后的煤灰分离开,既是煤化工的洁净原料气生产工序,也是保护燃气轮机叶片的关键环节。由于金属过滤元件具有优异的抗热震性能、耐高温、耐腐蚀以及良好的综合力学性能和更高的可靠性,因此,使用金属多孔过滤元件是洁净煤技术发展的趋势。
在进行高温气体净化用金属多孔材料的选择时,一般选择金属表面可形成厚度均匀、连续且和基体材料附着力较强的Al2O3膜的合金材料[2−3]。因此,国内外的研究主要围绕耐高温耐腐蚀的含 Al合金来展开[4−9]。Siemens Westinghouse 公司、Ames 实验室等机构以镍基高温合金和改进的 FeAl合金为研究对象,模拟洁净煤的工况条件,对 FeAl、HaynesX、310s和Inconel600等材料进行了耐腐蚀、力学性能、过滤性能等的对比研究,发现宇航级 Ni-Cr-Al-Fe合金材料在高温下具有突出的耐高温、抗氧化、耐腐蚀性能,特别是其耐硫腐蚀性能优于Fe3Al的,是洁净煤高温气体净化的理想材料。HAMID[10]研究了Ni-xCr-5Al(x=10,20,30,质量分数,%)1 000 ℃时的恒温抗氧化行为,表明 Cr含量的增加有利于形成α-Al2O3的氧化膜,Ni-30Cr-5Al在氧化初期就形成了完整的 α-Al2O3氧化膜;随着铬含量的增加,氧化膜的厚度减小但粘着性增强。XUE[11]研究了石墨的加入对Ni-Cr基合金在900 ℃时抗氧化性能的影响,表明加入 3%(质量分数)石墨时氧化质量增加较严重,含6.0%石墨的Ni-Cr基合金的质量增加最小,抗氧化性能好。TERPSTRA等[12]对Ni-Cr-Al-Fe合金块体进行了研究,发现合金中Al含量对材料的耐腐蚀性、抗氧化和耐高温性能有较大的影响,随着 Al含量的增加,Ni-Cr-Al-Fe合金的屈服强度增大;针对不同的高温气体组成,合金中Al含量应有所不同。以上关于镍基合金氧化行为的报道主要是针对合金成分对镍基合金块体抗氧化行为影响的研究,而对于 Ni-Cr-Al-Fe合金粉末原料抗腐蚀行为的研究,目前尚未见报道。本文作者针对我国洁净煤技术用金属多孔材料,以Ni-Cr-Al-Fe为基本体系,研究Al含量和预氧化处理对合金粉末在600 ℃空气中抗氧化性能的影响,分析其氧化动力学、氧化产物的形貌及组成,并探讨合金的抗氧化机理,为设计和开发新型金属多孔材料提供指导性原则和理论依据。
1 实验
选择两种不同铝含量的镍基合金粉末作为试验材料,其名义成分如表1所列。镍基合金粉末采用水雾化法制备。在1 000 ℃下,将粉末放在通入N2的管式炉中预氧化处理50 h。在进行氧化实验之前,先将洗净的石英坩埚在干燥箱内烘烤至质量恒定,然后将预氧化的合金粉末标为y1#、y2#以及作为对比的原始1、2号合金粉末(以下标为1#、2#)连同坩埚称量后放入炉中。氧化实验在600 ℃空气环境下进行,氧化时间为100 h。每隔25 h将试样取出,冷却至室温后在精度为0.1 mg的电子天平上称量。用X射线衍射仪(XRD)(日本 D/max−2550VB 型)分析粉末试样表面形成的氧化产物的物相组成,并分别利用TSM−6360LV型扫描电镜(SEM)和 Nova Nanosem 230型高分辨扫描电镜(FE−SEM)分析粉末试样表面及剖面氧化物的形貌及成分。
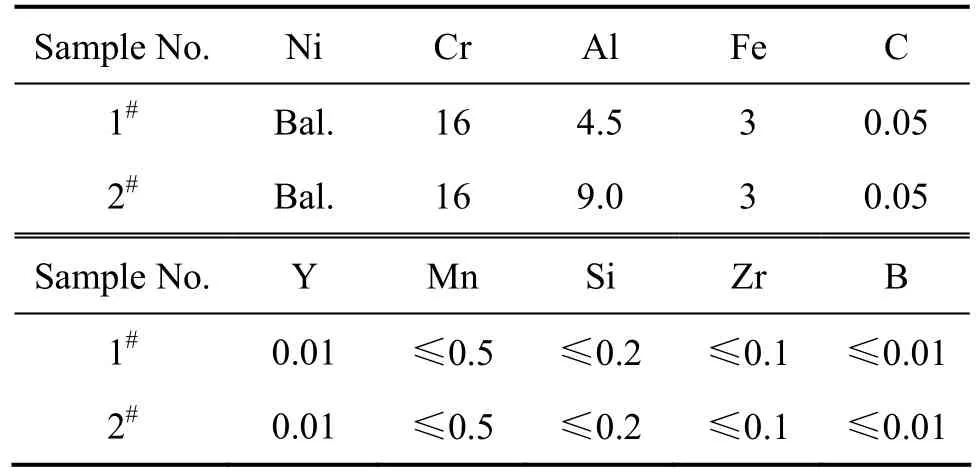
表1 原始粉末名义化学组成Table 1 Nominal compositions of origin superalloy powders(mass fraction, %)
2 结果与分析
2.1 氧化动力学
图1(a)所示为实验用Ni-Cr-Al-Fe基合金原始及预氧化粉末在600 ℃时的氧化动力学曲线,即单位面积上质量增加随时间的变化曲线。由图 1(a)可知,几种试验合金粉末的质量增加随时间变化均呈近似的抛物线趋势。氧化初期(25 h),1#、2#原始合金粉末氧化速度较快,属于氧化膜形成期;生成完整的氧化膜后,氧化速率开始减缓,由氧化膜形成阶段转为氧化膜生长阶段,即氧化过程由表面生成反应控制转变为扩散控制。由图1(a)还可以看出,Al含量为9.0%合金粉末的抗氧化性能优于Al含量为4.5%合金粉末的。同时,预氧化处理后,合金粉末的抗氧化性能明显提高,其质量增加仅为原始合金粉末质量增加的20%。图1(b)所示为不同Ni-Cr-Al-Fe基合金粉末在600 ℃氧化时单位面积质量增加的平方随时间的变化曲线。由图1(b)可知,不同实验合金粉末的氧化动力学曲线基本遵循抛物线规律。由图中各直线斜率可得不同实验合金粉末的抛物线速率常数,如表2所列。由表2可知,Al含量为 9.0%的预氧化合金粉末在 600 ℃氧化的抛物线速率常数最低,仅为5.94×10−19g2·cm−4·s−1,因此,其抗氧化性能最好。
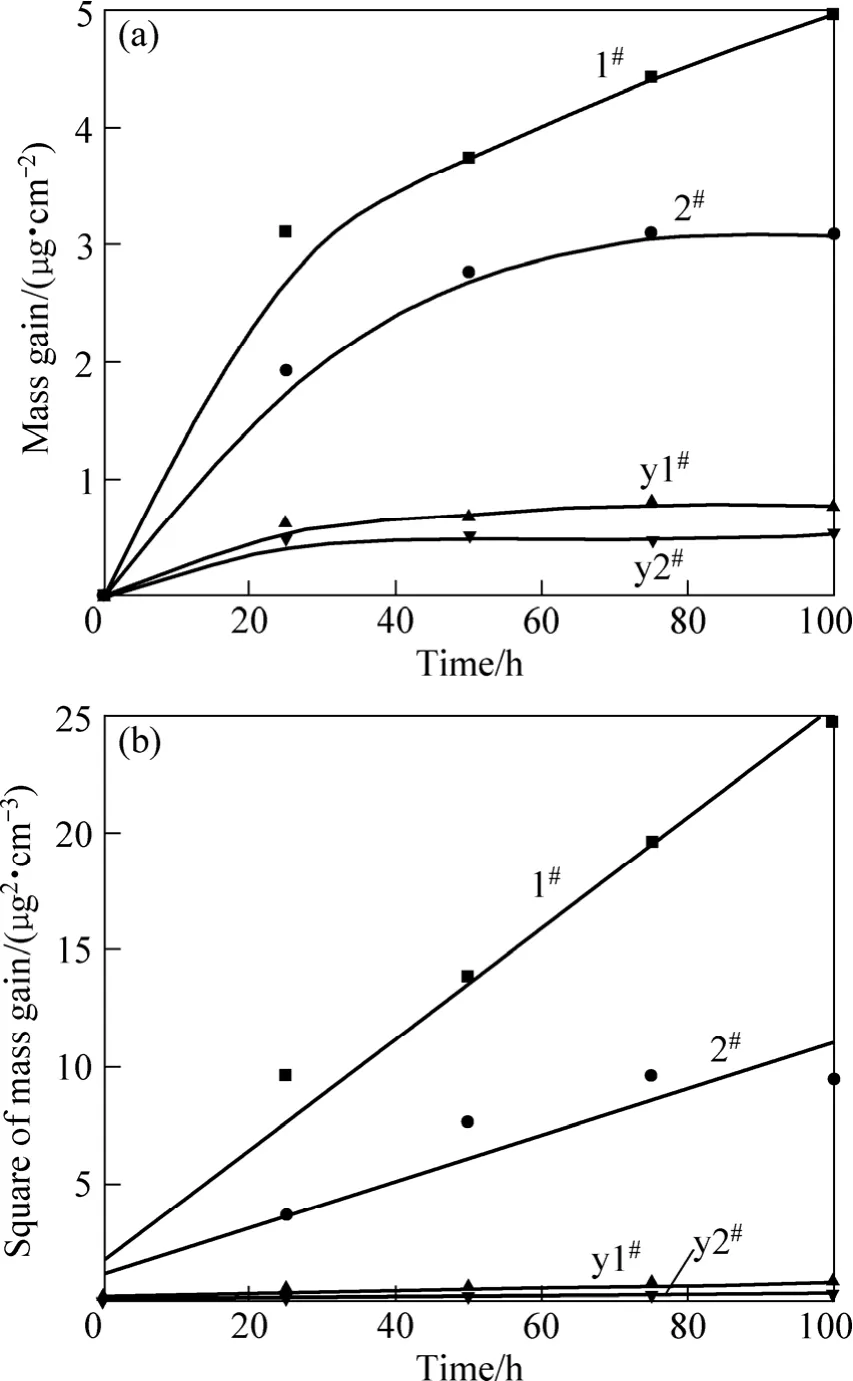
图1 不同试验合金粉末在600 ℃时的氧化动力学曲线Fig.1 Oxidation kinetics of different experimental alloy powder oxidized in air at 600 ℃
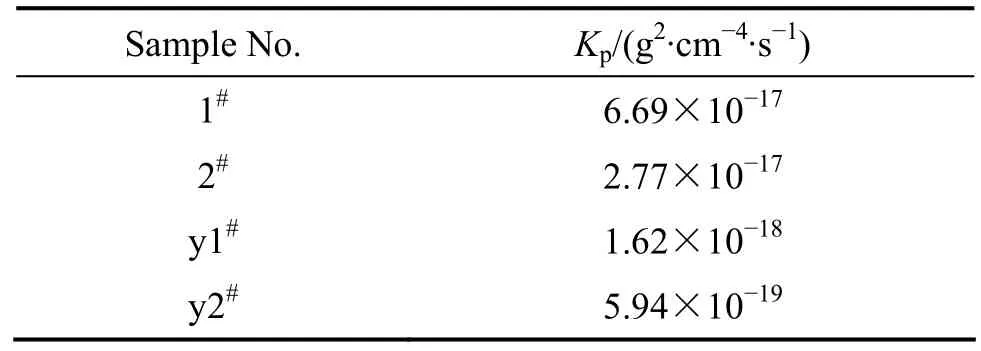
表2 不同试验合金粉末在600 ℃氧化100 h的抛物线速率常数Table 2 Parabolic rate constants of different experimental alloy powders oxidized in air at 600 ℃ for 100 h
2.2 物相分析
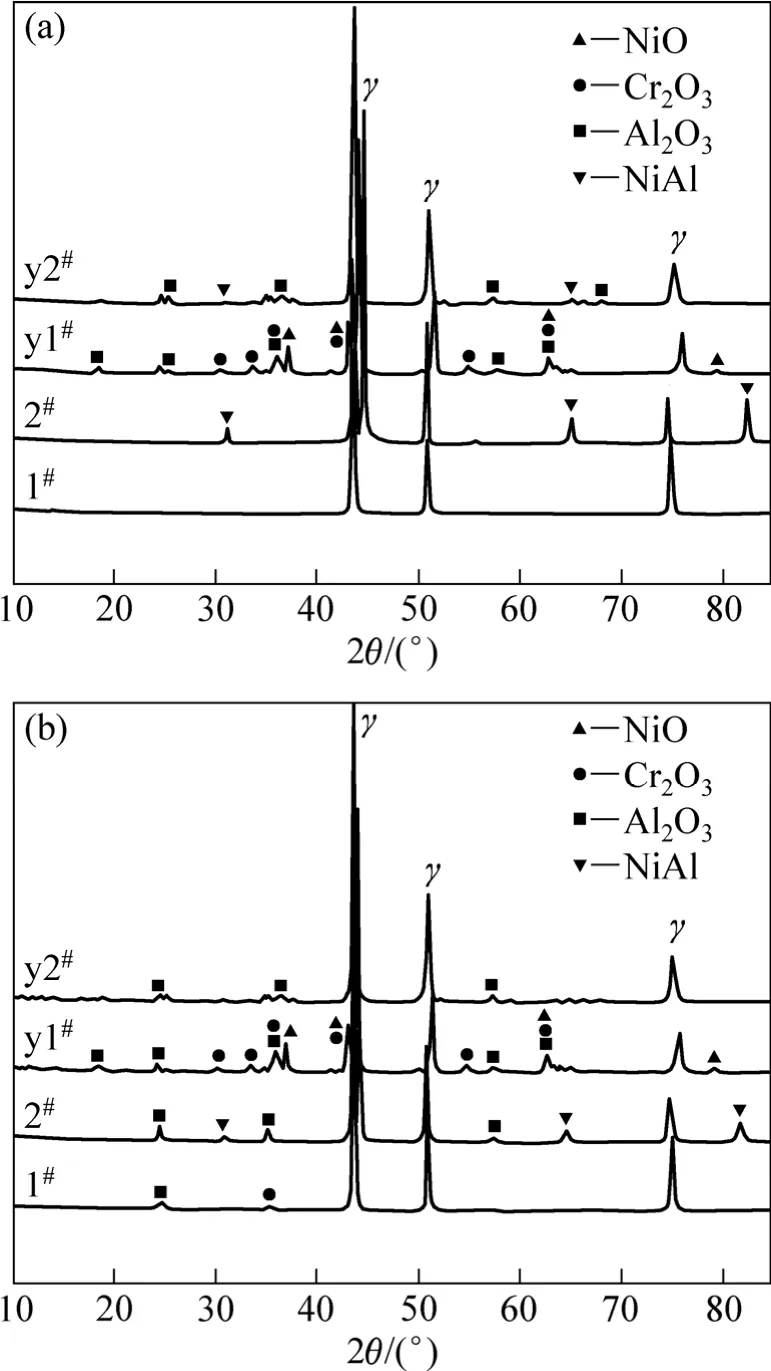
图2 氧化前、后不同试验合金粉末表面的XRD谱Fig.2 XRD patterns of surface of primitive and pre-oxidation alloy powders before and after oxidation: (a) Primitive and pre-oxidation of alloy powders; (b) Alloy powder oxidized in air for 100 h at 600 ℃
原始合金粉末及其预氧化合金粉末的 XRD谱如图 2(a)所示。由图 2(a)可知,随铝含量增加,2#合金粉末除基体γ相衍射峰外,还出现了NiAl的衍射峰。1#合金粉末预氧化后,表面生成Al2O3、Cr2O3及少量的NiO;2#合金粉末预氧化后,NiAl的衍射峰强度变得很弱,还明显出现了 Al2O3的衍射峰。图 2(b)所示为不同试验合金粉末在600 ℃氧化100 h后表面氧化物的 XRD 谱。从图 2(a)可以看出,1#合金粉末氧化100 h后表面生成Al2O3和Cr2O3,而2#合金粉末氧化后表面只检测到 Al2O3的生成;同时,预氧化粉末氧化100 h后的特征衍射峰没有明显的变化。
2.3 预氧化合金粉末截面氧化物形貌及分布
图3所示为y1#、y2#合金粉末的截面形貌及各元素分布。从试样截面氧化物形貌可以看出,预氧化后粉末表面形成了一层较连续的氧化膜。从元素的面分布情况可知,在 y1#、y2#合金粉末颗粒内部小范围区域有Al和O元素富集,说明粉末颗粒内部发生内氧化生成铝的氧化物。y1#合金粉末外氧化层中富含Cr、Al和O元素;而y2#合金粉末外氧化层只有Al和O元素富集。结合XRD分析结果可知,y1#合金粉末表面氧化膜的组成是 Cr2O3和 Al2O3的混合结构,而随铝含量增加,y2#合金粉末表面形成为单一的Al2O3氧化膜结构。
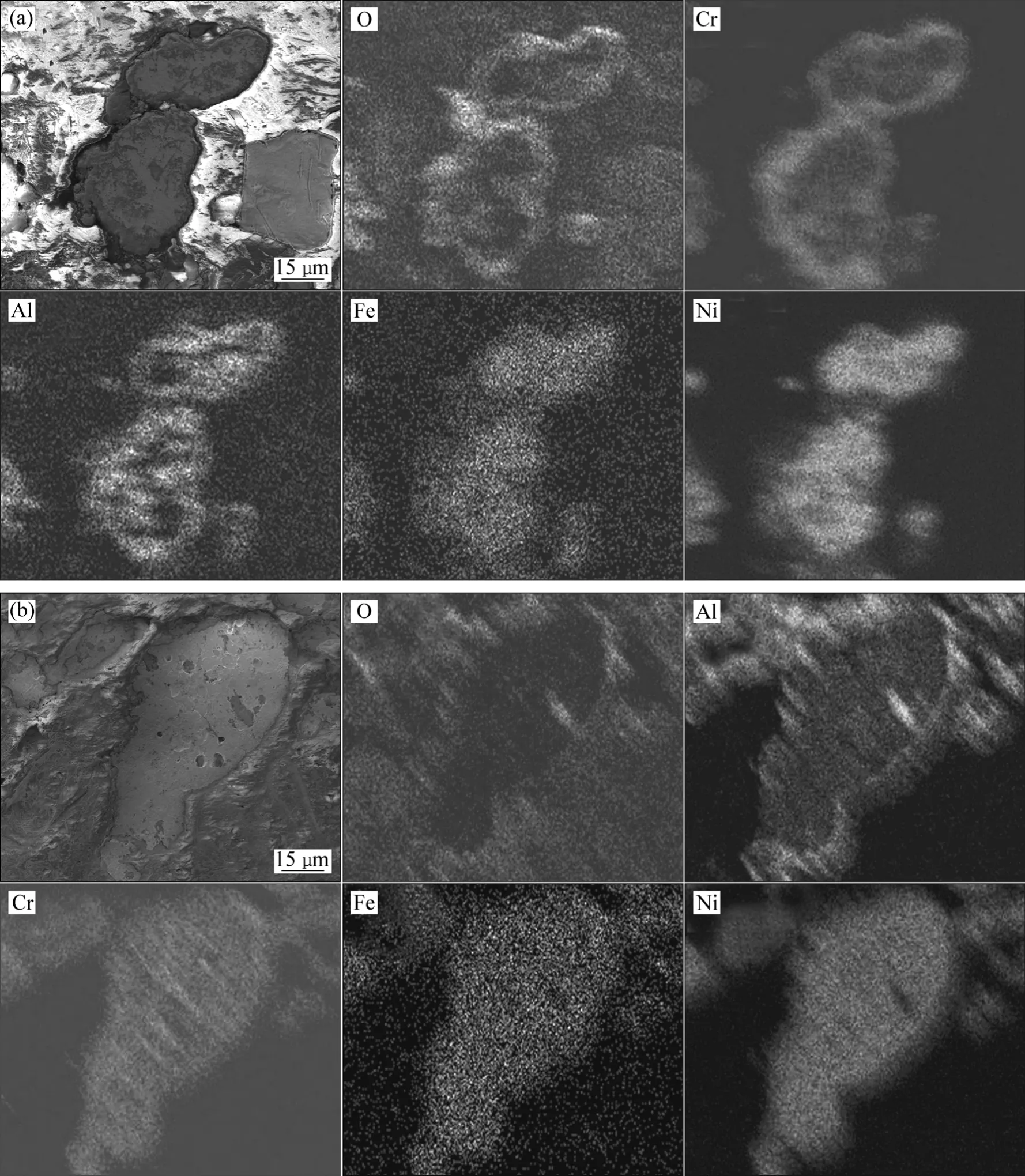
图3 y1#和y2#合金粉末的截面形貌及各元素分布Fig.3 Cross-sectional morphologies and elemental distributions of y1# (a) and y2 # (b) alloy powders
2.4 氧化粉末表面的氧化物形貌及分析
图4所示为合金粉末氧化前、后表面形貌。由图4可见,在600 ℃空气中氧化50 h后,1#合金粉末试样表面出现突起小颗粒(见图4(b)),2#合金粉末表面的颗粒略少些(见图 4(d))。1#、2#合金粉末预氧化后(见图4(e)和(g))表面形成由氧化物颗粒组成的较致密膜,预氧化的合金粉末在600 ℃空气中氧化50 h后,表面的形貌没有太大变化,只是氧化物颗粒有所长大(见图4(f)和(h))。利用能谱仪分析试样表面金属元素的平均含量,可知 1#合金粉末表面氧化膜的 Cr(30.74%,质量分数)、Al(41.23%)元素含量高于基体中的Cr(16%)、Al(4.5%)元素含量,2#合金粉末表面氧化膜的Al(35.69%)元素含量比基体中的 Al(9.0%)含量高。结合XRD分析结果可以断定,1#合金粉末在600 ℃空气中氧化后表面生成由 Cr2O3和 Al2O3组成的混合氧化膜结构;而2#合金的氧化膜组成只有Al2O3。

图4 不同实验合金粉末氧化前、后的表面形貌Fig.4 Surface morphologies of alloy powders before and after oxidation: (a), (c), (e) (g) 1#, 2#, y1#and y2# powders, respectively;(b), (d), (f), (h) 1#, 2#, y1#and y2# powders oxidized at 600 ℃ for 50 h, respectively
图5 所示为不同实验合金粉末在600 ℃空气中氧化75 h后的截面形貌。由图5可知,粉末表面形成了一层较连续的氧化膜,颗粒内部出现河流状的内氧化条纹。由1#合金粉末氧化50 h后截面的元素面分布情况可知(见图6),粉末颗粒表面出现了O、Al和Cr元素的富集,说明在氧化过程中,Al、Cr向合金表面迁移并在表面形成氧化物,同时也进一步证明1#合金粉末氧化后表面生成 Cr2O3和 Al2O3两种氧化物。图 7所示为SEM−EDS分析得出的2#合金粉末氧化膜厚度方向各元素的浓度分布。由图7可见,Al在氧化膜中的浓度高于在合金基体中的浓度,表明在该合金粉末氧化过程中,Al优先迁移到合金表面氧化为Al2O3。

图5 不同实验合金粉末在600 ℃氧化75 h的截面形貌Fig.5 Cross-sectional morphologies of different experimental alloy powders oxidized at 600 ℃ for 75 h: (a) 1#; (b) 2#; (c) y1#;(d) y2#
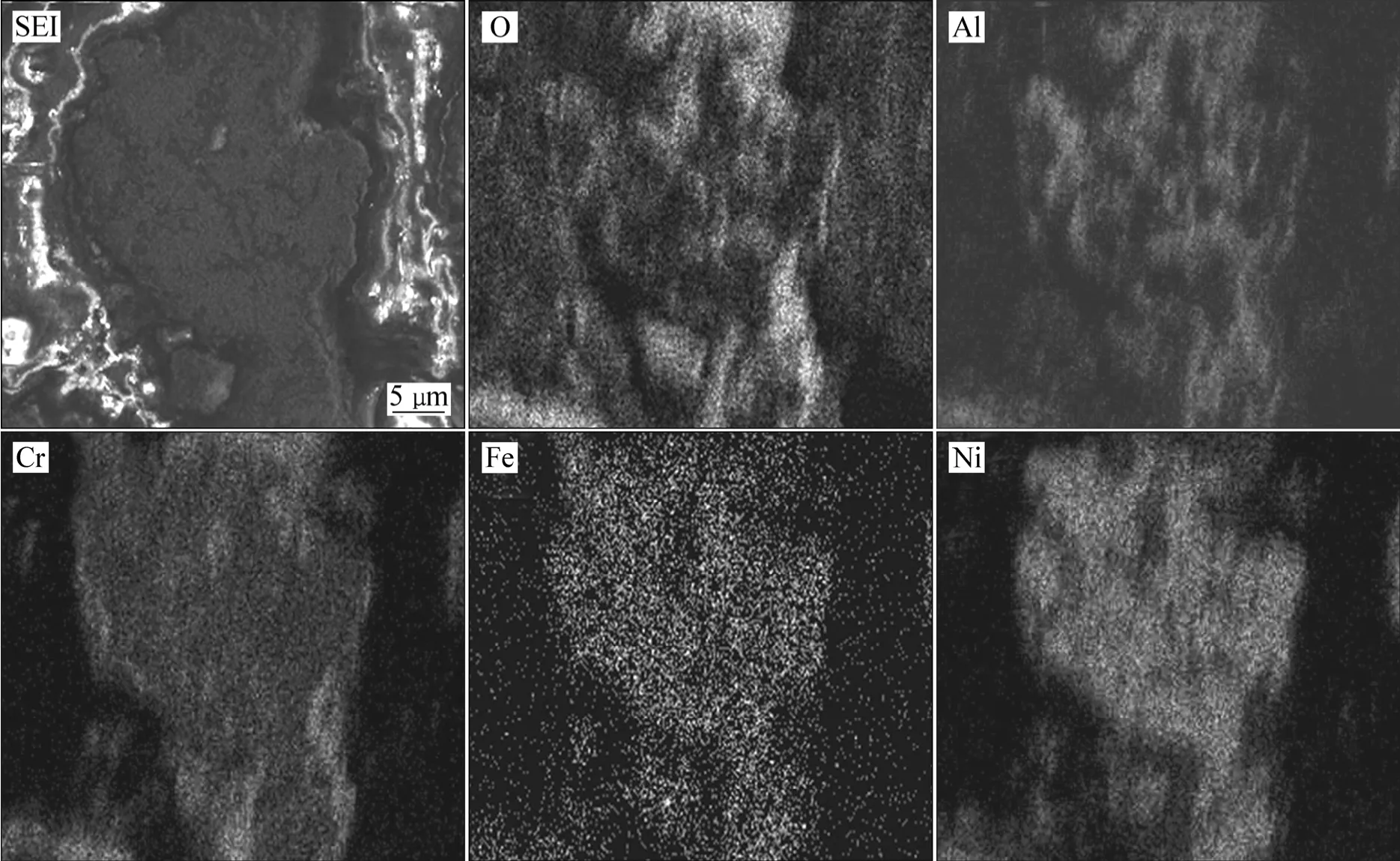
图6 1#合金粉末在600 ℃氧化50 h后的截面形貌及各元素面分布Fig.6 Cross-sectional morphology and plane elemental distributions of 1# alloy powder oxidized at 600 ℃ for 50 h
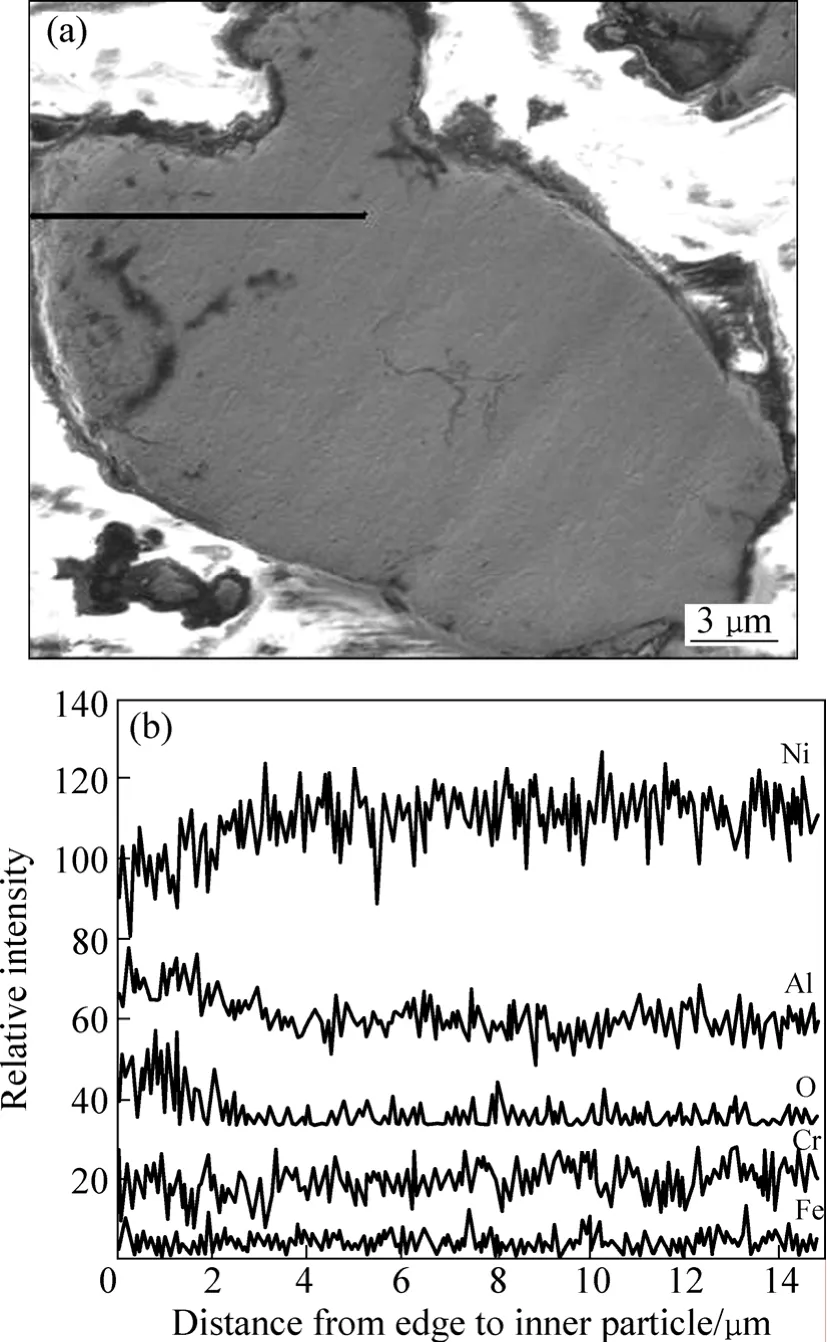
图7 2#合金粉末在600 ℃氧化100 h的断面SEM像及相应元素线分布曲线Fig.7 Cross-sectional SEM image (a) and corresponding elemental distribution curves (b) alloy for 2# powder oxidized at 600 ℃ for 100 h
3 讨论
3.1 氧化机理
根据瓦格纳的选择性氧化理论,合金初期氧化时,多种合金元素都可以发生氧化反应,氧化物种类和氧化膜结构随时间发生变化,直到形成稳定生长的氧化膜。形成稳定的保护性氧化膜的必要条件[13]为JM>J′M(其中JM为由合金内扩散向氧化膜/合金界面的M通量,J′M为通过氧化膜向外扩散被氧化的M通量)。如果JM<J′M,供给的M通量不足,合金/氧化膜界面的氧压增大并引起合金基体中其他元素氧化。对于本实验选择的Ni-Cr-Al三元合金来说,在氧化初期和过渡氧化阶段,NiO、Cr2O3和Al2O3这3种氧化物同时生成,形成薄膜。随后通过薄膜扩散氧的通量减少,更多的Cr2O3和Al2O3通过选择性氧化生成。如果Al含量很低,连续的Al2O3膜不能形成,元素Cr进一步与氧反应生成Cr2O3,且与NiO发生“吸氧反应”生成Cr2O3,从而促进致密的Cr2O3选择性氧化膜的生成。随着氧化的进行,氧通过致密氧化膜的扩散通量越来越低,在氧化膜/金属界面处氧的活度很低,只有氧活性较高的Al元素可以氧化,这样就发生了Al的内氧化。因此,1#合金粉末(4.5%Al)在 600 ℃氧化时,表面形成 Cr2O3和 Al2O3混合结构氧化膜;而对于铝含量较高的 2#合金粉末(9.0%Al),在 600℃氧化时生成的是Al2O3氧化膜。
图8所示为1 000 ℃下Ni-Cr-Al的氧化图[14]。由图8可以看出,Cr含量和Al含量变化对合金表面氧化物相的影响,可将Ni-Cr-Al合金分为3个区域。本实验选用的 1#合金粉末位于Ⅱ区边缘,2#合金粉末属于Ⅲ区。因此,2#合金粉末在1 000 ℃预氧化后形成的氧化膜与氧化图中的情况相符合,即形成 Al2O3氧化膜。而1#合金粉末在氧化图中的位置处于Ⅱ区和Ⅲ区交界处,且本实验合金粉末中还含有其他微量元素,因此,在本实验条件下形成了以Cr2O3和Al2O3为主的混合氧化膜结构。
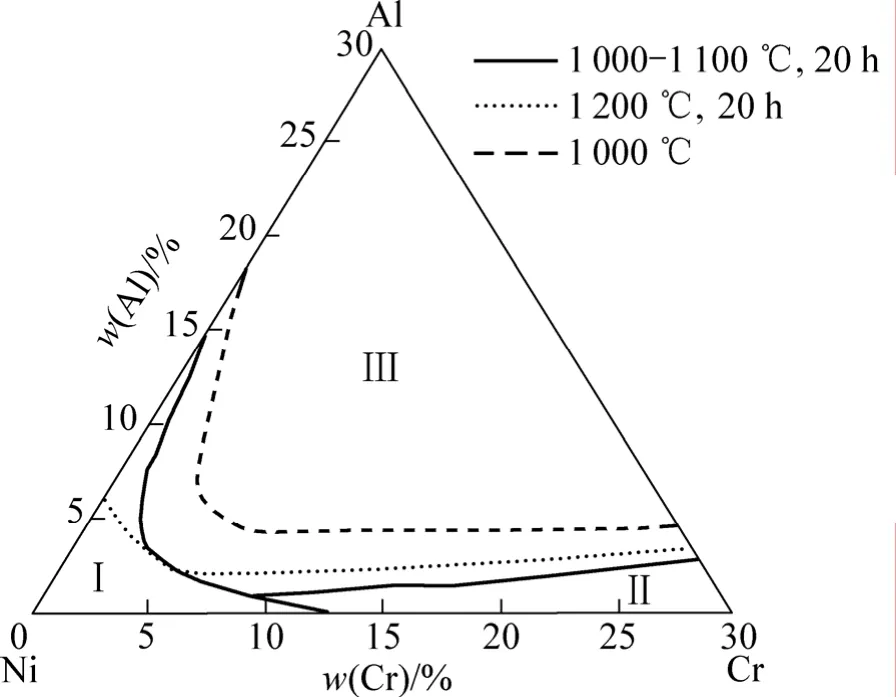
图8 Ni-Cr-Al三元合金1 000 ℃时的氧化[14]Fig.8 Oxide map of ternary Ni-Cr-Al alloys at 1 000 ℃[14](ZoneⅠ is coupled internal oxidation of aluminum plus chromium beneath external NiO scales; ZoneⅡ is internal oxidation of aluminum beneath external Cr2O3 scales; Zone Ⅲis external alumina scales)
根据氧离子在 Cr2O3的扩散系数[15]DO2-(C r2O3),氧离子在Al2O3氧化膜中的扩散系数[15]DO2-(A l2O3)和氧离子在镍中的扩散系数[16]DO2-(Ni)的计算公式如下:
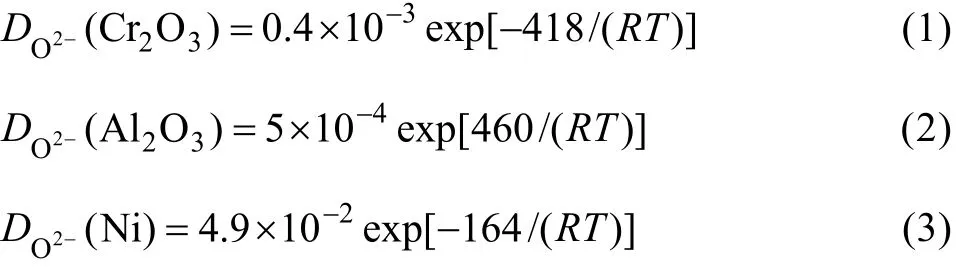
经计算可知,600 ℃时,氧离子在镍中的扩散系数为7.60×10−12cm2/s,而氧离子在Cr2O3和Al2O3氧化膜中的扩散系数分别为 3.94×10−29cm2/s和 1.5×10−31cm2/s。预氧化处理后,粉末表面形成了较连续、致密的氧化膜,有效地阻止氧离子向内扩散,且Al2O3氧化膜阻碍氧离子的扩散优于Cr2O3氧化膜的。所以,预氧化处理可显著提高粉末的抗氧化性能,表面形成单一Al2O3氧化膜结构的y2#粉末的抗氧化性能优于表面形成Cr2O3和Al2O3混合结构的y1#粉末的。
3.2 生成连续氧化铝膜的临界浓度
在 Ni-Cr-Al三元合金氧化时有两种内氧化的情况[14],对于本实验合金,欲生成单一连续的 Al2O3外氧化层,主要应避免第二种内氧化的发生,即避免形成Cr2O3外氧化膜,Al2O3内氧化。
第二种内氧化向外氧化转变时对应的临界 Al含量— NAOl*(C r2O3),可用如下公式计算[17]:
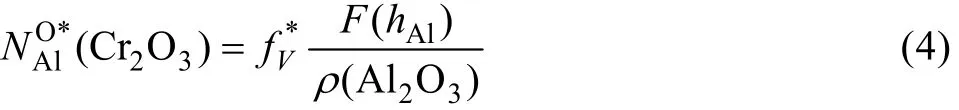
式中: fV*是发生转变时两种内氧化物的总体积分数的临界值,通常取 0.3。ρ(Al2O3)是合金与氧化物 Al2O3的摩尔体积比。镍基合金的摩尔体积近似等于纯镍的摩尔体积 V(Ni)=6.59 cm3/mol,Al2O3的摩尔体积V(Al2O3)为 12.86 cm3/mol。hAl=γφAl,φAl=DO/DAl(DO、DAl是O、Al在基体元素Ni中的扩散系数),γ是与内氧化动力学有关的参量,由下式得到:
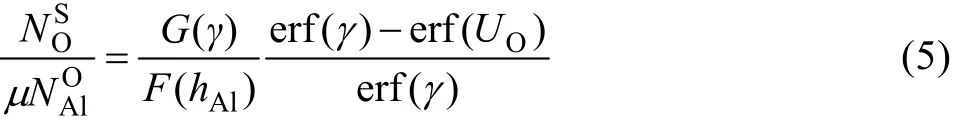
其中:UO可按计算;μ为内氧化物Al2O3中氧原子数与铝原子数之比;是Al在合金中的摩尔分数;为 Ni-Cr基中 Cr2O3氧化膜/合金界面处氧的溶解度,可以由已知数值的(Ni)(基体元素Ni与NiO达平衡时,基体中氧的浓度)计算得到,根据Sieverts准则[17]公式有
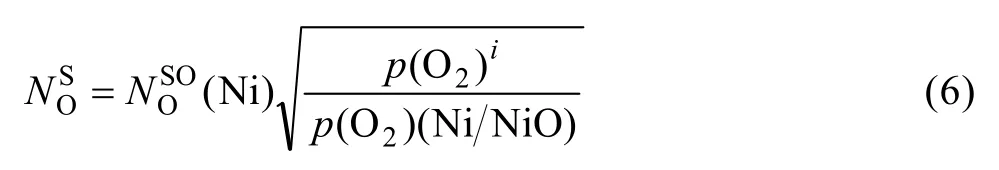
p(O2)(Ni/NiO)是 Ni 与 NiO平衡时的氧分压;与 Cr2O3氧化膜/合金界面处 Cr含量的关系公式[18]如下:

式中: pO*2为Cr与Cr2O3平衡分解压,ρCir与合金基体中Cr的摩尔浓度 ρCOr有关[19],可表示为

函数 F(r)定义[16]为

函数 G(r)定义[20]为

计算中需要的氧在镍中的溶解度[16]ρSO(Ni),氧
O在镍中的扩散系数[16]DO(Ni),铝在镍中的扩散[21]DAl( Ni-Al),铬在 Ni-20Cr合金中的扩散系数[22]DCr(Ni)由以下公式给出:
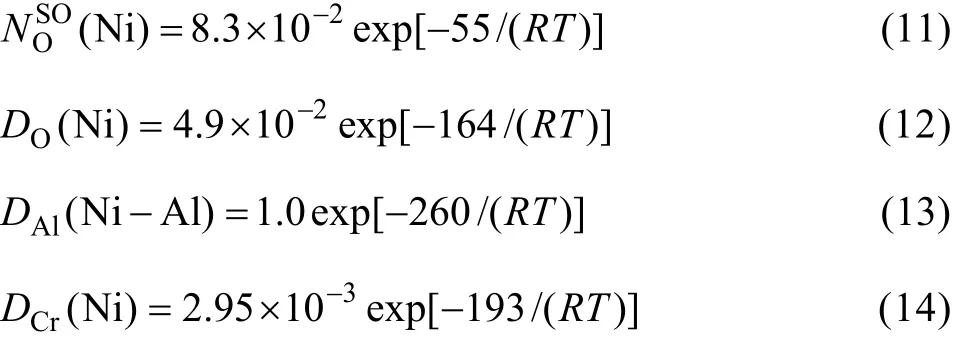
为了简化计算,将三元合金中的涉及的参数与二元合金的参数做近似处理。根据本实验中形成 Cr2O3外氧化膜的合金的抛物线速率常数为 6.69×10−17g2·cm−4·s−1,氧化膜厚度增长表征的抛物线速率常数kc(Cr2O3)为 2.47×10−17cm2·s−1。最终得出的第二种内氧化向单一 Al2O3外氧化膜转换的临界铝含量为5.66%(摩尔分数),换成质量分数为2.74%。
本实验所选用的 4.5%Al含量的合金,其铝含量大于计算得到的第二种内氧化向外氧化转变的临界铝含量 2.74%,但其在 600 ℃氧化时形成的是 Cr2O3和Al2O3混合结构氧化膜,而不是单一Al2O3外氧化膜。这是由于计算过程中做了很多简化处理,将三元合金中涉及的参数近似用二元合金的参数代替,还有就是一些Ni-Cr-Al合金中参量用相似镍基体系的参数值代替,使得理论计算得到的第二种内氧化向外氧化转变的临界铝含量值偏小。
4 结论
1) Ni-Cr-Al-Fe基合金粉末在600 ℃时的氧化质量增加遵循抛物线规律,铝含量的增加及预氧化处理均可提高合金粉末的抗氧化能力。预氧化处理后合金粉末的质量增量仅为原始粉末质量增量的 20%。
2) 当合金中铝含量从4.5%增加到9.0%,合金粉末氧化膜的组成由 Cr2O3和 Al2O3的混合结构转变为单一的 Al2O3氧化膜结构;单一的 Al2O3氧化膜更有利于提高合金粉末的抗氧化性能。
3) 预氧化后,粉末表面形成了较致密、连续的氧化膜,在整个氧化过程中,氧化速度主要受金属离子通过氧化膜向外扩散控制,有效地抑制Ni-Cr-Al-Fe基合金粉末的进一步氧化。
REFERENCES
[1] KORELL J, PAUR H R, SEIFERT H. Purification of synthesis gas at high temperatures[J]. Chemie Ingenieur Technik, 2009,81(8): 1132−1133.
[2] BRADY M P, GLEESON B, WRIGHT I G. Alloy design strategies for promoting protective oxide-scale formation[J]. The Journal of The Minerals, Metals & Materials Society, 2000,52(1): 16−21.
[3] YAMAMOTO Y, BRADY M P, LU Z P, LIU C T,TAKEYAMA M, MAZIASZ P J, PINT B A. Alumina-forming austenitic stainless steels strengthened by laves phase and MC carbide precipitates[J]. Metallurgical and Materials Transactions A, 2007, 38(11): 2737−2746.
[4] ZHENG Hai-zhong, LU Shi-qiang, ZHU Jian-yue, LIU Guang-ming. Effect of Al addition on the oxidation behavior of Laves phase NbCr2alloys at 1 373 K and 1 473 K[J]. Journal of Refractory Metals & Hard Materials, 2009, 27: 659−663.
[5] GRUSHKO B, KOWALSKI W, PAVLYUCHKOV D, MI S,SUROWIEC M. Al-rich region of the Al-Ni-Cr alloy system below 900 ℃[J]. Journal of alloys and compounds, 2009, 485:132−138.
[6] CHALIAMPALIAS D, PAPAZOGLOU M, TSIPAS S,PAVLIDOU E, SKOLIANOSS, STERGIOUDIS G,VOURLIAS G. The effect of Al and Cr additions on pack cementation zinc coatings[J]. Applied Surface Science, 2010,256: 3618−3623.
[7] YANG X, PENG X, WANG F. Effect of annealing treatment on the oxidation of an electrodeposited alumina-forming Ni-Al nanocomposite[J]. Corrosion Science, 2008, 50(11): 3227−3232.[8] ZHANG Z G, GESMUNDO F, HOU P Y, NIU Y. Criteria for the formation of protective Al2O3scales on Fe-Al and Fe-Cr-Al alloys[J]. Corrosion Science, 2006, 48(3): 741−765.
[9] GUO Ping-yi, SHAO Yong, LI Lei. High temperature oxidation of Fe3Al coating prepared by high energy micro-arc alloying process[J]. Journal of Chinese Society for Corrosion and Protection, 2009, 29(6): 431−436.
[10] HAMID A UI. A TEM study of the oxide scale development in Ni-Cr-Al alloys[J]. Corrosion Science, 2004, 46: 27−36.
[11] XUE Mao-quan. Effect of graphite addition on oxidation behavior of Ni-Cr-based superalloy at 900 ℃[J]. Rare Metal Materials and Engineering, 2009, 38(7): 1146−1149.
[12] TERPSTRA R L, ANDERSON I E, GLEESON B. Development of metallic hot gas filters[C]. 2001 International Conference on Powder Metallurgy & Particulate Materials. MPIF-APMI,Princeton, NJ, 2001, 8: 4.
[13] ZHU Y, MIMURA K, ISSHIKI M. Oxidation mechanism of Cu2O to CuO at 600−1 050 ℃[J]. Oxidation of Metals, 2004,62(3/4): 207-222.
[14] 李美栓. 金属的高温腐蚀[M]. 北京: 冶金工业出版社, 2001:249.LI Mei-shuan. High temperature corrosion of metals[M]. Beijing:Metallurgical Industry Press, 2001: 249.
[15] 李铁藩. 金属高温氧化与热腐蚀[M]. 北京: 化学业出版社,2003: 33.LI Tie-fan. High temperature oxidation and hot corrosion of metal[M]. Beijing: Chemical Industry Press, 2003: 33.
[16] NIU Y, ZHANG X J, WU Y, GESMUNDO F. The third-element effect in the oxidation of Ni-xCr-7Al(x=0, 5, 10,15 at. %)alloys in 1 atm O2at 900−1 000 ℃[J]. Corrosion Science, 2006, 48: 4020-4036.
[17] NIU Y, GESMUNDO F. The internal oxidation of ternary alloys,Ⅵ: The transition from internal to external oxidation of the most-reactive component under intermediate oxidant pressures[J]. Oxidation of Metals, 2004, 62(5/6): 391-410.
[18] GESMUNDO F, VIANI F. The formation of multilayer scales in the parabolic oxidation of pure Metals-Ⅱ. Temperature and pressure dependence of the different rate constants[J]. Corrosion Science, 1987, 18(3): 231-243.
[19] NIU Y, GESMUNDO F, FU G Y, DOUGLASS D L. Sulfidation of three two-phase Cu-Cr alloys in H2-H2S mixtures at 400−600℃[J]. Oxidation of Metals, 1998, 50(5/6): 327-354.
[20] NIU Y, GESMUNDO F. The internal oxidation of ternary alloys.Ⅷ: The transition from the internal to the external oxidation of the two most-reactive components under high-oxidant pressures[J]. Oxidation of Metals, 2006, 65(5/6):329-354.
[21] GUST W, HINTZ M B, LODDING A, ODELIUS H, PREDEL B. Impurity diffusion of aluminum in nickel single crystals studied by secondary ion mass spectrometry(SIMS)[J]. Physica Status Solidi A, 1981, 64(1): 187-194.
[22] SELTZER M S, WILCOX B A. Diffusion of chromium and aluminum in nickel-20 chromium and TDNiCr (nickel-20 chromium-2 thorium dioxide)[J]. Metallurgical Transaction,1972, 3(9): 2357-2362.
High-temperature oxidation resistance behavior of Ni-Cr-Al-Fe based powders
LI Wei-jie1, LIU Yong1, WANG Yan1, HAN Chao1, TANG Hui-ping2
(1. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China;2. State Key Laboratory of Porous Metals Materials, Northwest Institute for Nonferrous Metal Research, Xi’an 710016, China)
The oxidation resistance of Ni-Cr-Al-Fe based powders at 600 ℃ was investigated, and the effects of aluminum content and pre-oxidation treatment on its oxidation resistance behavior were analyzed. The Ni-Cr-Al-Fe based powders were prepared by water atomization. The oxidation kinetics was investigated by conducting the mass increase analyses. The morphology and chemical composition of the oxide films were characterized by FE-SEM (EDS) and XRD,respectively. The oxidation mechanisms of the alloy powders were also discussed by comprehensive analysis of oxidized kinetics and the phase composition of oxide layers. The results indicate that the oxidized kinetic curves of Ni-Cr-Al-Fe based powders at 600℃ follow the parabolic rule. The increase of the aluminum content and the pre-oxidation can enhance the oxidation resistance of Ni-Cr-Al-Fe based powders. With the increase of aluminum content, the oxide film changes from a combined structure of Cr2O3and Al2O3to single Al2O3structure, which is beneficial to the increase oxidation resistance of Ni-Cr-Al-Fe based powders. The further oxidation of Ni-Cr-Al-Fe based powders can be effectively controlled after the pre-oxidation treatment.
Ni-Cr-Al-Fe based powders; high-temperature oxidation resistance; pre-oxidation; oxidation mechanism
TG172.3
A
1004-0609(2010)12-2327-09
国家高技术研究发展计划资助项目(2009AA032601);中南大学博士后基金资助项目(2009−14)
2009-08-25;
2009-11-22
刘 咏,教授,博士;电话:0731-88836939;E-mail:yonliu11@yahoo.com.cn
(编辑 龙怀中)
