PPARγ激动剂对急性胰腺炎小鼠肝损伤的影响
2010-11-24孙俊涛许刚田克立
孙俊涛 许刚 田克立
·短篇论著·
PPARγ激动剂对急性胰腺炎小鼠肝损伤的影响
孙俊涛 许刚 田克立
过氧化物酶体增殖物激活受体γ(PPARγ)是一类依赖配体活化的转录因子,许多研究表明PPARγ通过抑制NF- κB的活化来发挥抗炎作用[1-3]。本实验应用PPARγ激动剂干预急性胰腺炎(AP)小鼠,观察其肝脏NF-κB和PPARγ的表达,探讨AP肝功能损伤机制及探索新的治疗途径。
一、材料和方法
1.实验动物及分组:健康雄性昆明小鼠72只,体重(30±2)g,购自山东大学实验动物中心。按数字表法将小鼠随机分为对照组、AP组和罗格列酮干预组(干预组),每组24只。采用腹腔注射雨蛙肽(50 μg/kg体重,Sigma公司)建模,每小时注射一次,共7次。干预组在建模前30 min腹腔内注射罗格列酮(CAYMAN CHEMICAL 公司)10 mg/kg体重,AP组注射等容积的生理盐水,对照组仅腹腔注射等量生理盐水。制模后6、12、24 h摘眼球取血,分离血清。引颈脱臼处死小鼠,收集肝脏标本,液氮冻存。
2.血清淀粉酶、ALT和AST含量检测:采用TOSHIBA-40FR全自动生化分析仪测定。
3.肝脏组织NF-κB和PPARγ mRNA测定:采用Trizol试剂(Invitrogen公司)提取肝组织总RNA。采用RT-PCR法检测NF-κB和PPARγ mRNA。PPARγ 上游引物 5′-CGTGATGGAAGACCACTCGC-3′,下游引物5′-AACCTGATGGCATTGTGAGA-3′,产物477 bp; NF-κB上游引物5′-GTGACAAGCCTGTAGCC-3′,下游引物 3′-CCAGATGAAACCCTAGTAA-5′ ,产物867 bp;内参β-actin上游引物5′-TGGTGGGAATGGGTCAGA-3′,下游引物 5′-ACGGTTGGCCTTAGGGTT-3′,产物218 bp。逆转录反应按RevertAidTM First Strand cDNA Synthesis试剂盒(Invitrogen公司)说明书进行。PPARγ PCR反应条件:94℃ 1 min,60℃ 50 s,72℃ 1 min,32个循环。β-actin反应条件:94℃ 30 s,60℃ 30 s,72℃ 1 min, 28个循环。NF-κB反应条件:94℃ 1 min,56℃ 50 s,72℃ 1 min, 35个循环。扩增产物经电泳分离,图像分析仪扫描,利用AlphaImager2200软件进行灰度测定,以目的条带与内参β-actin的灰度值比作为mRNA的相对表达量。
4.肝组织PPARγ和NF-κB蛋白表达检测:采用Western blotting方法。组织蛋白按PIPA裂解液(盖宁生物科技有限公司 )说明书提取。抗NF-κB p65、PPARγ、β-actin抗体均购自Santa Cruz公司。结果用图像扫描分析,以目的蛋白与内参蛋白灰度值比表示蛋白相对表达量。
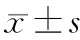
二、结果
1.血清淀粉酶、ALT和AST的变化:AP组和干预组血清淀粉酶、ALT和AST水平均较对照组显著升高(P值均lt;0.01);干预组血清淀粉酶、ALT和AST水平又均显著低于同时间点的AP组(P值lt;0.01或lt;0.05,表1)。
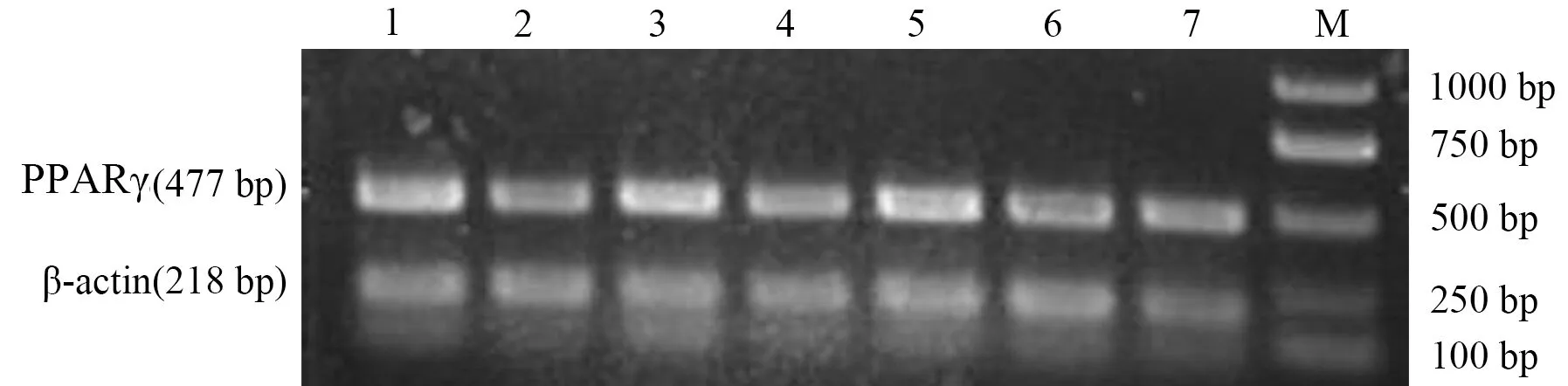
2.肝脏组织PPARγ和NF-κB mRNA表达的变化:AP组PPARγ mRNA表达较对照组下降,6 h和12 h点具有统计学差异(Plt;0.01和Plt;0.05);干预组PPARγ mRNA表达水平明显高于同时点的AP组和对照组(P值均lt;0.01,表1,图1)。AP组NF-κB mRNA表达水平较同时点对照组均显著升高(P值均lt;0.01),其中以12 h时升高最显著;干预组NF-κB mRNA表达明显高于对照组但又均显著低于同时点AP组(P值均lt;0.01,表1,图2)。
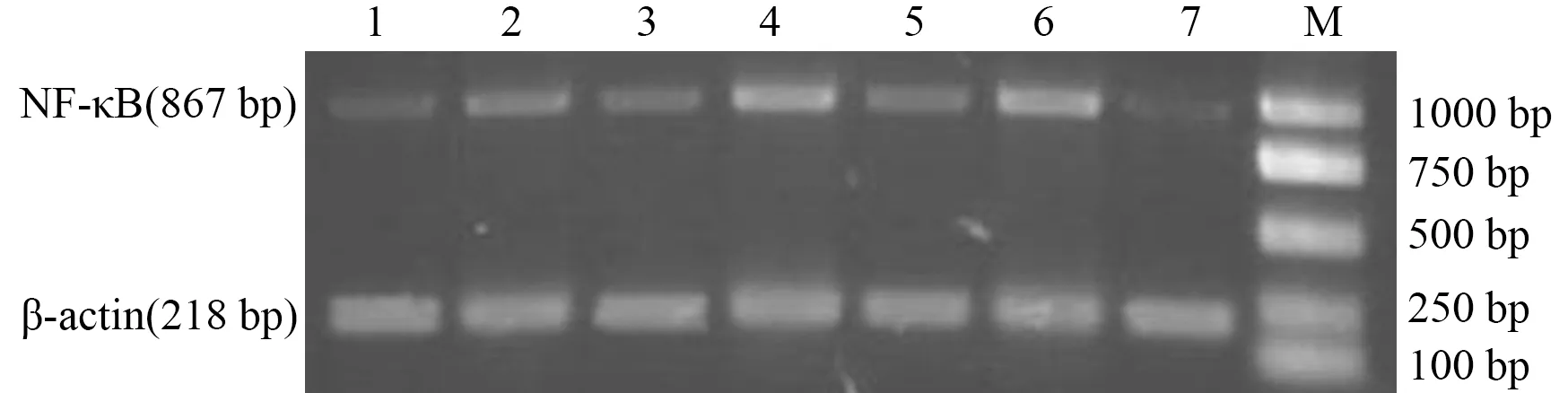
3.肝脏组织PPARγ和NF-κB 蛋白表达的变化:AP组PPARγ蛋白表达均低于同时点的对照组(P值均lt;0.05);干预组PPARγ蛋白表达均显著高于同时点AP组和对照组(P值均lt;0.01,表1,图3)。肝脏组织NF-κB p65蛋白各时点的表达结果均为AP组gt;干预组gt;对照组,各时点各组间均有显著性差异(P值均lt;0.01),其中AP组在制模后12 h升高最显著(表1,图4)。
1、3、5分别为24、12、6 h干预组;2、4、6分别为24、12、6 h AP组;7为6 h对照组
图1小鼠肝脏组织PPARγ mRNA 的表达
1、3、5分别为24、12、6 h干预组;2、4、6分别为24、12、6 h AP组;7为6 h对照组

图2 小鼠肝脏组织NF-κB mRNA 的表达
注:与对照组比较,aPlt;0.05,bPlt;0.01;与AP组比较,cPlt;0.05,dPlt;0.01

1、3、5分别为24、12、6 h AP组;2、4、6分别为24、12、6 h干预组;7为6 h对照组
图3小鼠肝脏组织PPARγ蛋白表达
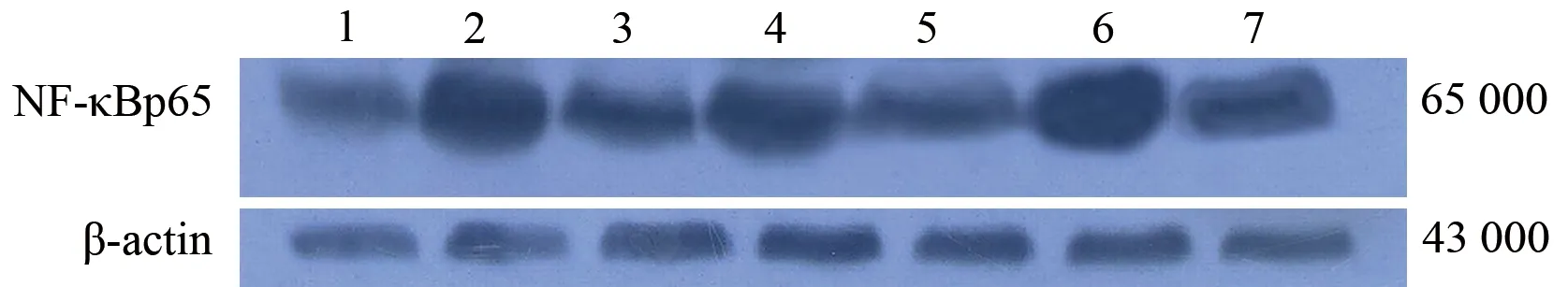
1、3、5分别为24、12、6 h AP组;2、4、6分别为24、12、6 h干预组;7为6 h对照组
图4小鼠肝脏组织NF-κBp65蛋白表达
讨论AP常伴有全身炎症反应综合征(SIRS)发生,若得不到有效控制,可并发多器官功能衰竭综合征(MODS),最终危及生命。肝脏具有物质代谢、分泌、排泄和生物转化等功能。因其血供丰富,在AP时非常容易合并损伤,80%的AP患者有肝功能损害[4]。肝脏损害程度与AP严重程度密切相关,且影响病程和预后。本实验结果显示,AP组和干预组小鼠血清淀粉酶、ALT和AST水平较对照组均明显升高;干预组又明显低于AP组,说明AP组存在肝损伤,而罗格列酮能减轻肝损伤的程度。
Dunn等[5]在AP早期的胰腺提取物中发现NF-κB DNA结合活动明显增强,而抑制NF-κB活性可阻止淀粉酶水平升高,促进炎症恢复。Satoh等[6]报道,NF-κB在AP造模后6 h就出现活化。本实验用雨蛙肽复制AP模型,结果显示对照组肝脏NF-κB微弱表达;AP组肝脏NF-κB活性明显升高,说明AP时肝脏组织中NF-κB被活化;干扰组小鼠肝脏NF-κB的表达则明显低于AP组,表明罗格列酮对AP小鼠肝脏NF-κB表达有抑制作用。实验证实,NF-κB的活化能增加炎症介质(如IL-6、IL-8、TNF-α、单核细胞趋化蛋白-1等)的表达[7-8]。因此,罗格列酮通过抑制NF-κB活化而减轻组织的损害。
近年研究发现,PPARγ除在糖和脂肪代谢、免疫调节、细胞生长和分化中起作用外,还在炎症反应中发挥着重要作用。Rollins等[9]应用PPARγ激动剂能呈剂量依赖性减轻AP的严重程度,认为PPARγ在AP早期阶段的炎症级联中起着直接作用。Ivashchenko等[10]报道,雨蛙肽能加重胰腺上皮PPARγ敲除小鼠所致的炎症反应,且罗格列酮在水肿、巨噬细胞浸润和促炎细胞因子表达方面的抗炎效应与对照组相比显著减弱,提示胰腺上皮PPARγ在抑制炎症过程中发挥重要作用。本实验结果显示,PPARγ在AP组肝脏中表达明显降低,罗格列酮干预后,PPARγ表达量显著升高,与国外研究结果一致。
总之,肝脏NF-κB参与并能加重AP时肝损伤过程,罗格列酮有可能通过激活PPARγ的活性、抑制NF-κB的活化起到减轻肝脏损伤程度的作用,为AP治疗提供新的思路。
[1] Sen R,Baltimore D.Multiple nuclear factors interact with the immunoglobulin enhancer sequences.Cell,1986,46:705-716.
[2] Straus DS,Pascual G,Li M,et al. 15-Deoxy-D12,14-prostaglandin J2 inhibits multiple steps in the NF-kappaB signaling pathway.Proc Natl Acad Sci USA,2000,97:4844-4849.
[3] Pascual G,Fong AL,Ogawa S,et al.A SUMOylation-dependent pathway mediates transrepression of inflammatory response genes by PPAR-gamma.Nature,2005,437:759-763.
[4] Blamey SL,Imrie CW,O′Neill J,et al.Prognostic factors in acute pancreatitis.Gut,1984,25:1340-1346.
[5] Dunn JA,Li C,Ha T,et al.Therapeutic modification of nuclear factor-kappaB binding activity and tumor necrosis factor-alpha gene expression during acute biliary pancreatitis.Am Surg,1997,63:1036-1043.
[6] Satoh A,Shimosegawa T,Fujita M,et al.Inhibition of nuclear factor-kappaB activation improves the survival of rats with taurocholate,pancreatitis.Gut,1999,44:253-258.
[7] Xue D,Zhang W,Zhang Y,et al.Adjusting effects of baicalin for nuclear factor-kappaB and tumor necrosis factor-alpha on rats with caerulein-induced acute pancreatitis.Mediators Inflamm,2006,26295.
[8] Algül H,Tando Y,Schneider G,et al.Acute experimental pancreatitis and NF-kappaB/Rel activation.Pancreatology,2002,2:503-509.
[9] Rollins MD,Sudarshan S,Firpo MA,et al.Anti-inflammatory effects of PPAR-gamma agonists directly correlate with PPAR-gamma expression during acute pancreatitis.J Gastrointest Surg,2006,10:1120-1130.
[10] Ivashchenko CY,Duan SZ,Usher MG,et al. PPAR-gamma knockout in pancreatic epithelial cells abolishes the inhibitory effect of rosiglitazone on caerulein-induced acute pancreatitis. Am J Physiol Gastrointest Liver Physiol,2007,293:G319-G326.
2009-05-20)
(本文编辑:屠振兴)
10.3760/cma.j.issn.1674-1935.2010.02.023
257034 山东东营,山东省东营市胜利油田中心医院消化内科(孙俊涛);中国人民解放军济南军区第四五六医院消化内科(许刚);山东大学医学院生物化学与分子生物学研究所(田克立)
田克立,Email:tiankeli@sdu.edu.cn
