盐酸左氧氟沙星在大鼠胰腺的药代动力学研究
2010-11-24刘德鼎肖和平王卓周佳宋彬杨琳刘瑞黄怡
刘德鼎 肖和平 王卓 周佳 宋彬 杨琳 刘瑞 黄怡
·论著·
盐酸左氧氟沙星在大鼠胰腺的药代动力学研究
刘德鼎 肖和平 王卓 周佳 宋彬 杨琳 刘瑞 黄怡
目的研究盐酸左氧氟沙星在大鼠胰腺组织的药代动力学。方法采用微透析技术对大鼠胰腺组织和血液进行同步取样,联合反相高效液相色谱实时检测胰腺组织和血液中盐酸左氧氟沙星的浓度变化,所得药物浓度数据用WinNonlin软件处理。结果大鼠血液中的游离左氧氟沙星浓度在给药后10 min时最高,为(65.23±12.9) μg/ml,胰腺组织在20 min到达峰浓度(30.56±3.22) μg/ml,然后持续下降;给药后20 min时胰腺组织的药物浓度开始高于血清,并持续至100 min,然后下降,两者浓度始终保持接近。血液、胰腺的药时曲线下面积分别为(2914.38±205.73)min·μg-1·ml-1和(2465.11±258.56)min·μg-1·ml-1。结论微透析采样技术联合反相高效液相色谱检测方法可以准确客观地反映药物在组织和血液中的药代动力学特点,盐酸左氧氟沙星具有较高的胰腺组织药物浓度。
左氧氟沙星; 微透析; 药代动力学; 药效学; 高效液相色谱法
胰腺感染是重症急性胰腺炎(SAP)患者病死的主要原因,约占80%。盐酸左氧氟沙星是新一代氟喹诺酮类抗菌药,系氧氟沙星的光学S-(-)异构体,其作用机制为抑制细菌拓扑异构酶Ⅱ的活性,抑制细菌DNA复制而起到杀菌作用。它具有较好的临床药动学特性、较佳的组织脏器及细胞渗透性,对大多数肠杆菌科细菌有较强的抗菌活性[1],在急性胰腺炎(AP)并发感染时临床医师常经验性选用此药[2]。复习文献,仅有环丙沙星、氟康唑、厄他培南和莫西沙星在胰腺的药代动力学报道[3-6],故本实验同步测定盐酸左氧氟沙星在大鼠胰腺和血液中的浓度,观察其在胰腺组织的药代动力学特点。
材料与方法
一、实验动物和仪器、试剂
SD大鼠6只,SPF级,体重220~250 g,雄性,第二军医大学动物中心提供。微透析设备为瑞典CMA公司产品,包括微量泵(CMA402)、微量收集器(CMA820)、1 ml注射器、血管及胰腺探针(CMA/20 PES)。探针内透析膜长度10 mm,直径0.5 mm,截留分子量100 000。LC-2010AHT高效液相色谱仪为日本岛津公司产品,Kromasil C-18柱150 mm×4.6 mm,5μm。流动相由0.4%磷酸/三乙胺(pH 3.58)与甲醇(v/v)以70∶30组成,流速1.0 ml/min,柱温40℃,检测波长295 nm,进样量10 μl。
试剂包括盐酸左氧氟沙星标准品,盐酸左氧氟沙星原料药(武汉合中生化制造有限公司,纯度99%,批号20090901),戊巴比妥钠(Sigma公司,纯度≥98%,批号P3761),ACD液(枸橼酸钠22 mg/ml,枸橼酸8 mg/ml,葡萄糖24.5 mg/ml,上海输血技术有限公司,批号09081621B),甲醇(TEDIA,色谱纯),超纯水,以及分析纯级的三乙胺和磷酸。
二、探针回收率测定
采用反向透析法。大鼠麻醉后固定于37℃保温垫,取腹正中切口进腹,循血管间隙将微透析探针植入胰腺实质,并固定关腹。采用经左侧股静脉途径将血管探针植入下腔静脉[7]。探针植入成功后,胰腺探针灌注Ringer液;血管探针灌注ACD抗凝液,以防止探针透析膜部发生凝血[8]。经过术后2 h稳定期,更换各含盐酸左氧氟沙星(中国药品生物制品检定所,纯度99.8%)1 μg/ml的Ringer和ACD液,以2 μl/min的恒定速率分别对胰腺、血管进行灌流。灌注液(Cperf)和透析液(Cdial)中的药物浓度均用HPLC测定。探针的在体回收率(Rdial)用下列公式计算:Rdial=(Cperf-Cdial)/Cperf。体内实际药物浓度(Cu)可由体内连续监测所得透析液浓度(Cm)经公式Cu=Cm/Rdial转化获得。
三、药代动力学分析
盐酸左氧氟沙星模拟人体常用给药剂量(400 mg/d),大鼠给药量为42 mg/kg体重[9]。经大鼠尾静脉15 min内推注完毕,随即开始收集透析样品,前240 min每间隔10 min收集一次样品,以后每20 min收集一次样品,至360 min时结束,同步监测给药后360 min内的大鼠血液及胰腺药物浓度变化。
使用Phoenix WinNonlin(Pharsight Corporation,Version 6.1,2009)软件以非房室模型法获得药动学数据。根据测量值计算曲线下面积(AUC),AUC=AUC(0-t)+AUC(t-inf)=AUC(0-t)+Clast/λz ;一阶矩曲线下面积(AUMC),AUMC=AUM Clast+(tlast×Clast/λz )+Clast/(λz )2;平均驻留时间(MRT),MRT=AUMC/AUC。其中λz 为对数药物浓度-时间曲线尾段指数段的斜率,Clast和tlast为最后(360 min时)的浓度和时间。血液与胰腺的药物分布系数用AUC胰腺/AUC血液计算,盐酸左氧氟沙星对血胰屏障的通透率(penetration ratio,PR)用C胰腺/C血液计算。
结 果
一、盐酸左氧氟沙星的色谱条件考查
在本实验条件下,透析液中无内源性干扰物质,左氧氟沙星峰形良好,分离度良好,保留时间为3.58 min。
准确称取盐酸左氧氟沙星标准品,加超纯水配成系列溶液,平行操作3份,取10 μl进样,HPLC测定并记录峰面积,其最低定量限为0.0304 μg/ml。以左氧氟沙星峰面积(Y)对浓度(X)进行线性回归,所得标准曲线为:Y=54680.4X-12610.8(r2=0.9998),表明透析液中左氧氟沙星在0.0304~125 μg/ml的浓度范围内线性良好。
取左氧氟沙星低、中、高3个浓度的标准品溶液,在1 d内连续测定6次,日内精密度(RSD)分别为0.62%、6.45%、3.18%;连续3 d测定,各浓度的日间精密度分别为0.87%、6.28%、5.55%。精密度和准确度均符合生物样品测定要求。
二、盐酸左氧氟沙星的药代动力学
6只大鼠血液和胰腺探针的平均回收率分别为(58±2)%和(34±1)%。1只大鼠胰腺探针的回收率较低,仅为27%,其余的回收率在34%~37%。样品收集完成后,所有实验动物行剖腹探查,未发现胰腺出血及异常液体积聚。后将探针留置于胰腺内行石蜡切片,证实探针植入部位为胰腺实质。
非房室模型参数详见表1。血液中盐酸左氧氟沙星浓度在给药后10 min时最高,Cmax为(65.23±12.9) μg/ml,个体最高值为104.76 μg/ml;胰腺中药物在20 min时达峰值,Cmax为(30.56±3.22) μg/ml,然后持续下降。20 min时胰腺组织的药物浓度开始高于血清,并持续至100 min,期间9个取样点的血胰屏障通透率(PR)=1.09±0.1,最高为1.27;从110 min起胰腺药物浓度低于血清,直至取样结束,期间20个取样点的PR=0.87±0.05,最低值为0.79。血液、胰腺的药时曲线下面积AUC(0-inf)分别为(2914.38±205.73)min·μg-1·ml-1和(2465.11±258.56)min·μg-1·ml-1。其中外推法估算的AUC(t-inf)占AUC(0-inf)的比值在血液为(8.86±0.03)%,胰腺为(9.52±0.04)%。血液与胰腺的药物分布系数为0.85±0.35。尾静脉推注盐酸左氧氟沙星后各时间点胰腺、血清中药物浓度对数图见图1,药物对血胰屏障通透率-时间曲线见图2。
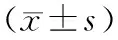
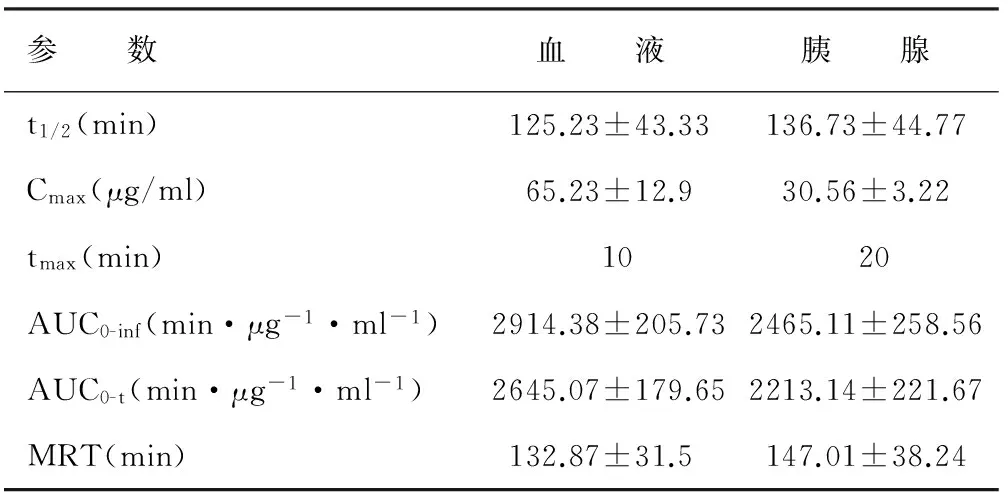
参 数血 液胰 腺t1/2(min)125.23±43.33136.73±44.77Cmax(μg/ml)65.23±12.930.56±3.22tmax(min) 1020AUC0-inf(min·μg-1·ml-1)2914.38±205.732465.11±258.56AUC0-t(min·μg-1·ml-1)2645.07±179.652213.14±221.67MRT(min)132.87±31.5147.01±38.24
注:Cmax和tmax分别为药物在组织中的峰浓度和到达峰浓度时间;AUC0-inf、AUC0-t分别表示曲线下总面积和截止至终末观察点时的曲线下面积;MRT为药物分子在体内的平均驻留时间
讨 论
以往使用的胰腺药代动力学研究方法,包括胰腺组织匀浆法、胰瘘管和内镜导管法均有较大缺陷,所获数据不能准确反映胰腺组织间液游离态药物代谢情况[10]。近来虽有一些非侵袭性手段,如PET(positron emission topography)和NMR(nuclear magnetic resonance)的出现并应用于胰腺药代动力学研究[11],但其科研成本极高,且依然无法对细胞内与组织间液进行精确定位。微透析是日渐兴起的一种新型生物采样技术,主要利用物质沿浓度梯度扩散和半透膜对小分子化合物具有通透性的原理,对细胞外液(ECF)的物质进行采样,可将胰腺和血浆中蛋白结合态药物截留于探针透析膜外,所测样品为游离态药物浓度,结合探针透析率,可计算出同一个体靶组织细胞外液密集时间点的对应药物浓度,具有良好的时间和空间分辨性,是进行药动学研究的良好工具。
血液微透析技术多采用经颈静脉向右心房插管法植入探针。本实验采用经左侧股静脉植入下腔静脉,回收率平均为58%,最高达65%,高于颈静脉探针植入法所获得的回收率[12],且回收率较稳定,个体间差异小。这是因为:(1)下腔静脉的血液流动快,可避免血流速度慢对探针回收产生的影响,更真实地反映血药浓度;(2)能够避免对重要脏器血供的干扰;(3)下腔静脉具备理想的直行长度,允许透析部较长的探针充分发挥透析功能,提高探针回收率。
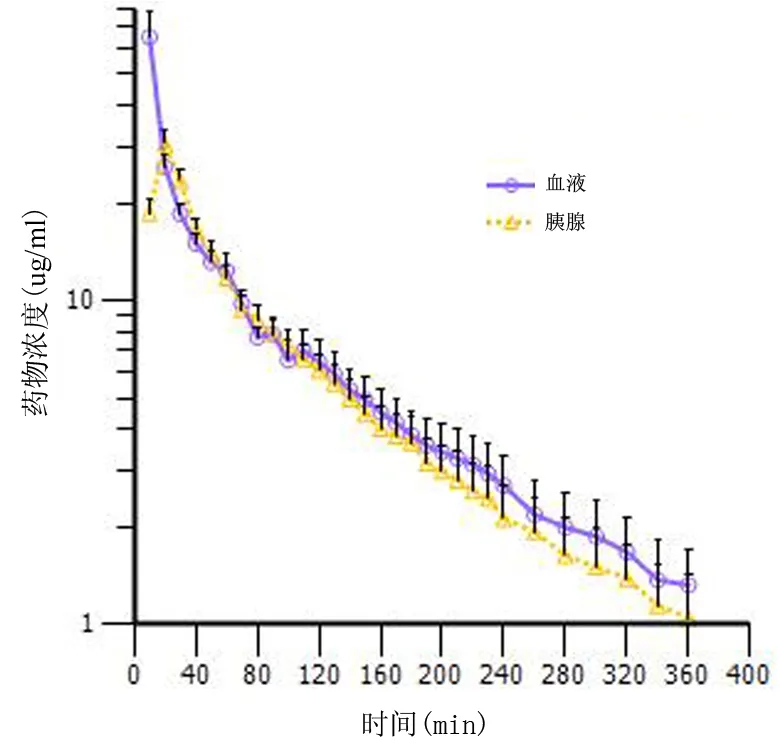
图1 10~360 min内各采样点的血液和胰腺浓度对数图
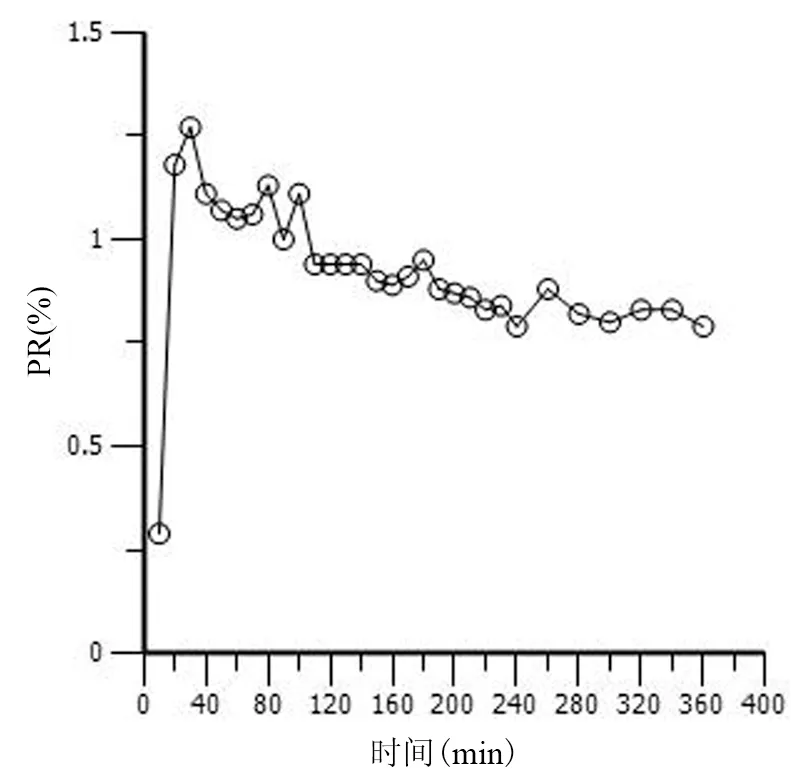
图2各采样点的盐酸左氧氟沙星对大鼠血胰屏障通透率(PR)
在胰腺微透析采样中,动物个体差异对探针回收率造成的影响并不显著。因为本实验所使用的探针为商品化CMA探针,探针物理性质稳定,胰腺微透析所选取的部位较为固定,均为胃底靠近脾脏部,探针植入点周围主干血管及毛细血管解剖分布基本相同,故微循环对药物的转运在不同个体间相似,所测探针回收率在个体间差异较小。
盐酸左氧氟沙星的AUC0-inf呈剂量依赖性[13],本实验大鼠所用药物剂量相当于人体给药400 mg/d,血液到胰腺的药物分布系数为0.85±0.35,表明盐酸左氧氟沙星具有较高的胰腺组织穿透力,这与血胰屏障多脂类成分的结构及左氧氟沙星脂溶性强的特点有关。分析药物在胰腺组织的分布过程,静脉给药后20 min,胰腺组织的药物浓度开始高于血清,并持续至100 min, PR=1.09±0.1,提示血胰屏障中可能存在药物转运体。胰腺的左氧氟沙星分布是由被动转运与主动转运共同调控,Ito等[14]曾在肾脏中发现左氧氟沙星的主动转运系。药物在胰腺组织的清除率及平均驻留时间与血液基本一致,表明两者代谢消除过程基本相似。从110 min至取样结束,胰腺药物浓度低于血清,PR=0.87±0.05,无明显差异,可能与药物的转运清除在两个方向达到饱和有关。本实验的PR数据均低于马珂等[15]的报道,而血浆中的药物半衰期无明显差异。我们认为,除大鼠个体差异影响,本文采用微透析技术所测对象为组织间液游离态药物浓度,不包括蛋白结合态药物及细胞内药物,因此可能低于组织匀浆法所获的数据。
对于胰腺抗感染治疗,病原学是抗菌药物选择的重要依据。不同病因引发胰腺感染的病原学特点并不相同,如非手术治疗中革兰阴性杆菌是胰腺感染的主要病原体,包括大肠杆菌、克雷伯菌属及厌氧菌等,而胆源性胰腺炎合并胆道梗阻的患者,铜绿假单胞菌、厌氧类杆菌、肠球菌等为主要致病菌。张菁等[16]报道,左氧氟沙星对溶血性链球菌、卡他莫拉菌具有高度抗菌活性,但甲氧西林耐药金葡菌(MRSA)、大肠埃希菌、鲍曼不动杆菌及大多数肠球菌对左氧氟沙星呈现耐药。一般认为氟喹诺酮类药物的Cmax/MIC达8~10时,可获得良好的临床和细菌学疗效,并可减少细菌对该类药物耐药性的产生,但治疗严重革兰阴性杆菌感染,AUC0-24 h/MIC90应为100~125。故在胰腺抗感染治疗中,虽然盐酸左氧氟沙星具有较高的胰腺组织穿透力,但并非对所有菌群都能产生良好的抗菌作用,提高给药剂量是增强疗效、减少细菌耐药的方法,但仍需分辨病因,依据病原学特点有针对性的选择抗感染药物。
[1] 梁锦芬,江秀丽,蔡萍,等.左氧氟沙星的临床应用及不良反应.中华临床医学研究杂志,2006,12:634-635.
[2] 叶华进,吴小彤.急性胰腺炎治疗中抗菌药物使用分析.医学研究杂志,2008,37:90-92.
[3] Büchler M,Malfertheiner P,Frieb H,et al. Human pancreatic tissue concentration of bactericidal antibiotics. Gastroenterology,1992,103:1902-1908.
[4] Bassi C,Pederzoli P,Vesentini S,et al. Behavior of antibiotics during human necrotizing pancreatitis.Antimicrob Agents Chemother,1994,38:830-836.
[5] Wittau M,Wagner E,Kaever V,et al.Intraabdominal tissue concentration of ertapenem.J Antimicrob Chemother,2006,57:312-316.
[6] Wacke R,Förster S,Adam U,et al.Penetration of moxifloxacin into the human pancreas following a single intravenous or oral dose.J Antimicrob Chemother,2006,58:994-999.
[7] Evrard PA,Deridder G,Verbeeck RK.Intravenous microdialysis in the mouse and the rat:development and pharmacokinetic application of a new probe.Pharm Res,1996,13:12-17.
[8] Wu JW,Tsai TH.Effect of silibinin on the pharmacokinetics of pyrazinamide and pyrazinoic acid in rats.Drug Metab Dispos,2007,35:1603-1610.
[9] Murillo O,Doménech A,Garcia A,et al.Efficacy of high dose of levofloxacin in experimental foreigh-body infection by methicillin-susceptible staphylococcus aureus.Antimicrob Agents Chemother,2006,50:4011-4017.
[10] 王刚,孙备,姜洪池.血胰屏障及其临床意义.中国实用外科杂志,2008,28:389-391.
[11] Fischman AJ,Babich JW,Bonab AA,et al.Pharmacokinetics of [18F] trovafloxacin in healthy human subjects studied with positron emission tomography.Antimicrob Agents Chemother,1998,42:2048-2054.
[12] Marchand S,Frasca D,Dahyot-Fizelier C,et al.Lung microdialysis study of levofloxacin in rats following intravenous infusion at steady state.Antimicrob Agents Chemother,2008,52:3074-3077.
[13] Destache CJ,Pakiz CB,Larsen C,et al.Cerebrospinal fluid penetration and pharmacokinetics of levofloxacin in an experimental rabbit meningitis model.J Antimicrob Chemother,2001,47:611-615.
[14] Ito T,Yano I,Masuda S,et al.Distribution characteristics of levofloxacin and grepafloxacin in rat kidney.Pharm Res,1999,16:534-539.
[15] 马珂,祁金文,俞佳,等.左旋氧氟沙星对大鼠血胰屏障的通透性,中国现代应用药学杂志,2002,19:237-239.
[16] 张菁,郁继诚,施耀国,等.左氧氟沙星药代动力学/药效学研究,中华医学杂志,2005,85:1926-1932.
2009-11-26)
(本文编辑:屠振兴)
Pharmacokineticsoflevofloxacininratpancreas
LIUDe-ding,XIAOHe-ping,WANGZhuo,ZHOUJia,SONGBin,YANGLin,LIURui,HUANGYi.
DepartmentofGeneralSurgery,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
HUANGYi,Email:huangliur@163.com,LIURui,Email:huangliur@163.com
ObjectiveTo investigate the pharmacokinetics of levofloxacin in rat′s pancreatic tissue.MethodsPancreatic tissue and blood were sampled in vivo by microdialysis simultaneously. The concentrations of levofloxacin in both blood and tissues were measured by high performance liquid chromatography. All date were analyzed by WinNonlin software.ResultsThe maximum concentration of free levofloxacin in blood and pancreatic tissue were (65.23±12.9) μg/ml at 10min and (30.56±3.22) μg/ml at 20 min, respectively, then both continuously decreased. Concentration of free levofloxacin in pancreatic tissue was higher than that in blood from 20min to 100min, then returned to similar level. The area under the concentration curve (AUC) of unbound levofloxacin was (2465.11±258.56) min·μg-1·ml-1in pancreas, and (2914.38±205.73) min·μg-1·ml-1in blood.ConclusionsMicrodialysis with reversed phase high performance liquid chromatography established in this essay could be used to determine the pharmacokinetics of levofloxacin objectively. High concentration of levofloxacin in pancreatic tissue and blood was observed.
Levofloxacin; Microdialysis; Pharmacokinetics; Pharmacodynamics; High performance liquid chromatography
10.3760/cma.j.issn.1674-1935.2010.02.007
国家科技重大专项《复发性结核病治疗的研究》(2008ZX10003-015)
200433 上海,第二军医大学附属长海医院普外科(刘德鼎、刘瑞、宋彬、杨琳),呼吸内科(黄怡),药学部(王卓、周佳);上海市肺科医院(肖和平)
黄怡,Email:huangliur@163.com;刘瑞,Email:huangliur@163.com
