伴高脂血症的急性胰腺炎大鼠肠屏障功能的改变
2010-11-23张富春吴婷黄胡萍孙娟
张富春 吴婷 黄胡萍 孙娟
伴高脂血症的急性胰腺炎大鼠肠屏障功能的改变
张富春 吴婷 黄胡萍 孙娟
近年来高脂血症与急性胰腺炎(AP)之间的关系越来越受到人们的关注。高脂血症已成为AP的一个较常见的病因,并能诱发和加重AP的病情进展,但具体机制尚未阐明。由于近年来肠道屏障功能障碍在AP病情进展中所起的作用得到揭示,故本实验试图从肠道屏障功能改变方面对高脂血症与AP之间的关系做一探讨。
一、材料和方法
1.实验动物及分组:清洁级SD大鼠50只,雌雄不分,体重200~220 g,购自福建医科大学实验动物中心。按数字表法随机分为4组,高脂血症并急性胰腺炎(HAP)组(15只)、AP组(15只)、高脂血症(HL)组(10只)和对照组(10只)。采用自制脂肪乳剂灌胃(1 ml·100 g-1·d-1,连续2周)的方法制备HL模型。脂肪乳剂配方参照刘明等[1]方法加以改进,配方中各种成分的比例为:20%猪油,10%胆固醇,20%吐温80,2%胆酸钠,1%丙基硫氧嘧啶。采用胰胆管逆行注射3.5%牛磺胆酸钠1 ml/kg体重方法制备AP模型。对照组仅行剖腹术,轻轻牵动十二指肠及胰腺。
2.血清淀粉酶、三酰甘油(TG)、胆固醇(CH)、D-乳酸、内毒素含量测定:制备模型后6 h采血,自动生化仪测定大鼠血清淀粉酶、TG及CH含量;改良分光光度法[2]测定血浆D-乳酸水平;EDS-99细菌内毒素测定系统测定血浆内毒素水平。
3.胰腺、回肠组织病理检查:取胰腺和回肠组织行常规病理组织学观察,参照Grewal等[3]的标准对胰腺损害进行评分。
4.回肠末段组织凋亡指数(apoptotic index,AI)及PCNA表达检测:采用TUNEL检测试剂盒(德国ROCHE公司)原位检测回肠黏膜上皮细胞凋亡情况。计数3个视野中每100个上皮细胞中凋亡细胞(棕黄色染色)数,取均值,为AI;采用常规免疫组化法检测回肠黏膜上皮细胞PCNA的表达,PCNA抗体购自北京中杉金桥生物技术有限公司,以PBS代替PCNA抗体作为阴性对照。细胞核呈棕色者为阳性细胞,计算阳性细胞占总细胞数的百分率。
二、结果
1.模型评估:AP组及HAP组血清淀粉酶值较对照组明显升高(P﹤0.01),HL组和HAP组血清TG、CH值较对照组均明显升高(P﹤0.01,表1)。AP组及HAP组胰腺病理评分较对照组明显升高,对照组及HL组胰腺组织未见改变,各组胰腺组织病理评分见表1。表明两种模型均制备成功。
2.血D-乳酸和内毒素水平变化:AP组血D-乳酸和内毒素水平较对照组均明显升高(P﹤0.01),HAP组血D-乳酸及内毒素水平又均较AP组显著升高(P﹤0.05,表1)。
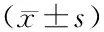
表1 各组血清淀粉酶、TG、CH、D-乳酸和内毒素水平变化及胰腺病理评分
注:与对照组比较,aP﹤0.05,bP﹤0.01;与AP组比较,cP﹤0.05
3.回肠组织病理改变及回肠上皮细胞AI、PCNA表达的变化:各组回肠组织学改变未见明显区别。对照组、AP组、HAP组的AI分别为5.200±1.121、15.348±1.446、25.915±1.939(图1); PCNA阳性细胞表达率分别为(79.3±7.0)%、(67.3±5.9)%、(53.8±7.5%)。AP组的AI较对照组显著增加,而PCNA表达较对照组显著减少(P值均<0.01);HAP组的AI较AP组进一步增加,PCNA表达较AP组进一步减少(P值均<0.05,图2)。

图1 AP组(a)和HAP组(b)小肠细胞凋亡情况(Tunel ×400)
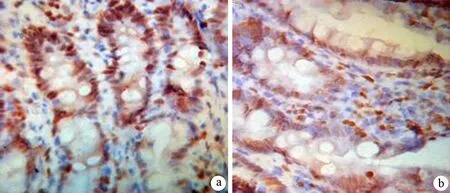
图2AP组(a)和HAP组(b)小肠细胞PCNA表达情况(免疫组化×400)
讨论高脂血症与AP之间孰因孰果目前仍存在争议。当前的多数研究认为高脂血症可导致或加重AP[4-5],极高的TG可以直接诱发AP。Berger等[6]报道,血清TG水平浓度超过11.3 mmol/L就能引起胰腺炎。高脂血症引起或加重胰腺炎的具体机制为:(1)HL使血液黏稠度增高,微血栓形成,造成胰腺微循环障碍;(2)血清脂质颗粒聚集栓塞胰腺血管,或胰腺内黄色瘤形成;(3)HL激活血小板,释放大量具有强烈缩血管作用的血栓素A2,同时损伤胰腺血管内皮细胞,前列腺环素分泌减少,导致两者失衡,加重胰腺微循环障碍;(4)胰脂酶水解TG产生大量的游离脂肪酸,产生组织毒性。本结果显示,HAP组大鼠胰腺病变,尤其是胰腺坏死程度较AP组明显加重,证实HL可加重AP病情的进展。
近年来肠屏障功能障碍在重症急性胰腺炎(SAP)的发病机制中受到很大关注,SAP时肠屏障功能障碍是加重SAP病情进展的一个重要因素[7-8]。D-乳酸是细菌发酵的代谢产物,可由肠道多种细菌产生。因哺乳动物不具备将其分解的酶系统,肠道细菌产生的大量D-乳酸通过受损肠黏膜进入血,引起外周血中D-乳酸的水平升高,故血中D-乳酸水平可反映肠通透性的变化[9]。内毒素是革兰阴性菌细胞壁的成分,正常情况下只有少量内毒素进入循环并在肝脏内被灭活,外周循环中检测不到。在各种原因引起肠道屏障功能减弱时,大量的内毒素即可通过各种途径进入到循环中,形成内毒素血症[10]。本实验结果显示, HAP组的血D-乳酸和内毒素的水平均较AP组明显升高,说明HAP大鼠的肠黏膜通透性较AP组增加。实验结果还显示, HAP组大鼠回肠黏膜上皮细胞的AI较AP组显著增加,而PCNA的表达则明显减少,提示肠黏膜上皮细胞过度凋亡与增殖减弱可能是导致HAP大鼠肠道屏障功能障碍加剧、通透性进一步增加的一个重要机制之一。
[1] 刘明,董超仁,苏静怡.一种简便实用的大鼠高脂血症模型.中国药理学通报,1989,5:119-120.
[2] Brandt RB,Siegel SA,Waters MG,et al.Spectrophotometric assay for D-(-)-lactate in plasma.Anal Biochem, 1980,102:39-46.
[3] Grewal HP,Mohey el Din A,Gaber L,et al.Amelioration of the phy-siologic and biochemical changes of acute pancreatitis using an anti-TNF-alpha polyclonal antibody.Am J Surg,1994,167:214-219.
[4] Tsuang W, Navaneethan U, Ruiz L,et al. Hypertriglyceridemic pancreatitis: presentation and management.Am J Gastroenterol,2009,104:984-991.
[5] Fortson MR,Freedman SN,Webster PD 3rd. Clinical assessment of hyperlipidemic pancreatitis.Am J Gastroenterol,1995,90:2134-2139.
[6] Berger Z,Quera R,Poniachik J,et al.Heparin and insulin treatment of acute pancreatitis caused by hypertriglyceridemia.Experiences of 5 cases.Rev Med Chil,2001,129:1373-1378.
[7] Marotta F,Geng TC,Wu CC,et al.Bacterial translocation in the course of acute pancreatitis:beneficial role of nonabsorbable antibiotics and lactitol enemas.Digestion,1996,57:446-452.
[8] Miniello S,Testini M,Amoruso M.Acute pancreatic necrosis complicated by infection and gastro-intestinal translocation:pathogenesis correlation and therapeutic implication.Ann Ital Chir,2002,73:611-617.
[9] 陈秀凯,邱方,程爱国.肠道屏障功能监测方法的现状及其进展. 中国煤炭工业医学杂志,2002,5:413-415.
[10] 邓群,黎沾良,陆连荣,等.急性坏死性胰腺炎肠粘膜屏障改变与肠源性细菌移位及内毒素血症的关系. 中华实验外科杂志,2000,17:471.
2009-08-17)
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2010.04.023
350003 福州,福建省老年医院消化内科(张富春);福建医科大学附属第一医院消化内科(吴婷);福建省立医院消化内科(黄胡萍);福州市第一医院消化内科(孙娟)
吴婷,Email:DrWT@medmail.com.cn
