美国FDA医疗器械和放射健康中心(CDRH)医疗器械监管模式概述
2010-11-16编译
沈 翀 编译
(本刊编辑部,北京 100022)
美国FDA医疗器械和放射健康中心(CDRH)医疗器械监管模式概述
沈 翀 编译
(本刊编辑部,北京 100022)
编者按:确保医疗器械的安全性和有效性是监督管理部门应履行的职责。近年,医疗器械临床研究数量呈现出逐年增长的势头,中国越来越重视医疗器械的临床研究,医疗器械监管部门对医疗器械临床试验的监管更加严格,出台多个规范性文件以保护受试者权益,同时保证临床资料的科学性。本文编译了美国食品药品监督管理局(FDA)器械和放射健康中心(CDRH)对医疗器械监管的主要内容,重点介绍了上市前审批、上市后监测的要点,以及CDRH 2010年的战略重点,希望能为加强我国医疗器械监管,建立规范化、系统化的监管模式提供借鉴。
医疗器械法规的目标是通过关注医疗器械的安全性和有效性来促进和保护公众健康。医疗器械在设计和功能方面具有多样性,因此需要依据其复杂性和风险特征采取不同的监管方法。以FDA医疗器械风险管理的过程模式为指南,CDRH通过上市前审批计划,确保新的、高风险的、复杂的医疗器械安全有效;通过上市后监测计划、科学研究、法律约束和教育计划等,最大限度地确保上市后医疗器械的安全有效。正是由于CDRH这些计划的相互作用,使医疗器械从设计、上市使用,到更新换代,组成了一个维护公众健康安全的统一体。
1 上市前审批
1976年FDA颁布的《医疗器械修正案》将医疗器械分为三类,其分类标准是基于医疗器械的复杂性和风险特征,其中以Ⅲ类产品最为复杂,风险性最高。FDA对Ⅰ类产品(占47%左右)实行的是一般控制,绝大部分产品只需进行注册、列名和实施GMP规范,即可进入美国市场(其中极少数产品连GMP也豁免,极少数保留产品则需向FDA递交510(k)申请,即上市前通知(Premarket Notification,PMN));对Ⅱ类产品(占46%左右)实行的是特殊控制,企业在进行注册和列名后,还需实施GMP并递交510(k)申请(极少数产可豁免510(k));对Ⅲ类产品(占7%左右),实施的是上市前许可(Pre-market Approval,PMA),企业在进行注册和列名后,须实施GMP并向FDA递交PMA申请。
1.1 上市前通知(PMN)
510(k)文件即FDA对PMN所需的文件,因其对应在《食品、药品和化妆品法》第510章节,故通常称510(k)文件。FDA规定医疗器械生产企业在产品上市前90天内必须提交510(k)文件,它要求企业呈报的信息能够说明准备上市的医疗器械与已合法上市的其它产品在安全性和有效性上是否实质等同(Substantially Equivalent, SE)。对 510(k)文件所必须包含的信息,FDA有具体的内容要求,传统510(k)文件包括申请函、资料清单、真实性保证声明、产品描述、注册号码、产品安全性及有效性证明、器械依据的标准和制造资料等。10%~15%的产品还需提供临床数据,这取决于受试器械与合法上市器械之间的差异,以及通过实验室试验和动物试验解答问题的能力。图1为FDA于1998年发布的510(k)审批流程图。
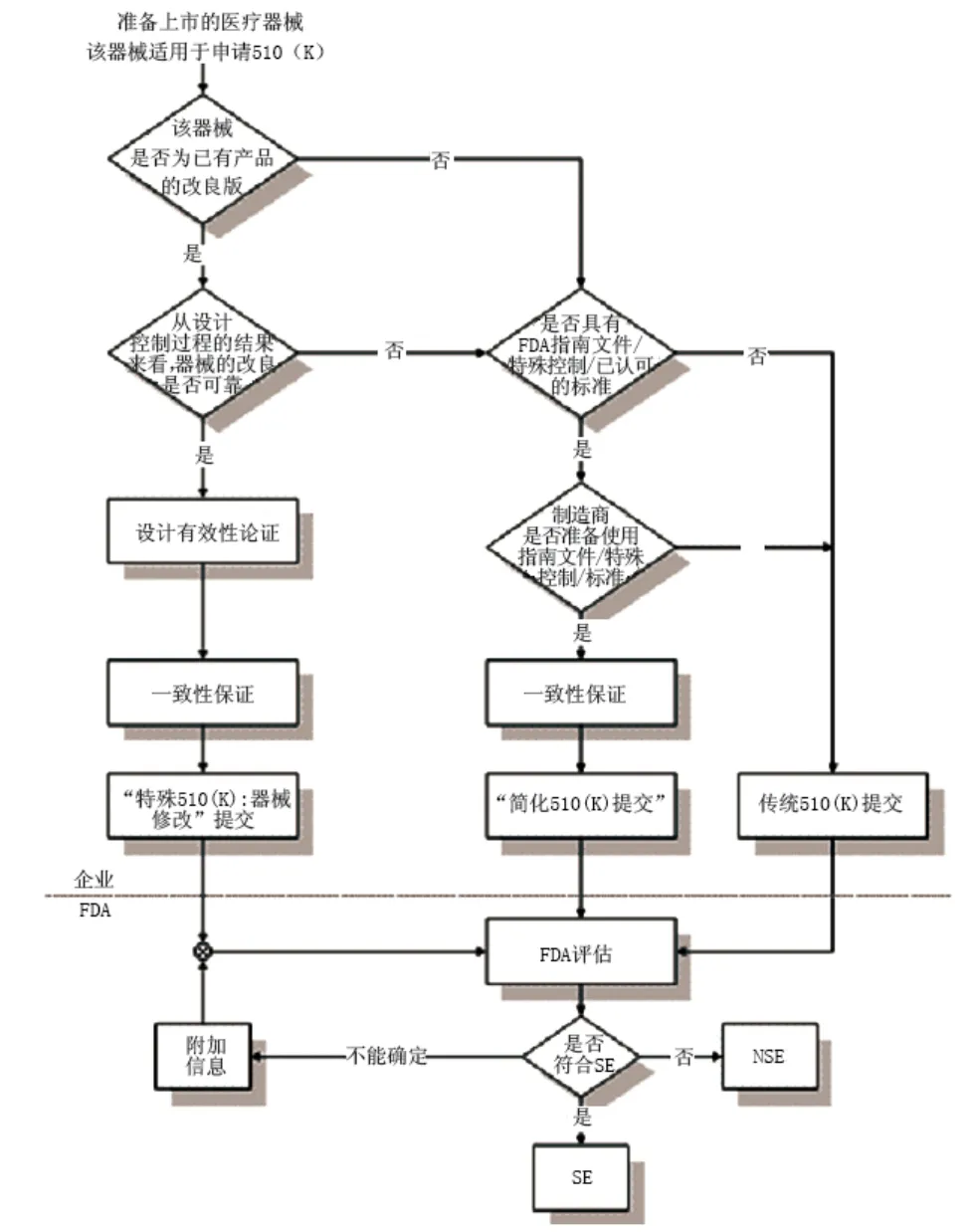
图1 510(k)审批流程图
FDA为企业申请510(k)提供了两种主要途径:“特殊510(k):器械修改”和“简化510(k)”,“特殊510(k):器械修改”以质量体系中的设计控制部分为基础;“简化510(k)”以指南文件、特殊控制和已认可的标准为基础。在没有指南文件、特殊控制和已认可的标准的情况下,企业只能提交传统510(k)。简化510(k)申请文件主要资料包含产品描述、产品适用范围、标贴、如何降低风险的说明及支持数据、产品执行标准及一致性声明、产品附件等。除此之外,以指南文件或特殊控制为基础的简化510(k)申请文件还应当着重说明与指南文件或特殊控制有偏离的地方;以已认可标准为基础的简化510(k)申请文件还应提交与已认可标准一致性的声明,着重指出与已认可标准有偏离的地方。
1.2 上市前许可(PMA)
《食品、药品和化妆品法》第515条规定,所有Ⅲ类医疗器械均需得到上市前认证许可,否则不允许进入市场。FDA对PMA的批准程序至少为180天。而法令修订前的产品、法令修订后的产品以及过渡期的Ⅲ类产品PMA审批程序也有所区别。
法令修订前产品是指1976年5月28日《医疗器械修正案》颁布前就已上市的产品。该类器械直至最终分类标准颁布30个月后,或要求提交PMA申请的最终法规颁布90天之后,才需要提交PMA申请。
法令修订后产品是指1976年5月28日《医疗器械修正案》颁布后第一次上市的产品。若该类产品与法令修改前的医疗器械实质相同,该产品适合申请510(k)。在检查完510(k)申请报告后,FDA可以决定该产品是否与法令修订前的医疗器械实质相同。
过渡期Ⅲ类医疗器械是指1976年5月28日前按药品管理的医疗器械。如:隐形眼睛及其护理产品、医用辅料等。
经FDA判断与法令修改前的医疗器械或法令修改后、分类为Ⅰ类或Ⅱ类的医疗器械不实质等同的产品被认为是 “新”的医疗器械,自动进入Ⅲ类管理。在这类医疗器械上市之前,它们可以申请PMA也可以通过重新分类程序降为Ⅰ类或Ⅱ类管理。
2 上市后监测

图2 CDRH上市后安全监测流程
CDRH上市后的安全监测流程见图2。CDRH的上市后安全性监测通过上市后安全性问题的识别、评估和反馈进行运作。
2.1 上市后安全性问题的识别
上市后安全性问题识别主要是用于识别非预期的公众健康问题,提高上市后医疗器械潜在风险信息的数量和质量。安全性问题识别不仅包括基本的监测信息(不良事件报告和补充信息),还包括了企业核查和召回工作中产生的数据和信息。
2.2 上市后安全性问题的评估
上市后安全性问题的评估分为五类,包括内部数据分析、补充数据分析、实验研究、问题评估、上市后监测研究。主要用以评价潜在风险因素和与器械使用有关的不良事件,包括数据收集与分析、确认医疗器械故障的原因、评价使用方面的问题、评估标签信息是否完善等。
2.3 上市后安全性问题的反馈
CDRH上市后安全性问题反馈用于上市后风险管理和交流,分为两个关键性步骤——风险交流和强制性措施。风险交流是通过与公众和器械使用者互动交流来解决问题,目的是使公众了解可能的健康危害、需关注的安全性问题,以及为使用者提供关于器械的培训和使用建议。
2.4 CDRH上市后监测的主要目标
(1) 收集广泛的、精确的、及时的统计学和流行病学的监测数据,衡量上市医疗器械的安全性和有效性,对潜在风险信号进行警示;
(2) 通过医疗器械有关机构与公众和企业建立伙伴关系和联盟,确保交流的持续性和信息的对称性;
(3) 通过医疗器械生产者协会维持强制性核查与评估,完善质量标准,在公众健康受到影响之前发现和说明问题;
(4) 以及时有效的方式,用通俗易懂的语言与听众交流每一条医疗器械风险信息;
(5) 把上市后的监测结果与上市前的器械审评相结合;(6) 发现和交流企业在法规实践中的优秀范例;
(7) 建立和维护支持法规和公众健康责任的信息与知识系统;
(8) 不断开发人力资源,培养器械安全性问题的技能和知识。
3 CDRH 2010年战略重点
3.1 全面落实产品全生命周期监管措施
监管部门对医疗器械的监管责任跨越了产品的全生命周期,从早期的产品开发、生产,直至进入市场流通。产品生命周期的任何阶段,均需对其制定正确的监管措施,考虑一切有价值的信息。为了全面落实医疗器械全生命周期监管,CDRH将会采取如下措施:① 加强和整合上市前的审评及上市后的监管,加强各部门的职能意识,以应对现有的和预期的挑战。具体而言,CDRH将加强上市前审查,优化科技资源的使用,从而提高科学决策的质量和一贯性;加强收集、分析以及共享有价值的信息;制定措施以更好地整合和利用组织架构;建立机制,将最新的科学信息纳入我们的决策制定中,从而应对与全球化相关的挑战。② 改善对发展策略的指导和调控,及时、准确地向境外机构传达目前的预期和要求。
3.2 加强沟通和监管透明度
加强与各国监管部门的沟通,提高监管透明度,使公众健康最大程度受益。提高公众及有关机构对CDRH的信任度,使其更好地与CDRH合作。为此,CDRH将采取如下措施:① 制定与公众沟通的战略措施,向境外企业提供及时、有价值的信息,并使其有机会参与与FDA的对话。② 加强内部沟通,鼓励思想交流。③ 提高决策制定的透明度,使得公众了解CDRH的工作,并了解决策制定的原因。
3.3 提高员工技能,创造高效的工作环境
技能优异的员工以及高效的工作环境能够提高CDRH应对挑战的能力,以及保护、提升公众健康水平的效率。为了提高员工技能,创造高效的工作环境,CDRH将采取如下措施:① 招募和培养有能力的员工。② 提高员工专业技能以及专业知识的深度和广度。③ 建立解决分歧的途径,支持CDRH内部合作,公平地考虑境内外企业提出的问题。④ 改善内部行政程序,提高工作效率。⑤ 使CDRH白橡园区的工作环境更加舒适友好,从而保证各项工作的质量及效率。
3.4 积极促进改革,解决公众医疗需求
为了促进改革和解决公众未得到满足的医疗需求,CDRH将采取如下措施:① 与联邦政府及境外企业合作,降低贸易壁垒,促进医疗器械开发。② 制定个性化的医疗计划,加强对诊断器械及治疗方法的监管能力。
