桔青霉发酵制备核酸酶P1研究进展
2010-11-14张亚雄朱昌雄李知洪
喻 晨,赵 劼,张亚雄,朱昌雄,姚 鹃,李知洪
(1.三峡大学生物工程重点实验室,湖北宜昌443002;2.安琪酵母股份有限公司,湖北宜昌443003)
桔青霉发酵制备核酸酶P1研究进展
喻 晨1,赵 劼2,张亚雄1,朱昌雄2,姚 鹃2,李知洪2
(1.三峡大学生物工程重点实验室,湖北宜昌443002;2.安琪酵母股份有限公司,湖北宜昌443003)
核酸酶P1是一种重要的工业酶制剂,可用于水解核酸生产5’-核苷酸。本文综述了利用桔青霉发酵得到核酸酶P1的菌种选育、培养基优化、发酵工艺控制、浓缩、相关应用和国内外市场状况。
核酸酶P1,桔青霉,发酵法
核酸酶P1(Nuclease P1),又名5′-磷酸二酯酶,其作用为水解核酸中的3′,5′-磷酸二酯键得到四种5′-核苷酸。核苷酸是生物体内重要的低分子化合物,具有许多生理功能,目前,随着在婴幼儿奶粉及保健品领域的广泛应用,核苷酸市场变得越来越大。核酸酶P1在核苷酸工业化生产中起着至关重要的作用。从目前的研究和工业化现状来看,核酸酶P1主要通过桔青霉(Penicillium citrinum)发酵和麦芽根提取[1]两种途径生产,但由于麦芽根中可能含有的N-甲基大麦芽碱、亚硝胺、展青霉毒素、米曲霉毒素和荨麻青霉菌毒素等物质对人体有害,同时麦芽根提取酶活水平较低,原酶液酶活为300U/mL[2],而且受麦芽根本身品质影响较大,目前,麦芽根提取核酸酶P1技术在工业化生产中没有任何优势;桔青霉发酵生产核酸酶越来越受到酶制剂工业的重视,此外,研究表明桔青霉产生的核酸酶P1在酵母抽提物生产中参与酵母产品风味的提高,对操作工人和消费者是安全的[3]。目前,有关桔青霉发酵产核酸酶P1的研究主要集中在以下几个方面。
1 核酸酶P1性质研究
核酸酶P1的分子量约为24000,由331个氨基酸多肽单链构成,含有2个二硫键,并含有3个锌原子,酶分子含17.4%的碳水化合物(图1)。

图1 核酸酶P1结构[4]
核酸酶P1的温度适用范围比较广,是一种热稳定酶,在45~95℃均有催化活性。其最适酶反应温度为70℃[5]。最适pH因底物而异,一般在pH5~8都有较强的活性。核酸酶P1的最适pH还与溶液中的离子种类和离子强度有关。对于酵母核酸而言,此酶的最合适pH为5.0左右。郭春香[5]等人研究了金属离子对核酸酶P1催化活性的影响,其结果表明Ti3+、Ce3+在浓度大于 10-3mol/L时,Mn2+、Fe2+、Co2+、Cu2+和Pd2+在浓度10-3~10-5mol/L的范围时均表现出明显抑制作用。Mg2+和Ca2+对酶活略有促进的效果[6](见图2)。
Zn2+在10-2~10-6mol/L的浓度范围对该酶的酶活有激活作用,这与核酸酶P1的结构(见图1)有关,研究表明,核酸酶P1分子结构中含有3个锌原子,各个锌原子作用如下[7]:锌I主要参与维持酶的三级结构从而确保酶与大分子底物如RNA的结合。锌II用于活性构象的维护。通过圆二色谱在远紫外区检测发现,锌I和锌II并不参与维护二级结构,锌III主要起维持完整二级结构的决定性作用。
核酸酶P1在部分有机溶剂中,如甲基酰氨、二甲亚砜存在时仍有较高的酶活,在低浓度的变性剂环境中酶活有一定提高。B.N.Gangadhara[8]等人研究核酸酶 P1在低浓度的尿素(1mol/L)和盐酸胍(0.5mol/L)条件下酶的活性可以提高3~4倍(见图3)。
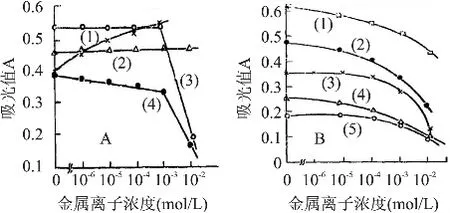
图2 不同金属离子对核酸酶活性的影响[5]
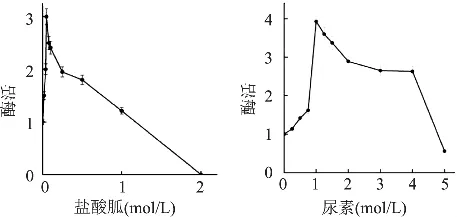
图3 有机溶剂浓度对核酸酶P1活性的影响[7]
2 核酸酶P1的发酵研究
目前利用桔青霉发酵法生产核酸酶P1的研究主要集中在高产菌株选育、发酵工艺优化和酶的分离纯化浓缩工艺等三个领域。
2.1 菌种选育研究
桔青霉菌种诱变主要采用物理和化学方法,通过物理和化学手段对生物体DNA产生影响,使其发生变异,得到高产突变菌株。洪亦武[9]等人分别对桔青霉菌种(AS3.2788和AS3.2833)采用紫外线、硫酸二乙酯、亚硝基胍作为诱变剂诱变,发现亚硝基胍和紫外线作诱变剂效果较好,二者复合诱变效果更佳,采用0.5mg/mL的亚硝基胍处理60min,再经紫外线处理60s,对出发菌株的致死率达到90%,筛选得到了3株高产菌株,酶活达到345U/mL。李科德等人[10]以桔青霉菌株(ATCC14994)为出发菌株,也采用紫外线与亚硝基胍相结合的方法多次诱变育种,获得1株高产菌株,酶活达到1329U/mL。
此外,一些新的诱变方式也有报道,苏龙[11]等人对桔青霉进行微波诱变得到1株核酸酶高产菌株,采用脉冲频率为2450MHz,功率800W的微波炉,分别对相同浓度和体积的单孢子悬液进行辐射处理,使诱变菌株产酶水平由 667.50U/mL提高到1228.20U/mL,提高了84%。
离子束注入技术是20世纪80年代初材料学中兴起的一项高新技术,近几年逐渐引入到微生物育种[12]。吴永宏[13]采用氮离子束注入对桔青霉 M02进行诱变,确定最佳注入能量为20keV,最佳注入剂量20×1014N+·cm-2,筛选出5株正突变株,发酵酶活比出发菌种提高了61%。南京工业大学应汉杰等人也通过离子束注入对桔青霉菌种进行诱变研究,控制离子注入室的真空度2×10-2~2×10-8,注入能量为0.1~1000keV,剂量为5×1013~500×1013ions· cm-2·s-1,低能离子为N+、Ar+、O6+或C6+,最终获得了高产核酸酶P1的桔青霉菌株(CGMCC No.2014),采用三级放大发酵培养,发酵终点酶活达到5800U/mL[14],这也是目前已有报道中见到的最高产酶菌株。
2.2 发酵工艺研究
从已有文献来看,目前利用桔青霉发酵生产核酸酶P1的方式主要有液体深层发酵,固态发酵和固定化细胞培养的方法。
2.2.1 固态发酵法 微生物在具有一定温度和湿度的固体培养基的表面生长、繁殖、代谢的发酵过程称作为固态发酵。以麸皮为培养基培养桔青霉,操作简单,成本低,能得到较高酶活的粗酶液。苏庆辉[1]利用麸皮固态发酵法生产核酸酶P1,酶活可以达到500U/mL。但是,由于发酵周期长,占用空间大,且发酵过程中孢子污染环境,同时由于麸皮成分非常复杂,要想获得纯的核酸酶P1较为困难和繁琐。因而,该生产工艺基本没有被生产厂家采用。
2.2.2 液体深层发酵法 液体深层发酵主要研究培养基优化和发酵工艺控制策略。李科德[2]等人对高产核酸酶P1的桔青霉进行了培养基中碳源、氮源、磷源成分筛选,确定了以蔗糖为碳源、酵母膏和蛋白胨为复合氮源、KH2PO4和K2HPO4为复合磷源的培养基。并通过正交实验得出对酶活的影响顺序为蔗糖>酵母膏+蛋白胨>MgSO4+ZnSO4>KH2PO4+ K2HPO4。徐正军[15]采用中心组合设计对碳源、氮源、磷源进行优化以最大限度地提高核酸酶P1的发酵水平,结果表明,最优的碳、氮源组成为葡萄糖3.87%、蛋白胨0.191%、玉米浆0.184%,此时的核酸酶P1的产酶水平最高,模型预测值可以达到661.1U/mL,验证实验酶活达到648.3U/mL,比优化前提高了70%。此外,金属离子对桔青霉菌体产酶也有显著影响,其中,Zn2+对酶活影响较大[16],研究表明0.04%锌离子浓度对于核酸酶P1的生成和激活有重要作用。娄永江等人[17]对发酵培养基中的金属离子种类进行了研究,得出低浓度的Zn2+能使酶活提高20%左右,Fe2+、Sn2+也能小幅提高酶活,在高浓度的 Fe3+、Mn2+、Pb2+下酶活被抑制,Ca2+、Mg2+、 Na+、K+、对菌体产酶影响不大。
梁剑光[18-19]等对桔青霉发酵的工艺条件进行了相关研究,结果表明,种龄24h,接种量10%,初始pH6.5条件下,较高的发酵温度下产酶最高点明显提前,而在较低温度下,发酵周期延长,但有利于菌体产酶。王端好等人[20]研究了溶氧对桔青霉发酵产核酸酶的影响,发现摇瓶装液量为20%时,摇床转速为180r/min,产酶最好,表明菌体产酶需要较高的溶氧。徐正军[21]等人利用30L气升式发酵罐研究了桔青霉产酶的发酵动力学,结果表明,核酸酶P1是不完全伴随菌体生物量生长的产出产物,属于部分耦联,其发酵过程属于部分耦联型发酵(图4)。

图4 桔青霉发酵过程中产酶与生物量的关系[21]
此外,梁剑光等在研究中也发现,核酸酶P1的产酶量和菌体的生长关系不大,但是却与菌体的生长速率有着一定的相关性,当菌体处于快速生长期时,其产酶也相应进入快速期[19]。
2.2.3 固定化菌体培养 固定化微生物技术是指用物理或化学方法将游离微生物细胞、动植物细胞、细胞器或酶限制或定位在某一特定空间范围内,保留其固有的催化活性,并能被重复和连续使用的技术[22]。其优点在于培养生物密度高、反应迅速、生物流失量少、反应控制容易[23]。固定化细胞技术的关键是所用载体材料的性能[24]。夏黎明[25]利用吸附固定在多孔聚酯载体上的桔青霉菌丝生产核酸酶,酶活可高达513.3U/mL,其产酶效率是游离菌丝的3.6倍,而葡萄糖和蛋白陈的用量仅为游离菌丝产酶的1/5,连续生产28批(56d),产酶水平没有下降,平均酶活达到507U/mL。烟台大学王克明[26]等人通过使用双载体固定化桔青霉产核酸酶,先使用玉米芯颗粒吸附桔青霉孢子,再用质量分数为1.5%的海藻酸钠包埋吸附固定化细胞玉米芯颗粒,培养50h后,发酵液中核酸P1的活力高达503U/mL。河南工业大学宋威[27]等人采用复合载体固定化细胞的方法,研究不同的材料和材料间不同配比对酶活力的影响,最终得出聚乙烯醇与海藻酸钠比例为2∶1的复合载体固定桔青霉的孢子,连续发酵20个周期后,生产的核酸酶P1酶活力损失不大,始终保持在468.3~501.4U/mL。
复合载体作为一种新的固定化载体,突显出机械强度大,使用寿命长等优点。同时固定化细胞培养方式解决了液体深层发酵成本高的问题,重复利用率高,具有很好的工业应用价值。
2.3 酶的分离纯化与浓缩工艺研究
吕浩[28]等人将桔青霉发酵液通过硫酸铵分级沉淀、凝胶层析和离子交换纤维素层析等生化分离步骤,核酸酶 P1的比活力为711U/mg,纯化倍数为1500。廖红东[29]对桔青霉发酵液经离心、超滤、硫酸铵盐析、透析和DE-52型树脂柱色谱分离,纯化得到核酸酶P1,比酶活为28490U/mg,纯化10.5倍。张一平[30]等采用超滤和盐析技术,对麦芽根浸提液中核酸酶P1进行纯化,酶活比初始提高了15倍,达到1500U/mL,其研究创新地将超滤和盐析技术相结合,对桔青霉发酵中核酸酶P1的纯化浓缩有指导意义。
3 核酸酶应用研究
目前,核酸酶P1主要是用于酵母核酸水解,一般最适反应温度在70℃左右,pH6.5,水解时间4~5h。邓义熹[2]等人研究得出,在3%底物浓度下,加入5%的用酶量,反应2h时补加核酸底物,可以提高酶的利用率,酶解率维持在85%以上。而酶解反应中随着产物的增加,酶促反应速率也相应地受到影响。杨大令[31]等人在制备5′-核苷酸设备研究中采用了新型的分体式中空纤维酶膜反应器。其优点在于反应中形成产物可透过膜分离出来,酶则继续参与反应循环往复,从而提高酶解率,通过优化,当核酸底物浓度为2%时,核酸酶P1浓度为100mg/L,pH为5.2,温度为65℃,过膜压力为0.1MPa,反应5h酶解率可达85%。
此外还可以通过固定化酶技术来提高酶水解率,邵卫祥[32]等人采用磁性纳米颗粒与酶蛋白共沉淀后经戊二醛交联的方法,制备了磁性交联核酸酶P1聚集体,结果表明:磁性交联核酸酶P1聚集体在热稳定性,耐酸碱性均优于游离酶,重复操作性稳定,游离酶和磁性交联核酸酶P1聚集体的Km值分别为7.27、30.7mmol/L,最适反应温度分别为75、90℃,最适 pH均为 5.2,连续使用 6次酶解率仍有70%。
4 展望
随着我国核酸工业化的不断推进,核酸酶P1在核苷酸工业生产中起到的重要作用,使核酸酶P1的需求量也越来越大。而我国国内核酸酶P1生产厂家不多,造成核酸酶P1供应紧缺,目前市场来源主要依靠国外进口。由此可见,该酶市场前景巨大。我国核酸酶P1的开发和生产以及相关应用研究还须进一步加深。
[1]苏庆辉,马兴胜,袁艳玲,等.5′-磷酸二酯酶的提取[J].酿酒,2004,31(1):88-90.
[2]邓义熹,赵劼,张亚雄,等.麦芽根提取5′-磷酸二酯酶对RNA酶解工艺研究[J].食品工业科技,2010(1):207-209.
[3]Mitsuru Kondo,Susumu Nishimura,Noriho Tanaka,et al. Safety Evaluation of Phosphodiesterase Produced from Penicillium citrinum Summary of Toxicological Data[J].Regulatory Toxicology and Pharmacology,2001,33:2-11.
[4]A Volbeda,A Lahm,F Sakiyama,et al.Crystal structure of Penicillium citrinum P1 nuclease at 2.8 A resolution[J].The EMBO Journal,1991,10(7):1607-1618.
[5]郭春香,邵昌平,郭和夫.金属离子对核酸酶P1催化水解RNA反应的影响及其机理探讨[J].催化学报,1992,13(4):316-319.
[6]Guo-Qing Ying,Shi Lu-E,Yiyu,et al.Production,purification and characterization of nuclease P1 from Penicillium citrinum[J].Process Biochemistry,2006,41:1276-1281.
[7]Kyuji Rokuguawa,Masao Fujimoto,Akira Kuninaka,et al. The Role of Zinc in NucleaseP1[J].Agric Biol Chem,1980,44:1987-1988.
[8] Gangadhara B N,KumarParigiRamesh,Prakash Vishweshwaraiah.Enhancement of nuclease P1 activity in low concentration ofdenaturants[J].Enzyme and Microbial Technology,2008,43:336-342.
[9]洪亦武,曹郁生,黄燕方,等.核酸酶P1产生菌的诱变选育[J].江西科学,1995,13(4):224-228.
[10]李科德,韩木兰,柏建玲,等.5′-磷酸二酯酶高产菌株的选育和发酵培养条件的优化[J].微生物学杂志,2001,21(3):28-30.
[11]苏龙,陈显玲.微波诱变选育核酸酶P1高产菌株[J].中国酿造,2008(5):62-63.
[12]陈义光,李铭刚,徐丽华,等.新型物理诱变方法及其在微生物诱变育种中的应用进展[J].长江大学学报:自科版,2005(5):46-68.
[13]吴永宏.酶法水解DNA制备5′-脱氧核甘酸的研究[D].南京工业大学,2005.
[14]应汉杰,杨蕴毅,贺沁婷,等.一株高产核酸酶P1的桔青霉菌及其选育方法[P].200710022932,2007-11-07.
[15]徐正军,肖林平,吕浩,等.实验设计法优化核酸酶P1的发酵培养基[J].过程工程学报,2003,3(5):433-437.
[16]陈珊珊,曹剑红.Zn2+对5′-磷酸二酯酶活性的影响[J].福建医药杂志,1994,16(3):49.
[17]娄永江,吴汉民,王海洪.从桔青霉M71生产核酸酶P1及酶活提高途径的研究[J].宁波大学学报,1997,20(3):21-27.
[18]梁剑光,黄鹏,徐正军.桔青霉发酵法生产核酸酶P1工艺条件及影响因素研究[J].中国酿造,2007(11):27-30.
[19]梁剑光,黄鹏,徐正军.呈味酶制剂-核酸酶P1发酵生产工艺初试[J].中国调味品,2007(6):70-73.
[20]王端好,周河治,张小里.桔青霉生产核酸酶的发酵条件研究[J].生物加工过程,2008,6(2):33-37.
[21]徐正军,吕浩,何明芳,等.气升式发酵罐生产核酸酶P1发酵过程的动力学[J].南京工业大学学报,2004,26(2):28-32.
[22]夏冰,赵全升,曲洋.固定化微生物技术及其载体在污水处理中的研究进展[J].科技信息,2010(1).
[23]王芳,李进,鲁敏.固定化微生物技术的发展及其在印染废水处理中的应用[J].纺织科技进展,2010(1):28-30.
[24]陈娜丽,冯辉霞,王冰,等.固定化细胞载体材料的研究进展[J].化学与生物工程,2009(10):13-17.
[25]夏黎明.固定化桔青霉产生核酸酶P1的研究[J].微生物学报,1998,28(6):449-453.
[26]王克明.双载体固定化桔青霉产生核酸酶P1的研究[J].中国粮油学报,1999,14(5):44-46.
[27]宋威,张芹,李欢庆,等.复合载体固定化细胞发酵生产核酸酶P1的对比研究[J].河南工业大学学报,2008,29(3):51-54.
[28]吕浩,应汉杰.核酸酶P1的纯化和酶学性质研究[J].南京工业大学,2002,24(6):66-69.
[29]廖红东,莫晓燕,宋威.核酸酶P1的分离纯化及部分酶学性质研究[J].中国医药工业杂志,2005,36(9):536-538.
[30]张一平,华洵璐,李靖,等.高活力5′-磷酸二酯酶制备及水解RNA的研究[J].生物技术,2010(1):62-65.
[31]杨大令,吴迪,张守海,等.分体式中空纤维酶膜反应器制备5′-核苷酸的研究[J].食品工业科技,2007,28(11):167-169.
[32]邵卫祥,莫晓燕,李黎.磁性交联核酸酶P1聚集体的制备及性质研究[J].西安交通大学学报,2008,42(8):1035-1039.
Advances on the nuclease P1 fermented by Penicillium citrinum
YU Chen1,ZHAO Jie2,ZHANG Ya-xiong1,ZHU Chang-xiong2,YAO Juan2,LI Zhi-hong2
(1.Key Laboratory of Bio-engineering,China Three Gorges University,Yichang 443002,China;2.Angel Yeast Co.,Ltd.,Yichang 443003,China)
Nuclease P1 is an important industrial enzyme,it can be used for hydrolyzing nucleic acid to produce 5′-nucleotide.The strain selection,medium optimization,fermentation processcontrol,concentration,related applications and domestic and international market conditions of nuclease P1 produced by Penicillium citrinum were reviewed.
nuclease P1;Penicillium citrinum;fermentation
Q814.4
A
1002-0306(2010)11-0416-04
2010-06-28
喻晨(1985-),男,硕士研究生,研究方向:微生物代谢工程。
