溶解氧和污泥粒径分布对城市污水SND影响
2010-11-14聂会元左金龙
王 川,聂会元,左金龙,李 桥
(1.重庆大学a.建设管理与房地产学院,b.科技企业集团,c.城市建设与环境工程学院,重庆 400045;2.哈尔滨商业大学环境工程系,哈尔滨 150076)
同步硝化反硝化(Simultaneous Nitrification and Denitrification)简称SND,是指硝化和反硝化过程在同一反应器中同时进行,它是由于好氧系统中污泥絮体内部缺氧产生的[1-2]。在同一处理系统中实现同步硝化反硝化过程,硝化反应的产物可直接成为反硝化反应的底物,避免了硝化过程中硝酸盐的积累对硝化反应的抑制,加速了硝化反应的速度;而且反硝化反应中所释放出的碱度可部分补偿硝化反应所消耗的碱度,无需外添碱度[3-5]。硝化反应和反硝化反应可在相同的条件和系统下进行,简化了操作难度。SND大大简化生物脱氮工艺并提高脱氮效率,从而节省投资、提高处理效率,也可节省碳源。对于连续运行的SND工艺污水处理厂,可以减少缺氧池容积。对于仅由一个反应池组成的SBR反应器而言,SND能够降低实现完全硝化反硝化所需的总时间[6-7]。
目前SND生物脱氮的机理分析主要有以下3种:宏观环境理论、微环境理论和生物学理论,其中微环境理论占主导地位[8-9]。微环境理论认为,生物反应器中的微生物个体形态较小,一般在50μm~80μm之间[10-11]。同时影响生物的生存环境也是微小的,在溶解氧(Dissolved Oxygen,DO)比较低的好氧条件下,由于存在传质阻力,在活性污泥菌胶团的不同深处,存在缺氧区和好氧区两种微环境类型,它们的位置、微生物类型、基质分布与代谢活动、DO含量具有很大差异。缺氧区在菌胶团内部,其DO浓度很低,适宜于反硝化菌生活;而处于菌胶团外部的好氧区,DO较高,以有机物好氧降解菌(异养菌)和硝化菌为主。异养菌、硝化菌和反硝化菌分别占据适宜的生态位,系统通过硝化菌和反硝化菌的协同作用实现同时硝化反硝化生物脱氮。
现有的的研究成果认为SND关键控制因素主要为DO、污泥絮体形态因素,pH值、温度、污泥龄、碳源等因素也会对其产生一定的影响。DO浓度对能否实现SND是至关重要的,通过控制DO浓度,调节硝化和反硝化速率都能达到比较合适的水平,最佳的状态是使硝化速率与反硝化速率达到基本一致,以保证完全硝化反硝化。另外,微生物絮体结构也直接影响污泥絮体内部好氧区与缺氧区比例的大小和絮体内部物质的传质效果,进而影响微生物对DO和底物获取的难易程度。体积较大的污泥颗粒增加了缺氧微环境的比例,结构密实的污泥颗粒的传质阻力大。只有颗粒大小适中的污泥才能保证DO和有机碳源在污泥絮体内部的分布有利于同步硝化反硝化。
由于目前不同的学者分别支持不同的观点,SND的机理尚未十分清晰,因此该文主要针对DO浓度、污泥粒径分布考察对城市污水SND的影响。
1 材料与方法
1.1 试验用水来源和水质
该试验所用生活污水取自哈尔滨商业大学校园生活区,水质主要指标如表1中所示。

表1 试验废水成份
1.2 试验装置和方法
采用2个反应器平行试验,每个反应器由有机玻璃制成,上部为圆柱形,下部为圆锥体,高为700 mm,直径为200 mm,总有效容积为12 L。

图1 试验装置
试验期间采用温度控制器,反应器中混合液的温度控制在25±1℃。运行方式为瞬时进水、缺氧搅拌30 min、好氧曝气3 h、静止沉淀2 h和闲置待机2.5 h,因此每个周期运行时间为8 h,每d运行3个周期。每周期结束后排放泥水混合液,控制MLSS在2000 mg/L-2500 mg/L,SRT=15 d左右。
1.3 检测分析项目与方法
指标采用国家环保总局颁布的标准分析方法测定[12]。COD采用5B-3型COD快速测定仪测定;NH4+-N采用纳氏试剂分光光度法;MLSS、SS采用滤纸重量法;DO、pH、ORP和温度采用 WTW inoLab Oxi level2实验室台式溶解氧仪在线检测。COD和氨氮的试验结果均选取试验稳定的典型周期,采用重现性较好的数据。污泥粒径分布测定采用HIAC Royco9703粒径分析仪。
2 结果与讨论
2.1 SND分析
在SBR反应器典型周期内,采用低DO(平均DO=0.5~0.8 mg/L)控制SND形成,活性污泥由下面4部分组成:1)具有代谢功能活性的微生物群体(主要是细菌);2)微生物内源代谢、自身氧化的残留物;3)由原水带的细菌难降解的惰性物质;4)由原水带入的无机物质。通过微生物的代表公式(C5H7NO2)可以估算得出用于细胞合成所消耗的氮量。绘制SBR反应器发生SND时的氮平衡图,如图2所示。
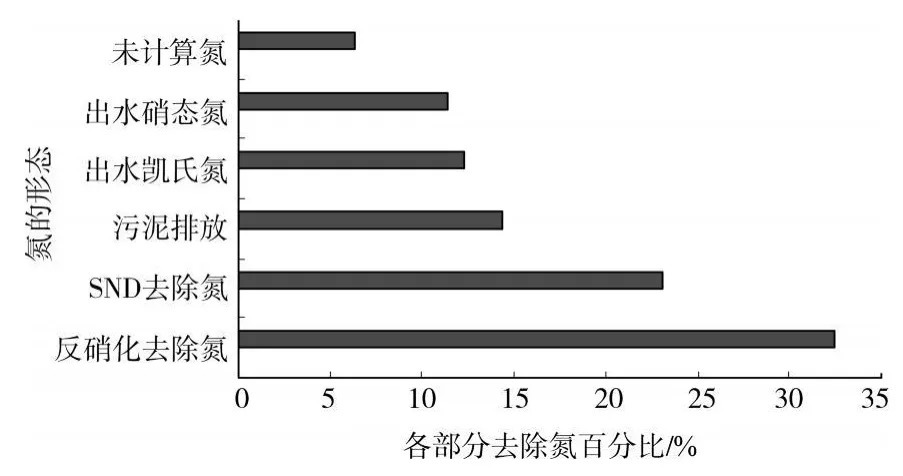
图2 SND时氮元素物料平衡
由图2中所示,对于城市污水,在SBR典型的反应周期内,氮元素主要通过缺氧段的反硝化脱氮、好氧段的SND、剩余污泥的排放等途径得到有效去除。其中缺氧反硝化去除氮的量占总氮的32.46%,而占总氮大约23.11%的氮是通过SND现象去除的。可见系统存在明显的同步硝化反硝化(SND)现象。
2.2 SND与DO关系
以往研究表明,SND现象均是在较低的DO浓度的条件下发生的。但在DO浓度较高时,是否仍然会发生明显的同步硝化反硝化现象?为此分别在低曝气量和高曝气量的条件下对DO浓度与SND的关系进行了试验研究,得到高DO和低DO浓度与NOX-N生成速率和氨氮氧化速率之比(发生SND的程度)的关系,见图3。
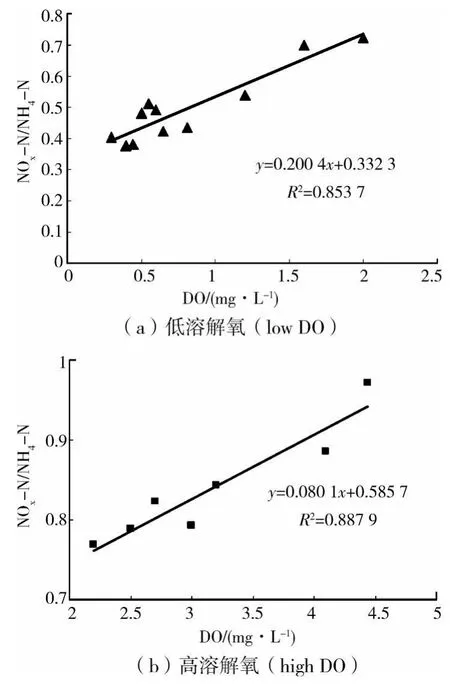
图3 DO与NOX-N生成速率和氨氮氧化速率之比间的关系
根据图3的试验数据,可得出低DO浓度和高DO浓度条件下的两个表达关系式:
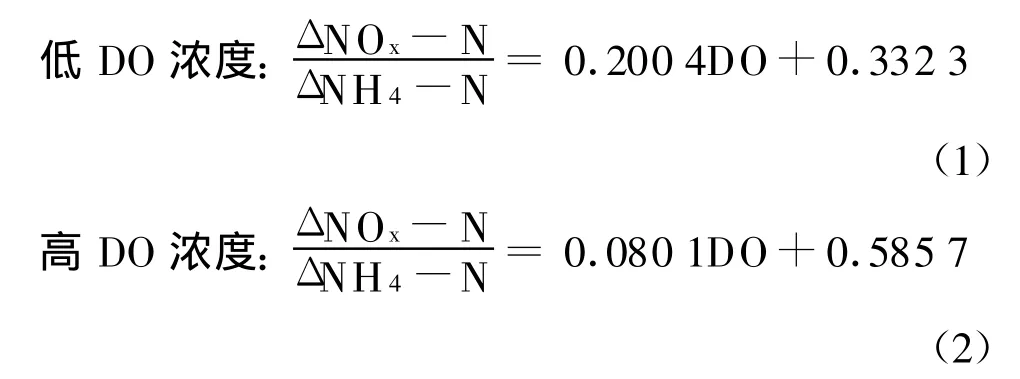
分析公式1和2发现,在高和低DO浓度条件下,NOX-N生成速率与NH4-N氧化速率之比与DO高、低浓度都均保持了较好的线性关系。将DO高、低浓度与NOX-N生成速率与氨氮氧化速率之比绘图,见图4。
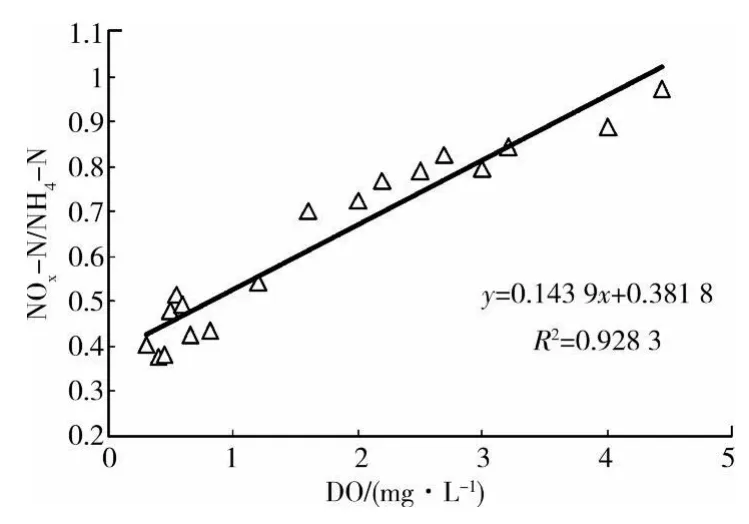
图4 DO与NOX-N生成速率和氨氮氧化速率之比间的关系
由图4中可得出二者的函数关系式如式3:
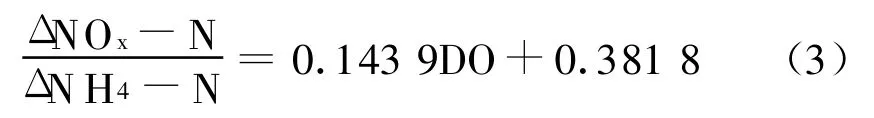
将方程式(1)、(2)和(3)进行比较后发现,在低DO活性污泥的SBR反应器中,SND与DO浓度存在着明显的线性关系。当DO浓度为4.296 mg/L时,硝化反应产生的氨氮的减少量与硝态氮的生成量相等,此时基本不发生SND现象;当溶解氧浓度为0.5 mg/L时,硝态氮的生成量与氨氮的减少量之比为0.454,与Munch等曾报道的达到相等硝化速率与反硝化速率时的溶解氧浓度(0.5 mg/L)基本相当[13]。表明在SBR反应器中,当好氧条件下进行硝化反应的同时,也进行着好氧反硝化过程。
可见DO浓度与SND的发生具有明显的直接关系。通过调节反应器中的DO浓度,使反应系统中的硝化反应以最大的反应速率进行,同时兼顾同步硝化反硝化,对于缩短SBR硝化反硝化反应的时间,指导污水处理厂生产实践具有重要的现实意义。
2.3 SND与污泥颗粒粒径的关系
在进行SND的试验的同时,针对活性污泥菌胶团颗粒的大小也进行考察,结果见图5。
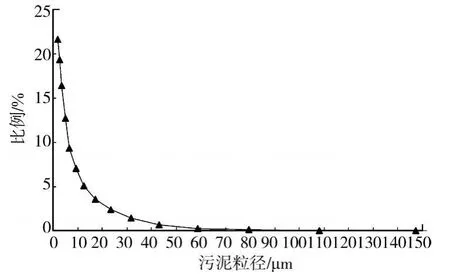
图5 SND条件下活性污泥菌胶团颗粒分布
从图5中可以看出,实验活性污泥菌胶团颗粒粒径主要分布在 2μm ~6.83μm,平均粒径为 5.02μm~6μm,远远小于文献报道的活性污泥菌胶团颗粒粒径的平均值52μm和Beccari报道的平均80μm[10-11]。
分析产生粒径小的原因:实验采用家属区生活污水,水质属于普通城市污水。根据污泥絮体形态观察,发现在SND时活性污泥的颗粒比较细小破碎。在低DO的条件下,如此小的污泥粒径下,DO扩散非常迅速,不会产生DO浓度的梯度分布,也不会因为在菌胶团内部产生缺氧区。因此在这种条件下发生SND的现象,一定不是“微环境作用”的单一结果。
实验是在非常小的菌胶团颗粒粒径(5.02μm~6μm)条件下实现了SND,证明以往的关于SND微环境理论解释的具有一定的片面性。而目前普遍接受的理论为:在菌胶团颗粒粒径较大的条件下,由于DO的扩散,菌胶团内部产生缺氧环境,从而发生SND现象。但该实验的结果证明:由于DO扩散产生浓度梯度引发SND现象,并不是SND形成的唯一原因。
3 结论
1)采用SBR工艺处理城市污水,反应器中总氮中大约23.11%的氮是通过SND去除的。氮平衡计算证实了SBR工艺污泥微膨胀状态下发生了明显的SND现象。
2)在高DO和低DO浓度的条件下,硝态氮生成速率与氨氮氧化速率之比与DO浓度间均保持了较好的线性关系。通过调节反应器中的DO浓度,使反应系统中的硝化反应以最大的反应速率进行,同时兼顾同步硝化反硝化,对于缩短SBR硝化反硝化反应的时间,指导污水处理厂生产实践具有重要的现实意义。
3)当DO浓度为4.296 mg/L时,硝化反应产生的氨氮的减少量与硝态氮的生成量相等,此时基本不发生SND现象;当DO浓度为0.5 mg/L时,硝态氮生成量与氨氮的减少量之比为0.454,硝化速率与反硝化速率基本相当。
4)当SND发生时,活性污泥菌胶团平均颗粒粒径仅为5.02~6μm,远小于文献报道活性污泥菌胶团颗粒粒径,仍然会发生明显的SND现象,说明SND不是单纯的“微环境作用”的结果。
[1]HOLMAN J B,WAREHAM D G.COD,ammonia and dissolved oxygen time profiles in the simultaneous nitrification/denitrification process[J].Biochemical Engineering Journal,2005,22(2):125-133.
[2]ZHANG DAIJUN,LU PEILI,LONG TENGRUI,et al.The integration of methanogensis with simultaneous nitrification and denitrification in a membrane bioreactor[J].Process Biochemistry,2005,40(2):541-547.
[3]EVELYN W,HILLE A,HE M EI,et al.Simultaneous nitrification/denitrification in a biofilm airlift suspension(BAS)reactor with biodegradable carrier material[J].Water Research,2009,43(18):4461-4468.
[4]PARK W,NAM YOUN-K U,LEE MYUN-JOO,et al.Simultaneous nitrification and denitrification in a CEM(cation exchangemembrane)-bounded twochamber system[J].Water Research,2009,43(15):3820-3826.
[5]SARIOGLU M,INSEL G,ARIAN N,et al.M odel evaluation of simultaneous nitrification and denitrification in a membrane bioreactor operated without an anoxic reactor[J].Journal of Membrane Science,2009,337(1/2):17-27.
[6]SEUNG H B,KRISHNA R P.Simultaneous nitrification and denitrification of municipal wastewater in aerobic membrane bioreactors[J]. Water Environment Research,2008,80(2):109-117.
[7]左金龙,王淑莹,姜安玺,等.低溶解氧污泥微膨胀前后污泥硝化活性的对比研究[J].土木建筑与环境工程,2009,31(4):117-122 ZUO JIN-LONG,WANG SHU-YING,JIANG AN-XI,et al.Study on comparison ofsludge nitrification activity before and after micro-bulking sludge with low DO[J].Journal of Civil, Architectural &Environmental Engineering,2009,31(4):117-122.
[8]LONG TENGRUI,CAO YANXIAO,ZHANG HONGJING,etal.Performance of simultaneous nitrification and denitrification in lateral flow biological aerated filter[J].Journal of Chongqing University,2006,5(4):223-228
[9]CHIU YING-CHIH, LEE LI-LING, CHANG CHENG-NAN,et al.Control of carbon and ammonium ratio for simultaneous nitrification and denitrification in a sequencing batch bioreactor[J].International Biodeterioration&Biodegradation,2007,59(1):1-7
[10]BAKTI N A K,DICK R I.A Model for a nitrifying suspended-growth reactorincorporating intraparticle diffusional limitation[J].Water Research,1992,26:1681-1690.
[11]BACCARI M,PINTO D,RAMADORI A C,et al.Effects of dissolved oxygen and diffusion resistance on nitrificatioin kinetics[J].Water Researach,1992,26:1099-1104.
[12]国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002,53-74
[13]MUNCH E V,LANT P,KELLER J.Simultaneous nitrification and denitrification in bench scale sequencing batch reactors[J].Water Research,1996,30(2):277-284
