美国兽用抗菌药耐药性管理
2010-11-14张苗苗戴梦红黄玲利王玉莲袁宗辉
张苗苗,戴梦红,黄玲利,王玉莲,袁宗辉
(华中农业大学动物科技 -动物医学院,国家兽药残留基准实验室,武汉 430070)
抗菌药可用于预防、控制、治疗动物疾病及促进动物生长,因此推动了全球畜牧业的健康发展。但是抗菌药广泛应用的同时,耐药菌也随之产生,因而导致药物疗效减弱甚至消失,给畜牧养殖业带来巨大的经济损失;而且耐药菌可以转移给人类,影响人类健康和医疗。随着畜产品贸易的全球化,耐药菌株在国际间开始传播和蔓延。因此,各国都在积极采取措施控制耐药性的产生和蔓延,我国在这方面才刚刚起步。本文就美国有关兽用抗菌药耐药性的管理做详细阐述,旨在促进我国兽药合理使用以及加强耐药性的管理。
1 美国耐药性管理机构
美国兽药管理工作主要由食品药品管理局(the Food and Drug Administration,FDA)和农业部(United States the Department of Agriculture,USDA)来负责(图 1)。此外,疾病控制和防治中心(CDC)、环境保护局(EPA)、州药事委员会(SBP)、美国兽医协会(AVMA)也都参与耐药性的管理工作。

图1 美国兽药耐药性管理机构
1.1 食品药品管理局(FDA) FDA下设的兽药中心(Center for Veterinary Medicine,CVM)是一个专门负责兽药管理的机构,负责动物药品的审批、生产、经营和使用;负责鉴定和追踪饲用抗菌药的危险性,并且具有调控责任,保证食品动物用抗菌药不对人类健康造成影响。CVM设有专门的动物与食品微生物学处(Division of Animal and Food Microbiology),主要针对动物使用抗菌药的作用效果开展基础性和应用性研究,包括对病原体和共生微生物耐药性产生及蔓延的研究。
1.2 农业部(USDA) USDA下设的食品安全检验局 (Food Safety and Inspection Service,FSIS)、动植物健康检验局(Animaland PlantHealth Inspection Service,APHIS)和农业研究局(Agricultural Research Service,ARS)都参与抗菌药耐药性的管理和监控。
ARS细菌流行病学和抗菌药耐药性研究单位(Bacterial Epidemiology and Antimicrobial Resistance Unit,BEAR)是 USDA/Russell研究中心的一部分,负责评估和检测动物用抗菌药影响人类健康的程度;了解食源性病原体耐药性的流行和生产设备及环境中影响耐药性产生存留的因素;研究耐药性产生的分子机制;研究共生菌在耐药性产生和转移中的作用,并负责兽医组的抗菌药耐药性监测工作[1]。
APHIS、ARS、FSIS联合成立了动物健康和食品安全流行病学合作组(Collaboration in Animal Health and Food Safety Epidemiology,CAHFSE),主要监测农场和工厂的细菌,了解它们在食品安全中的危害,提供食品动物常规监测重大疾病的方法,并强调相关细菌的抗菌药耐药性问题。
2 美国耐药性管理措施
2.1 成立机构间抗菌药耐药性联邦工作组 为了减少抗菌药耐药性对人类公共卫生的危害,1999年由疾病控制和防治中心(CDC)、国家卫生研究院(NIH)和 FDA主导,此外还包括 USDA、美国卫生保健机构和品质机构(AHRQ)、医疗保健和医疗补助服务中心(CMS)、环境保护局(EPA)等总共 10个机构创立了机构间抗菌药耐药性联邦工作组(Interagency Federal Task Force on Antimicrobial Resistance,TFAR),2001年又加入了美国国际发展署(USAID)。2000年6月该工作组提出了“对抗耐药性公共卫生工作计划”的草案,于 2001年1月正式发布,主要针对人类和农业抗菌药耐药性问题,从监测、预防与控制、研究、产品研发中的不同议题提出建议和目标,并指定相关负责部门,包括 84项(其中 13项优先考虑)条款,并且每年都发布公共计划实施的年度进展报告[2]。
2.2 制定相关指导文件
2.2.1 安全框架 1998年11月18日联邦注册(Federal Register,FR)发布了“食品动物用抗菌新兽药的微生物作用对人类健康影响的评价”指导草案,这是政府机构考虑抗菌新兽药用于食品动物相关问题的第一步[3]。1999年1月联邦注册提出了“关于评价抗菌新兽药对人的微生物的安全影响和确保新的抗菌药物在食品动物使用的安全框架”(Framework Document)[4],这是政府机构考虑怎样评价和降低食品动物用抗菌药对人类健康的潜在影响的第二步。FDA和科学团体及一些相关感兴趣的参与者共同讨论,在概念上提出了以风险评估为基础对食品动物用抗菌药微生物安全进行评价。这个安全框架包括 5个部分[5]:抗菌新兽药使用对人类病原体荷载量影响的评估;拟用于动物的药,根据在人药的重要性和人类对这些耐药菌(从食品中获得的,是人类致病菌或者能够转移给人类)的潜在暴露进行安全评估;对拟使用药物的耐药转移水平的预审前资料的评估;建立耐药临界值和监测临界值,确保批准使用的药物在临界值内不会导致动物耐药的产生或转移给人类;建立批准后研究和监测。
2.2.2 GFI#78 FDA-CVM于 1999年12月13日发布了 Guideline#78即“食品动物用抗菌新兽药的微生物效应对人类健康影响的考虑”[6],代替了1998年的指导草案。该文件指出抗菌药用于食品动物,可以改变动物的肠道菌,包括增加病原体荷载量,产生耐药性,消费被细菌污染的动物食品将危害人类健康,并提出两个评价因素:一是使用新的抗菌药物后动物肠道中形成的耐药性肠道菌的数量(即耐药性);二是动物肠道中引起人患病的肠道菌数量的变化(即致病菌的荷载量)。而且,FDA认为那些拟用于食品动物的抗菌新兽药的申报者应该考虑耐药性产生及那些药物的微生物效应对人类健康的潜在影响。
2.2.3 确立食品动物用抗菌药临界值 2000年12月19日发布了“食品动物用抗菌药临界值的确立方法”[7],该文件提出要建立两种临界值,即耐药临界值和人类健康临界值。人类健康临界值是指由于食品动物用抗菌药产生耐药菌而引起的人类感染的流行率;耐药临界值是指食品动物分离的耐药菌不能够对人类造成危害的最大允许水平,是以流行病学为基础的,用于描述人类健康临界值和动物耐药水平之间的关系,超过耐药临界值的抗菌药将被认为对人类来说不再是安全的。
2.2.4 GFI#152 2003年10月23日健康与人类服务部(DHHS)、FDA/CVM公布了“抗菌新兽药对与人类健康相关细菌微生物学影响的安全性评价”指导原则(GFI#152)[8],代替了前面的 GFI#78。该导则提出了抗菌新兽药对非目标菌潜在影响的评价程序,并把它作为新兽药报批的一部分。该指导原则的主要内容包括:指导原则适用范围、危险分析方法、危害的特点、定性的抗菌药耐药性危险评价、危险管理策略等。其中微生物方面的食品安全评价程序包括:危害特点的论述、释放评估、暴露评估、后果评估、总危险评估以及根据总危险评估结果决定采取的管理措施(图 2)。

图2 定性耐药性风险评估程序
2.2.5 VICH GL27 药物批准前要考察所有的属于食品安全的相关信息,包括潜在的促进食源性病原体耐药性产生和蔓延的资料。因此,2004年4月27日,DHHS、FDA-CVM发布了 Guidance for Industry#144(VICH GL27)即“用于食品动物的抗菌新兽药耐药性预审资料指南”[9]。该指南描述了食品动物在拟使用条件下使用抗菌药可能导致耐药性产生的资料,分为“基本资料”和“附加资料”。基本资料是申报者要递交的资料,包括抗菌药种类,作用机制(抑菌和杀菌作用),活性谱,耐药机制和遗传机制,耐药基因出现和转移率,交叉耐药的出现,联合耐药的出现和药物代谢动力学。附加资料是申报者可以选择其中的几项或全部,包括体外突变频率研究,肠道内的抗菌药活性,其他动物的研究和一些相关的文献资料。
2.3 耐药性监测 为了解抗菌药耐药性的产生、威胁程度和耐药性随时间转移的趋势等信息,1996年DHHS/FDA/CVM、DHHS/CDC、USDA(USDA/FSIS、USDA/ARS、USDA/APHIS)合作成立了国家抗菌药耐药性监测系统(National Antimicrobial Resistance Monitoring System,NARMS)[10],主要对人、动物、零售食品中分离的食物传播病原体的耐药性进行监测,初步决定也将对动物饲料成分进行监测。NARMS的主要目的是提供抗菌药对肠道菌敏感性趋势的描述性数据;鉴别抗菌药耐药性在人类、动物及肉品的提升情况;提供兽医师及医师及时的信息;提供不易获得的肠道菌分离株,用于诊断方法的建立,发现新的耐药基因和耐药性产生的分子机制的研究;推广正确用药观念以延长核准药物的使用期限。
人类分离菌的检测主要由 CDC下设的国家传染病中心(NCID)负责。动物样本从健康的农场动物、动物临床、屠宰场和加工厂获得,健康动物样本主要由 USDA下设的动植物健康检验局(APHIS)和国家动物健康检测系统(NAHMS)提供,动物临床样本主要由兽医诊断实验室包括 USDA下设的国家兽医服务实验室(National Veterinary Service Laboratory)分离,屠体样本主要由联邦监测屠宰场提供,所有的动物样本都由位于乔治亚州亚特兰大市的农业研究局(USDA/ARS)内设的 Russell研究中心负责进行敏感性检测。零售食品(主要包括牛肉、火鸡、猪排、鸡脯等)和动物饲料中分离的肠道细菌由 CVM研究实验室(Office of Research Lab in Laurel,MD)进行抗菌药敏感性检测(图 3)。
NARMS动物组监测的细菌包括非鼠伤寒沙门氏菌、弯曲杆菌、大肠杆菌和肠球菌,监测的动物主要包括牛、猪、肉鸡和火鸡。NARMS每年根据具体情况来不断调整监测的抗菌药种类,2006年对 9种抗菌药进行弯曲杆菌敏感性试验,对 15种抗菌药进行沙门氏菌和大肠杆菌敏感性试验,对 17种抗菌药进行肠球菌敏感性检测。USDA/ARS每年都提供 NARMS总结报告,包括零售肉和动物饲料的检测结果报告,还要定期召开公众会议,报告监测结果。为了在全球范围内共享耐药性病原体的扩散信息,NARMS也和其他国家的抗菌药耐药性监测系统合作,包括加拿大、丹麦、法国、荷兰、挪威、瑞典、墨西哥,机构间和机构内都已经开展了相关的流行病学和微生物学的研究。
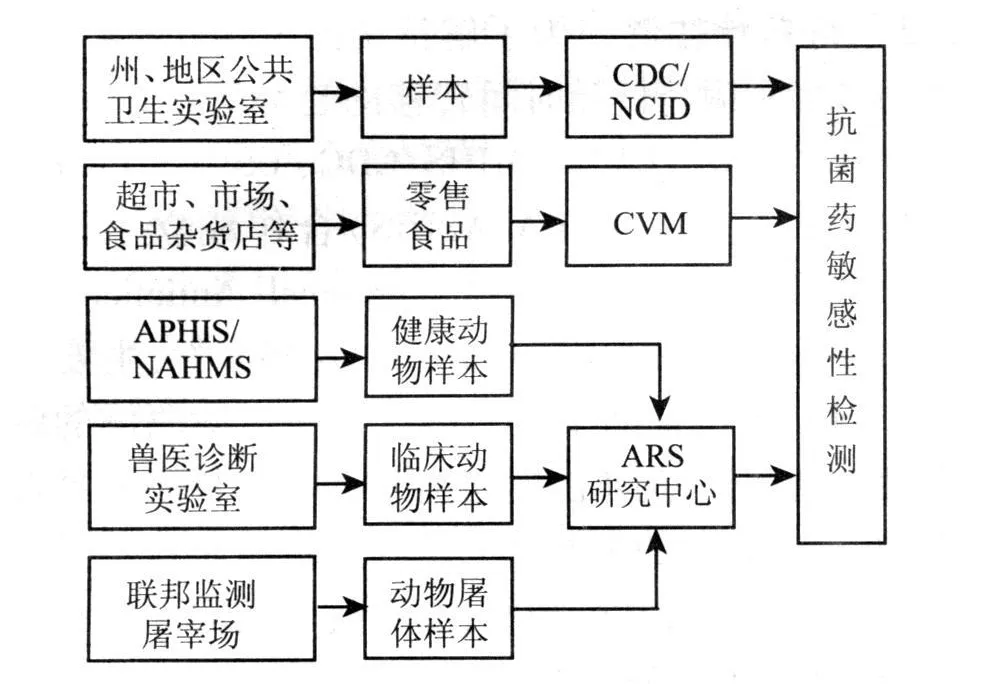
图3 美国现行的抗菌药耐药性检测程序
2.4 风险分析模型 为了更好的评估动物用抗菌药对人类健康的影响,CVM建立了定量风险评估模型。第一个风险评估模型是 1998-1999年FDA/CVM对由于消耗鸡肉而引起的耐氟喹诺酮类的弯曲杆菌对人类健康影响的评估。根据食用鸡肉而引起的耐氟喹诺酮(FQ)的弯曲杆菌感染的案例数和被耐氟喹诺酮的弯曲杆菌污染的鸡肉的消耗量,用风险模型进行评估。2000年10月18日公布了评估报告,包括五个方面:上报到卫生部的弯曲杆菌案例数的评估,美国实际的弯曲杆菌案例数的评估,由于食用鸡肉而引起的耐氟喹诺酮的弯曲杆菌感染的案例数的评估,被耐氟喹诺酮的弯曲杆菌污染的鸡肉的消耗量的评估,最后用模型进行风险评估[11]。该模型可以预测未来家禽屠体中耐药流行率、其他模型参数和对人类健康的影响,但是这个模型只是对由于消耗鸡肉引起的风险进行定量化,对病原体从鸡到其他食源性的扩散影响并没有进行定量化。
第二个模型用来评价人类屎肠球菌对链阳霉素(Streptogramin)的耐药性和在食品动物用链阳霉素之间的关系来阐明耐药因子的转移。共杀素(奎奴普丁/达福普汀,Q/D)是用于人类的链阳霉素,维吉霉素(Virginiamycin)是用于动物的链阳霉素,一些科学家认为农场用维吉霉素将引起人类对共杀素的耐药。2000年FDA/CVM开始对维吉霉素进行风险评估,在 2004年11月23日,FDA/CVM公布了第一份风险评估结果报告,该报告根据 GFI#152的评估程序对链阳霉素进行了风险分析和评价[12]。
2.5 颁布禁令 1997年8月20日起,由于耐药性问题 FDA禁止将 FQ和氨基糖苷类作为非限制性药物使用[13];2003年禁止糖肽类抗菌药在进出口动物源食品中使用;2005年9月12日起,由于恩氟沙星用于家禽感染可能导致人类弯曲杆菌耐药性的增加,禁止恩氟沙星用于治疗家禽细菌感染[14]。
2.6 慎用抗菌药 美国兽药协会成立了抗菌耐药性指导委员会,强调应通过合理的饲养管理降低抗菌药的使用量,通过合理使用抗菌药降低耐药性的产生和蔓延,并制定了《慎用抗菌药治疗原则》,用于指导兽医人员治疗牛、家禽、猪、马、猫、狗、食用鱼等的临床用药[15]。美国养猪、养牛、禽类病理学会还制定了养猪业、肉牛业、奶牛业、养禽业和食用鱼慎用抗菌药的宣传材料。FDA为这些小册子的制定、印刷、发放提供经费,并把这些小册子发放给兽医人员、各兽医协会和兽医院校。
3 小结
控制抗菌药耐药性是一项复杂的系统工程,需要兽药工业、饲料生产商、兽医人员、畜禽饲养者、立法者和消费者等全方位密切合作。我国对兽药的管理还不完善,滥用抗菌药现象很普遍,在兽医领域至今也没有建立国家耐药性监测系统,因此,需要借鉴国外的管理经验,根据我国的具体情况,在全国开展抗菌药耐药性监测和动物源耐药菌对人类健康影响的风险评估,并在新兽药注册审批时增加相关的耐药性资料,最终有效地预防和控制耐药性的产生和蔓延。
[1] Bacterial Epidemiology and Antimicrobial Resistance[DB/OL].http://www.ars.usda.gov/main/site_main.htm?modecode=66120508.
[2] A Public Health Action Plan to Combat Antimicrobial Resistance[DB/OL].http://www.cdc.gov/drugresistance/actionplan/aractionplan.pdf.
[3] Docket No.98D-0969.FederalRegister/Vol.63,No.222/Wednesday,November 18,1998/Notices,64094.
[4] Docket No.98D-1146.Federal Register/Vol.64,No.3/Wednesday,January 6,1999/Notices,887-888.
[5] A Proposed Framework for Evaluation and Assuring the Human Safety of the MicrobialEffects of Antimicrobial New Animal Drugs Intended for Use in Food-Producing Animals.
[6] Guideline No.78.Consideration of the Human Health Impact of the Microbial Effects of Antimicrobial New Animal Drugs Intended for Use in Food-Producing Animals.FDA/CVM.December 13,1999.
[7] A Discussion Document.An Approach for Establishing Thresholds in Association with the Use ofAntimicrobial Drugs in Food-Producing Animals.FDA Center for Veterinary Medicine December 19,2000.
[8] Guidance for Industry#152.Evaluating the Safety of Antimicrobial New Animal Drugs with Regard to Their Microbiological Effects on Bacteria of Human Health Concern.FDA/CVM.October 23,2003.
[9] Guidance for Industry#144.Pre-Approval Information for Registration of New Veterinary Medicinal Products for Food-Producing Animals with Respect to Antimicrobial Resistance VICH GL27.FDA/CVM.April 27,2004.
[10]National Antimicrobial Resistance Monitoring System[DB/OL].http://www.fda.gov/cvm/narms_pg.html#Data.
[11]Human Health Impact of Fluoroquinolone ResistantCampylobacter Attributed to the Consumption of Chicken.FDA/CVM.October 18,2000.
[12]Risk Assessment of Streptogram in Resistance in Enterococcus faecium Attributable to the Use of Streptogram ins in Animals“Virginiamycin Risk Assessment”.November 23,2004.
[13]Docket No.97N-0172.Federal Register/Vol.62,No.99/May 22,1997/Notices,27944-27947.
[14]Docket No.2000N-1571.FederalRegister/Vol.70,No.146/Monday,August 1,2005/Notices,44105.
[15]American Veterinary Medical Association Guidelines.Judicious Therapeutic Use of Antimicrobials.May 2004.
