应用胚胎干细胞实验模型体系对异硫氰酸盐发育毒性的评价
2010-11-12徐海滨
于 洲,徐海滨
(中国疾病预防控制中心营养与食品安全所,北京 100021)
异硫氰酸盐(isothiocyanates,ITC)是对一类具有N=C=S结构的小分子化合物的总称,其在十字花科包括西兰花、卷心菜、芥蓝、花茎橄榄和孢子甘蓝等蔬菜中含量丰富,在现已发现的大约20多种ITC中,通过饮食常接触的主要包括:烯丙基异硫氰酸盐(allyl isothiocyanate)、苯甲基异硫氰酸盐(benzyl isothiocyanate,BITC)、苯乙基异硫氰酸盐(phenethyl isothiocyanate,PEITC)和莱菔硫烷(sulforaphane),它们都具有对神经系统、免疫系统、肿瘤等疾病的保健及治疗作用[1]。但目前ITC毒性资料仅局限于其作为风味剂等在较低摄入量水平时的风险性评价,对作为膳食补充剂或保健食品等摄入ITC可能导致的健康风险,现有的安全性的评价资料尚不完备。近年又有报道已广泛使用的ITC的某些成分中可能存在对实验动物的母体毒性和胚胎毒性作用[2],这引起了其在食用安全性方面的关注。
因此本研究将利用胚胎干细胞(embryonic stem cells,ESC)体外经悬浮、悬滴培养分化为心肌细胞[3]和经视黄酸(retinoic acid)诱导培养分化为神经细胞[4]的方法,以分化获得的心肌细胞和神经细胞为观察终点,对BITC和PEITC可能的发育毒性作用进行筛选和评价,为ITC的食用安全性提供科学依据。
1 材料与方法
1.1 细胞
129品系小鼠胚胎干细胞D3细胞和BALB/c品系小鼠3T3细胞均购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
1.2 试剂与仪器
PEITC(纯度99%)和 BITC(纯度98%)购自Sigma公司,敲除DMEM培养基、胰蛋白酶/依地酸(trypsin/EDTA)、特级胎牛血清、谷氨酰胺、β-巯基乙醇(β-mercaptoethanol)、非必需氨基酸、磷酸盐0.1 mol·L-1缓冲液、羟乙基哌嗪乙磺酸〔4-(2-hydroxyerthyl)piperazine-1-erthanesulfonic acid〕、软琼脂、白血病抑制因子和视黄酸购自Sigma公司;二甲亚砜(dimethyl sulfoxide,DMSO)、逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)试剂盒、Trizol细胞裂解液购自Invitrogen公司;Taq DNA聚合酶购自上海生物工程公司,其余试剂均为国产分析纯。IX71倒置显微镜(日本Olympus公司)、TOMY LC-120低速离心机(日本Tomy公司)、低温高速离心机(美国Beckman公司)、TGL-16B台式高速离心机(重庆安科医疗器械公司)、PCR仪(德国Biometra公司)和凝胶成像仪(上海天能科技有限公司)。
1.3 胚胎干细胞体外培养[3]
取出-180℃液氮冷冻条件下保存的ESC D3细胞进行细胞复苏,接种于备用的小鼠胚胎成纤维细胞(mouse embryonic fibroblast)饲养层上,加入含15%特级胎牛血清、β-巯基乙醇 0.1 mmol·L-1、羟乙基哌嗪乙磺酸 1 mmol·L-1、谷氨酰胺 2 mmol·L-1、1%非必需氨基酸及1×106U·L-1白血病抑制因子的敲除DMEM培养基进行维持培养。为保持其理想的未分化状态,当胚胎干细胞团集落达到60% ~70%融合时,即需传代。
1.4 苯甲基异硫氰酸盐和苯乙基异硫氰酸盐对胚胎干细胞D3和3T3细胞毒性的检测[5]
分别将200μl 500个BALB/c 3T3细胞和129小鼠D3细胞分别接种在96孔培养板上,每孔中加入BITC 和 PEITC 0.5,1,2,4,6,8,10,12 和 14 μmol·L-1,同时设立阴性对照组。第3和第5天更换培养基,第10天用MTT法检测细胞活性,于波长570和630 nm处检测量其吸光度值(A),制成浓度-反应曲线,求出BITC和PEITC对细胞活性的半数抑制浓度(50%inhibitory concentration,IC50),其中对ESCD3细胞活性半数抑制浓度以IC50(D3)表示,对3T3细胞活性的半数抑制浓度以IC50(3T3)表示。
1.5 苯甲基异硫氰酸盐和苯乙基异硫氰酸盐抑制胚胎干细胞体外分化为心肌细胞能力的检测[7]
根据文献[6]及ESC活性抑制的检测结果,取DMSO溶解的BITC和PEITC用上述ESC培养液(无白血病抑制因子)溶解至浓度为0,1,2,4和8 μmol·L-1。BITC和PEITC抑制 ESC体外分化为心肌细胞能力检测方法见参考文献[7]。
1.6 苯甲基异硫氰酸盐和苯乙基异硫氰酸盐抑制胚胎干细胞分化为神经细胞能力检测[8]
1.6.1 悬滴、悬浮培养
取生长旺盛的ESC,用0.25%胰蛋白酶/EDTA消化成单细胞悬液,加入ESC培养基调整细胞密度至1×105L-1后滴于直径10 cm的细菌培养皿盖板上,每滴30μl,随即将培养皿盖倒扣于培养皿上,形成细胞悬滴。将此培养皿放入37℃,50%CO2培养箱中培养3 d。以1%软琼脂铺底于6 cm细菌培养皿中,将悬滴培养3 d由ESC形成的胚体(embryonic bodies)转入其中继续悬浮培养1 d。悬滴、悬浮培养阶段所用培养基不含白血病抑制因子和β-巯基乙醇,胎牛血清也由常规培养时的15%增加到胚体培养阶段的20%。
1.6.2 视黄酸诱导的ESC神经定向分化
将上述悬浮培养的胚体转移至黏附性组织培养瓶中,加入含上述BITC和PEITC的ESC培养基(无白血病抑制因子),同时加入视黄酸(终浓度为0.5 μmol·L-1)进行神经分化诱导。上述含 BITC和PEITC和视黄酸的培养基,每2 d换液1次,于诱导后第4天停用。
1.7 RT-PCR法检测分化特异基因表达
不同浓度BITC和PEITC分化培养的ESC,用0.25%胰蛋白酶/EDTA消化成单细胞悬液,磷酸盐缓冲液 0.1 mol·L-1清洗 2 遍后,采用 Trizol试剂盒提取 ESC总 RNA,并用紫外分光光度计,选择A260/280检测以确定RNA浓度与质量。取1μg RNA逆转录合成cDNA,基因PCR产物经1%琼脂糖凝胶电泳,以DL1500作为核酸相对分子质量标志,紫外灯下观察结果并照像。心肌分化特异基因肌球蛋白重链(myosin heavy chain,MHC)引物为 反向:5'-ACCTGTCCAAGTTCCGCAAG-3',正向:5'-CTTGTTGACCTGGGACTCGG-3';心肌分化特异巢蛋白基因引物为反向:5'-CTCGAGCAGGAAGTGGTAGG-3',正向:5'-TTGGGACCAGGGACTGTTAG-3';内对照基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因引物为反向:5'-GCACAGTCAAGGCCGAGAAT-3', 正 向:5'-ACGTCAGATCCACGACGGAC-3'。ɑ/β-MHC、巢蛋白和GAPDH基因扩增退火温度分别为60℃、55℃和62℃,循环次数均为 34 次[7-8]。
1.8 苯甲基异硫氰酸盐和苯乙基异硫氰酸盐的发育毒性分析[5]
采用UVISoft UVIBand Application V97.04分析软件对上述分化获得的心肌细胞内MHC基因、神经细胞内巢蛋白基因扩增产物的凝胶电泳图像进行灰度分析,且以GAPDH为内对照基因,绘成浓度-反应曲线,计算BITC、PEITC对ESC体外定向分化抑制率为50%时的作用浓度,即半数抑制浓度ID50,其中对ESC体外心肌细胞定向分化半数抑制浓度以ID50(D3,MHC)表示,神经细胞定向分化半数抑制浓度以ID50(D3,巢蛋白)表示。
评价发育毒性计算公式为:公式Ⅰ=5.9157×lg〔IC50(3T3)〕+3.500 lg〔IC50(D3)〕- 5.307 ×〔IC50(3T3)- ID50(D3)〕/IC50(3T3)-15.72;公式Ⅱ =3.651×lg〔IC50(3T3)〕+2.394×lg〔IC50(D3)〕-2.033〔IC50(3T3)- ID50(D3)〕/IC50(3T3)-6.85;公 式 Ⅲ = -0.125×lg〔IC50(3T3)〕+1.917 × lg〔IC50(D3)〕+1.500〔IC50(3T3)-ID50(D3)〕/IC50(3T3)-2.67;且公式中均以mg·L-1为单位。IC50(D3)和 IC50(3T3)分别为D3和3T3细胞活性的半数抑制浓度;ID50(D3)为D3细胞体外定向分化为心肌细胞或神经细胞的定向分化半数抑制浓度。
评价发育毒性的判定标准为:上述结果中,Ⅰ>Ⅱ且Ⅰ>Ⅲ,则判定BITC和PEITC发育毒性为无发育毒性;如Ⅱ >Ⅰ且Ⅱ >Ⅲ,则判定 BITC和PEITC发育毒性为弱发育毒性;如Ⅲ>Ⅰ且Ⅲ>Ⅱ,则判定BITC和PEITC发育毒性为强发育毒性。
1.9 统计学分析
2 结果
2.1 苯甲基异硫氰酸盐和苯乙基异硫氰酸盐对细胞存活率的影响
由表1结果显示,BITC和PEITC作用1 0 d后,ESC D3和3T3细胞的存活率随着 BITC和PEITC浓度的增加而明显降低,并呈一定的浓度依赖性;当达到BITC和PEITC设计的最大毒性作用浓度14 μmol·L-1时,BITC 作用条件下 ESC D3和3T3细胞存活率分别仅为无BITC和PEITC作用条件下细胞活性的28%和12%,PEITC作用条件下为28%和15%,可见BITC和PEITC均具有一定的抑制细胞存活率作用,且上述两种细胞对BITC和PEITC细胞活性抑制作用的敏感性差别不大。依据浓度-反应曲线计算,BITC对ESC D3和3T3细胞存活率的IC50(D3)和 IC50(3T3)分别为1.23和0.95 mg·L-1,PEITC 相应的 IC50(D3)和 IC50(3T3)分别为 1.26 和 0.98 mg·L-1。
2.2 苯甲基异硫氰酸盐和苯乙基异硫氰酸盐抑制胚胎干细胞定向分化为心肌细胞的作用
由图1和表2可见,体外ESC经悬滴、悬浮培养诱导分化后可获得能够表达MHC基因的心肌样细胞,但随着BITC和PEITC作用浓度的增加,ESC定向分化为心肌细胞的能力逐渐降低。BITC和PEITC 2 μmol·L-1时,与 BITC 和 PEITC 0 μmol·L-1相比较,ESC定向分化为心肌细胞的分化率分别为89%和92%;当 BITC 和 PEITC 8 μmol·L-1,ESC 分化为心肌细胞的分化率降至83%和84%。依据浓度-反应曲线计算,BITC和PEITC抑制50%ESC定向分化为心肌细胞的 ID50(D3,MHC)分别为3.56和 3.48 mg·L-1。
2.3 苯甲基异硫氰酸盐和苯乙基异硫氰酸盐抑制胚胎干细胞定向分化为神经细胞的作用
图2 RT-PCR检测结果表明,ESC体外悬滴、悬浮培养后,经视黄酸0.5 μmol·L-1诱导分化获得一定数目可表达特异性巢蛋白基因的神经样细胞。由表3可见,随着BITC和PEITC作用浓度的增加,ESC神经定向分化获得具有表达巢蛋白基因的神经样细胞的能力均受到抑制,且抑制作用随BITC和PEITC作用浓度的增加而增强;BITC和PEITC 2 μmol·L-1与 BITC 和 PEITC 0 μmol·L-1相比较,ESC定向分化为神经细胞的分化率为92%和87%;BITC和PEITC为8 μmol·L-1时,ESC定向分化为神经细胞的分化效率仅为81%和74%。依据浓度-反应曲线计算,BITC和PEITC抑制50%ESC定向分化为神经细胞的ID50(D3,巢蛋白)分别为3.87和2.43 mg·L-1。
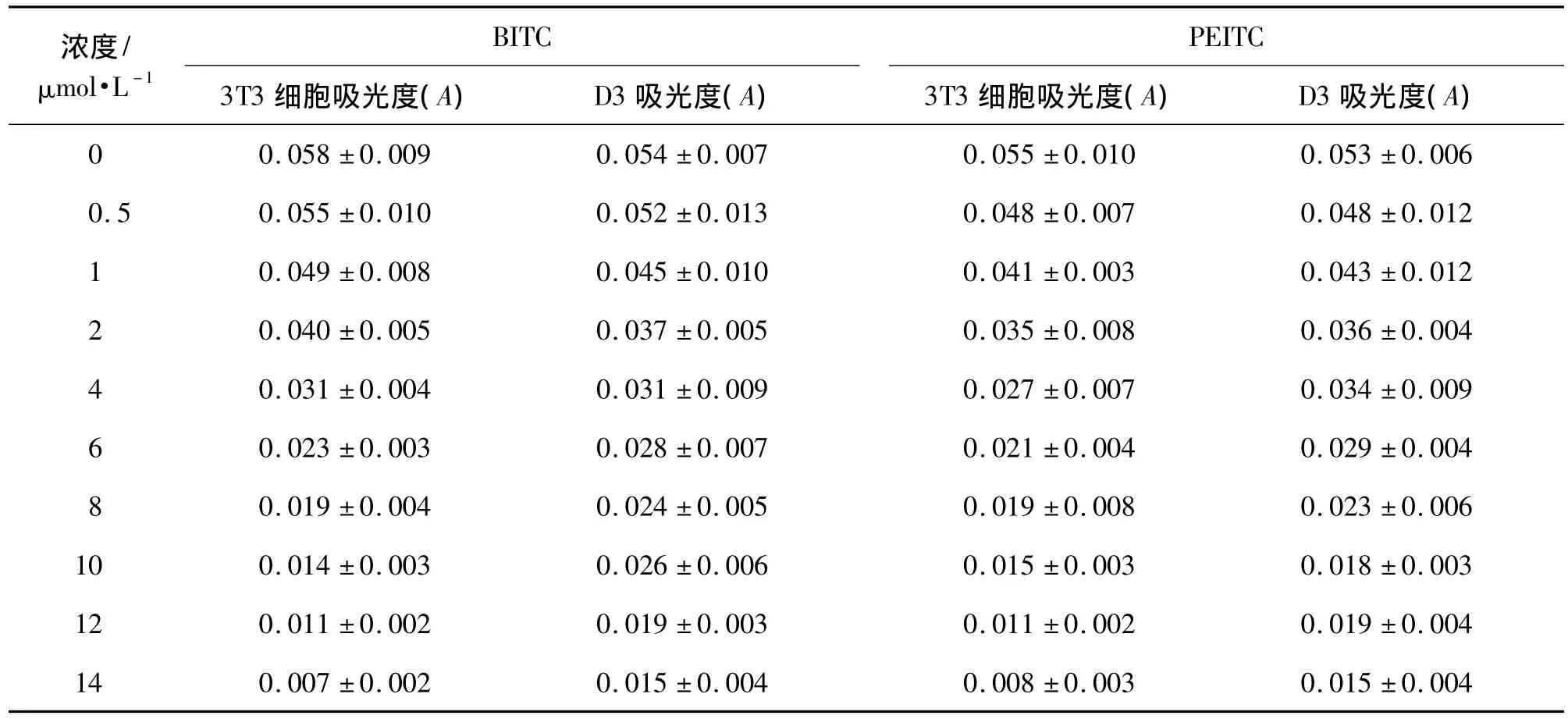
表1 苯甲基异硫氰酸盐(BITC)和苯乙基异硫氰酸盐(PEITC)对胚胎干细胞和BALB/C(3T3)细胞存活率的影响Tab.1 Effect of benzyl isothiocyanate(BITC)and phenethyl isothiocyanate(PEITC)on embryonic stem cells and BALB/C(3T3)cells survival
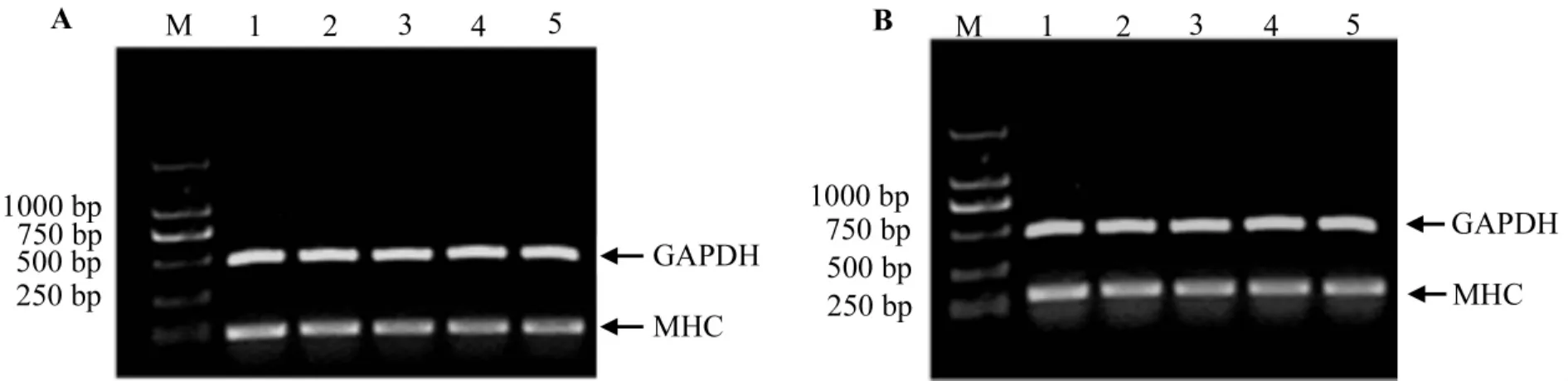
图1 BITC(A)和PEITC(B)对胚胎干细胞体外定向分化获得表达肌球蛋白重链(MHC)基因的心肌细胞能力的影响.将BITC和PEITC加入胚胎干细胞分化培养基中,经悬滴、悬浮诱导培养10 d后,采用逆转录聚合酶链反应法法检测分化获得的细胞内心肌细胞特异肌球蛋白重链(MHC)基因和管家基因甘油醛-3-磷酸脱氢酶(GAPDH)的表达,图中M:DNA标志,条带1~5:分别为BITC和PEITC 0,1,2,4 和8 μmol·L-1.Fig.1 Effect of BITC and PEITC on the embryonic stem cells differentation into cardiomyocyte cells with myosin heavy chain expression.

表2 BITC和PEITC对胚胎干细胞定向分化为心肌细胞能力的影响Tab.2 Effect of BITC and PEITC on the embryonic stem cells differentation into cardiomyocyte cells
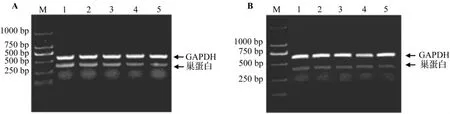
图2 BITC(A)和PEITC(B)对胚胎干细胞体外定向分化获得特异表达巢蛋白基因的神经细胞能力的影响.悬滴、悬浮培养4 d后,将BITC和PEITC加入胚胎干细胞分化培养基中,同时加入视黄酸再神经定向分化诱导培养4 d,收集细胞后采用逆转录聚合酶链反应法检测分化获得的细胞内神经细胞特异巢蛋白基因和管家基因甘油醛-3-磷酸脱氢酶(GAPDH)的表达.M:DNA标志,条带1~5:BITC和PEITC 0,1,2,4 和8 μmol·L-1.Fig.2 Effect of BITC and PEITC on the embryonic stem cells differentation into neuron cells with nestin expression.
2.4 苯甲基异硫氰酸盐和苯乙基异硫氰酸盐的发育毒性
由表4可见,分别将BITC和PEITC相对应的ID50(D3,MHC)、ID50(D3,巢蛋白)和 IC50(D3)、IC50(3T3)值,按照材料和方法1.8项下发育毒性公式计算,BITC和PEITC心肌发育毒性公式Ⅰ>Ⅱ,同时Ⅰ>Ⅲ,判定BITC和PEITC均无心肌发育毒性,BITC的神经发育毒性公式Ⅰ>Ⅱ,同时Ⅰ>Ⅲ,所以判定BITC无神经发育毒性。PEITC的神经发育毒性公式Ⅱ>Ⅰ,同时Ⅱ>Ⅲ,依据发育毒性评价标准,判定BITC神经发育弱毒性。
3 讨论
ESC是从早期胚胎内细胞团(inner cell mass)中分离出来的具有多向分化潜能的细胞系,它在体外既可维持不分化而无限增殖,又能参与胚胎发育分化为各种类型细胞和组织而形成器官,因此被称为多(潜)能性细胞[9]。ESC在适当的体外培养条件下能形成一种称为胚体的结构,分化出多种细胞谱系,包括原始外胚层、脏层和壁层内胚层以及早期中胚层,并产生各种细胞类型如心肌细胞、肌细胞、神经细胞、软骨细胞以及血管平滑肌细胞。由于缺乏空间调控信号,胚胎干细胞不能完成各组织的形态发育,但能在细胞核分子水平重演胚胎发育过程,并且在胚体分化过程中,早期胚胎发育的标志基因按一定的顺序先后表达,同时各组织的特异性基因的表达的顺序也很好地重演了体内胚胎发育的基因表达模式[3]。因此,胚胎干细胞时间依赖的分化过程为哺乳动物的发育生物学和发育毒理学等方面的研究提供一个非常有价值的体外实验模型基础,通过BITC和PEITC对ESC发育过程影响的检测,可以对BITC和PEITC是否具有发育毒性做出比较正确的判断,提高检测的准确度[10]。
在无诱导剂的作用条件下,胚胎干细胞通过体外悬浮、悬滴培养后具有一定的分化为心肌细胞的能力,而具有发育毒性的BITC和PEITC可抑制其这种分化能力[9]。因此将BITC和PEITC分别以不同的浓度作用于胚胎干细胞的心肌分化过程,采用RT-PCR和半定量灰度检测方法对结果进行分析。结果可见,随着BITC和PEITC作用浓度的增加,胚胎干细胞向心肌细胞分化的能力降低,呈一定的剂量-反应关系,ID50(D3,MHC)依次为 3.56 和 3.87 mg·L-1;同时结合BITC和PEITC相应的抑制细胞活性的分析结果 IC50(3T3)和IC50(D3),根据欧洲替代方法验证中心(theEuropeanCenterfortheValidationof Alternative Methods,ECVAM)提供的判定方法和标准,BITC和PEITC的心肌发育毒性评价结论均为无心肌发育毒性。
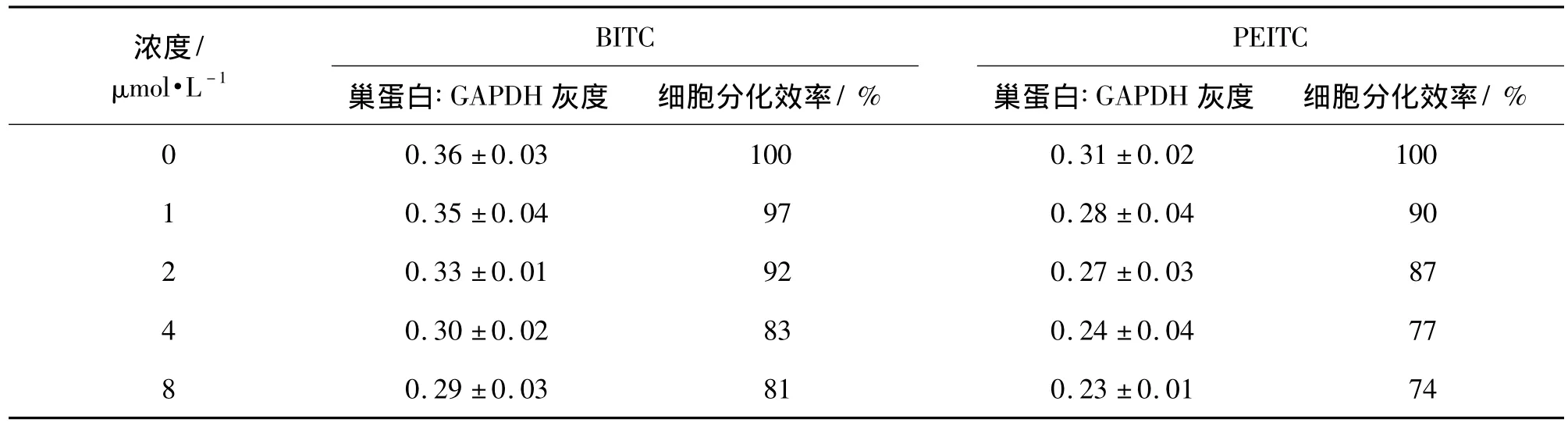
表3 BITC和PEITC对胚胎干细胞定向分化为神经细胞能力的影响Tab.3 Effect of BITC and PEITC on the embryonic stem cells differentation into neuron cells
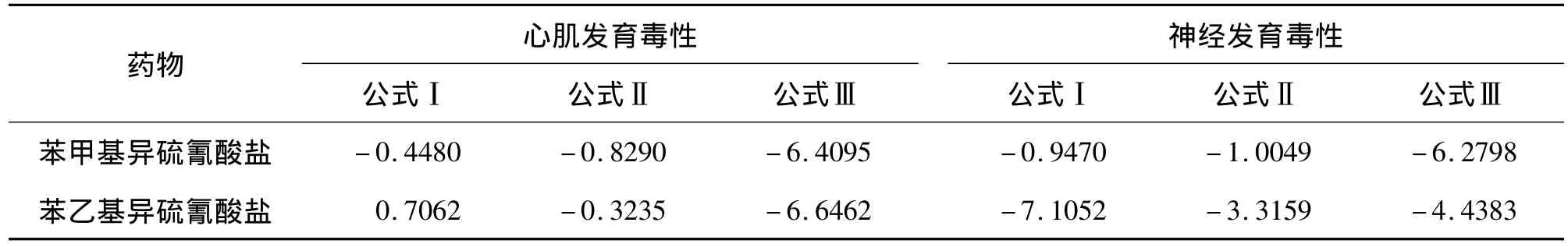
表4 BITC和PEITC发育毒性评价Tab.4 The developmental toxicity evaluation of BITC and PEITC
选择ESC向心肌细胞分化作为判断发育毒性的终点之一,可以建立和评价ITC基于心肌分化模型的发育毒性,这一点对于评价多数化合物发育毒性,尤其是心脏发育毒性/畸形是有效的。但是对于那些不能作用于早期心脏发育而特异性地抑制其他组织,如神经系统发育的致畸物,这一模型检测灵敏度低且不能涵盖所有发育毒性的作用特点,同时对于BITC和PEITC抑制神经系统发育的的机制及分化后可能的神经细胞特性的改变也未给予评价,需要通过建立和完善新的发育模型给予重视和研究[11]。因此,本研究中利用经视黄酸诱导法建立的胚胎干细胞神经发育毒性评价模型,有助于进一步评价ITC可能的神经发育毒性作用。
在胚胎干细胞神经发育毒性评价模型中,同样采用RT-PCR和半定量灰度检测方法对神经细胞特异性巢蛋白基因表达的结果进行分析。结果显示,随着上述BITC和PEITC作用浓度的增加,胚胎干细胞定向分化为神经细胞的能力降低,并呈一定的剂量-反应关系,ID50(D3)巢蛋白分别为 3.48 mg·L-1和2.43 mg·L-1,结合上述的3T3、D3 细胞抑制分析的结果,同样依据ECVAM的公式计算分析,判定BITC为无神经发育毒性物,PEITC为弱神经发育毒性物。上述模型评价结果的差异提示,在胚胎干细胞不同的定向分化过程中,其所涉及相关的分化控制基因和信号通路不尽相同,即胚胎干细胞必需接受不同的信号从而向不同方向分化[12]。因此,BITC和PEITC对ESC定向分化过程中的影响,局限于相应特定的基因表达调控和信号通路,这一研究结果有利于发现和解释BITC和PEITC特异的发育毒性靶器官及其毒性作用特点。
目前,BITC和PEITC的一般毒性、遗传毒性和致癌性的作用已有报道[13-14],但对于其发育毒性,尤其是神经发育毒性仍未见相关的研究。本研究结果提示,PEITC具有弱神经发育毒性,需要在ITC的利用过程中对其特殊发育毒性作用给予关注,并对其可能的作用机制进一步研究。
[1]Spitz MR,Duphorne CM,Detry MA,Pillow PC,Amos CI,Lei L,et al.Dietary intake of isothiocyanates:evidence of a joint effect with glutathione S-transferase polymorphisms in lung cancer risk[J].Cancer Epidemiol Biomarkers Prev,2000,9(10):1017-1020.
[2]Adebiyi A, Adaikan PG, Prasad RN. Pregnancy outcomes following pre-and post-implantation exposure of Sprague-Dawley rats to benzyl isothiocyanate[J].Food Chem Toxicol,2004,42(5):715-220.
[3]Balls M,Hellsten E.Statement of the scientific validity of the embryonic stem cell test(EST)-an in vitro test for embryotoxicity[J].Altern Lab Anim,2002,30(3):265-268.
[4]Guan K,Chang H,Rolletschek A,Wobus AM.Embryonic stem cell-derived neurogenesis.Retinoic acid induction and lineage selection of neuronal cells[J].Cell Tissue Res,2001,305(2):171-176.
[5]Bremer S,Hartung T.The use of embryonic stem cells for regulatory developmental toxicity testing in vitro-the current status of test development[J].Curr Pharm Des,2004,10(22):2733-2747.
[6]Kassie F,Knasmüller S.Genotoxic effects of allyl isothiocyanate(AITC)and phenethyl isothiocyanate(PEITC)[J].Chem Biol Interact,2000,127(2):163-180.
[7]于 洲,严卫星,张连峰,徐海滨.应用胚胎干细胞实验模型对人参皂甙Rbl、Rg1发育毒性的初步研究[J].毒理学杂志,2008,22(3):173-176.
[8]章淑芳,章恩明,郑筱祥.胚体培养对小鼠ES细胞定向神经分化的影响研究[J].生物医学工程学杂志,2006,23(3):620-624.
[9]Schwengberg S, Bohlen H, Kleinsasser N, Kehe K,Seiss M,Walther UI,et al.In vitro embryotoxicity assessment with dental restorative materials[J].J Dent,2005,33(1):49-55.
[10]Piersma AH.Validation of alternative methods for developmental toxicity testing[J].Toxicol Lett,2004,149(1-3):147-153.
[11]Rolletschek A,Blyszczuk P,Wobus AM.Embryonic stem cell-derived cardiac,neuronal and pancreatic cells as model systems to study toxicological effects[J].Toxicol Lett,2004,149(1-3):361-369.
[12]Bremer S,Pellizzer C,Coecke S,Paparella M,Catalani P.Detection of the embryotoxic potential of cyclophosphamide by using a combined system of metabolic competent cells and embryonic stem cells[J].Altern Lab Anim,2002,30(1):77-85.
[13]Keum YS, Jeong WS, Kong AN. Chemopreventive functions of isothiocyanates[J].Drug News Perspect,2005,18(7):445-451.
[14]Murata M,Yamashita N,Inoue S,Kawanishi S.Mechanism of oxidative DNA damage induced by carcinogenic allyl isothiocyanate[J].Free Radic Biol Med,2000,28(5):797-805.
