α-Fe2O3空心球的水热法制备及其对苯酚的吸附性能
2010-11-09袁晓卫于丽丽
袁晓卫 杨 骞 刘 琦*,, 于丽丽 陈 群 徐 正
(1江苏工业学院化学化工学院,江苏省精细石油化工重点实验室,常州 213164)
(2南京大学配位化学国家重点实验室,南京 210093)
α-Fe2O3空心球的水热法制备及其对苯酚的吸附性能
袁晓卫1杨 骞1刘 琦*,1,2于丽丽1陈 群1徐 正2
(1江苏工业学院化学化工学院,江苏省精细石油化工重点实验室,常州 213164)
(2南京大学配位化学国家重点实验室,南京 210093)
以铁氰化钾、磷酸二氢铵等为反应物,采用水热法合成了α-Fe2O3空心球,并用XRD,TEM,FESEM(场发射扫描电镜)、UVVis和低温氮吸附脱附对其进行了表征。结果表明,α-Fe2O3空心球直径在200~560 nm之间,其BET比表面积为80 m2·g-1,平均孔径为8.5 nm。考察了反应时间、反应物用量和反应温度等对α-Fe2O3空心球形貌和大小的影响,提出了其可能的形成机理。研究了室温下α-Fe2O3空心球吸附苯酚的性能,吸附达平衡时,其吸附苯酚的量达97 mg·g-1。
氧化铁空心球;纳米材料;吸附
空心球纳米结构材料具有较低的密度和较高的表面积等独特的性质,在催化、低密度结构材料、药物载体、化学传感器和电极材料等许多领域都有潜在的应用价值[1],有关这类材料的制备和性能研究是目前纳米材料研究的一个热点领域,其中金属、金属氧化物空心球的制备尤其受到人们的关注。制备空心球纳米结构材料,一般来说,有两条途径。一条途径是基于利用各种可移去的模板来制备空心球结构材料,这样的模板包括硬模板和软模板,如聚合物微球[2]、二氧化硅纳微米级小球[3-4]、微胶束液滴[5]、液晶[6]、表面活性剂囊泡[7]、聚合物胶束[9]、功能表面活性剂胶束[12]、金属纳米粒子[13]等,比如刘琦等[12]利用水热处理Ni(DS)2和NaH2PO2的碱性溶液制备了纳米/微米级的镍空心球。另一条途径是利用一些物理现象,比如Kirkendall效应或Ostwald陈化[14-17],来制备空心球纳米结构材料,比如,Alivisatos和其合作者[14]利用Kirkendall效应合成了氧化钴空心纳米晶。利用温和的水热过程[18-19],γ-辐射[20],超声波法[21]也可以制备空心球纳米结构材料。α-Fe2O3是一种n型半导体材料,常温下能隙E=2.2 eV,在催化剂[22]、颜料、光电极[23]和传感器[24]方面有广泛的应用。基于氧化铁的性能和应用,人们合成了各种形状的氧化铁纳米粒子,例如球型,立方体,椭球,纺锤型,圆盘型,六角型和花形等[25]。由于氧化铁空心纳米结构材料在催化、医药载体、锂离子电池和水处理等许多领域上都有潜在的应用,有关它的合成也引起了人们关注[26-30]。Thomas等[26]利用金属盐和碳氢化合物为原料,经过锻烧等步骤,制备了氧化铁等各种金属氧化物空心球;Chen等[27]利用二甲苯作溶剂,制备了针形的空心氧化铁;最近,Chu等[17]采用十六烷基三甲基溴化铵(CTAB)辅助的水热法制备了氧化铁空心球;而Tang等[28]采用水热法合成了针形和球形的空心氧化铁。但开发合成步骤简便、成本低、产率高的制备Fe2O3空心球的新方法,仍然很有价值。本文利用铁氰化钾等为原料,采用水热法高产率制备了球壳具有介孔结构的α-Fe2O3空心球,并研究了其吸附苯酚的性能。
1 实验部分
1.1 试剂和仪器
样品的XRD采用日本理学D/Max2500PC型X-射线衍射仪测定,Cu Kα(经 Kα2剥离处理,λ= 0.154056 nm),石墨单色器滤波,功率:40 kV×100 mA,扫描范围20°~80°,闪烁计数器记录X射线的强度;样品的透射电镜图利用荷兰PHILIPS-FEI公司TECNAI-12透射电子显微镜测定,加速电压120 kV;样品的扫描电镜图及能谱图利用日本日立公司 S-4800扫描电子显微镜测定,加速电压15 kV;样品的N2吸附-脱附等温线和相应的孔径分布图是在Micromeritics公司ASAP2010C表面孔径吸附仪上记录。样品的紫外-可见光谱图在UV-2501PC紫外-可见光谱仪上记录。实验中所用的试剂及溶剂均为国产分析纯,使用前未经纯化。
1.2 Fe2O3空心球的制备
氧化铁空心球的典型制备:将铁氰化钾(0.375 g),无水硫酸钠(0.081 g)和十六烷基三甲基溴化铵(CTAB)(0.02 g)依次加入到内衬聚四氟乙烯的高压釜(容积为50 mL)中,再加入0.01 mol·L-1的磷酸二氢铵溶液40 mL,在室温下搅拌使之完全溶解,待溶液为橙黄色透明溶液时,将高压釜密封,放入烘箱,在180℃恒温8 h后,让其自然冷却至室温。将样品放在离心管中在12 000 r·min-1下离心分离3 min,分离出洋红色沉淀,依次用去离子水、无水乙醇洗涤数次,60℃干燥6 h,得到0.084 g洋红色粉体,产率92%。改变温度、反应时间等条件下的合成参照上述方案。
1.3 吸附实验
称取10 mg苯酚,放入250 mL烧杯中,用适量去离子水溶解后,按定量分析要求配成浓度为100 mg·L-1苯酚水溶液,用精密pH试纸测苯酚水溶液显酸性,然后配制0.10 mol·L-1的NaOH溶液,用其调节苯酚溶液pH值,使其pH=8。然后加0.1 g氧化铁空心球于该溶液中。进行苯酚的吸附实验时,在整个过程中要保持不断的搅拌。在实验过程中,定时将一定量的溶液取出,经离心机离心后取上层清液进行吸光度检测。
1.4 分析测试
样品检测在UV-2501PC紫外-可见光谱仪上进行。首先通过紫外-可见光谱仪在紫外和可见光区域对不同浓度苯酚溶液进行全程扫描,并绘出其紫外-可见吸收光谱曲线,如图1所示。由图1可以看出,苯酚的最大吸收波长为292 nm。然后在苯酚的最大吸收波长处测量各样品的吸光度。以C/C0随时间的变化来表示氧化铁空心球吸附苯酚的吸附率,其中:C/C0=A/A0,C,A分别为吸附某一时刻溶液的浓度和吸光度;C0,A0分别为初始浓度和吸光度。

图1 不同浓度苯酚溶液的紫外-可见吸收光谱Fig.1 UV-Vis spectra of phenol solution in different concentrations
2 结果与讨论
2.1 XRD分析
图2A是典型合成所得产物的XRD图,图中出现了α-Fe2O3的衍射峰,其峰位置和α-Fe2O3的标准图中相应的峰位置一致(PDF 86-0550),衍射峰的强度较弱,表明典型合成所得Fe2O3空心球产物结晶度不高;图2B为样品700℃煅烧5 h后的XRD图,图中的主要衍射峰与α-Fe2O3的标准图一致(PDF 86-0550),但还出现了归属于Fe2P的2个弱的衍射峰(PDF 89-3680)以及归属于FeP4的1个弱的衍射峰(PDF 79-0486),表明产物中还有少量 Fe2P和FeP4。峰形尖而窄,表明煅烧后,产物的晶粒的粒径增大,依据Scherrer公式计算所得晶粒的平均粒径为31.4 nm。
2.2 Fe2O3的TEM和SEM分析

图2 典型合成所得Fe2O3空心球(A)和700℃煅烧后的产物(B)的XRD图Fig.2 XRD patterns of typical synthetic Fe2O3hollow spheres(A)andtheproductcalcinedat700℃(B)
图3A,B是典型合成所得产物的TEM图,从图3A中可以看出,颗粒颜色中间较浅,边缘加深,表明粒子具有空心结构,且球壳的表面比较粗糙。从图3B还可以看到破的α-Fe2O3空心球,进一步说明α-Fe2O3粒子具有空心结构。产物中还有一些花生状的空心结构,可能是由于相邻的球长大到一定尺寸后碰在一起,最后共同生长而成。α-Fe2O3空心球粒径分布在200~560 nm范围内,平均粒径为380 nm,平均壳厚为50 nm。从图3C可知,α-Fe2O3空心球是由更小的纳米粒子聚集而成,这些纳米粒子的大小在2~10 nm之间。从扫描电镜图(图3D)可以明显看到破的 α-Fe2O3空心球,这进一步说明产物是由 α-Fe2O3空心球组成。从产物的能谱图(EDS)可以看出(图3E),产物含有大量的Fe、O元素,以及少量的P、K、C元素,结合XRD图的分析可知,Fe、O元素来自产物中的主要成分α-Fe2O3,P元素来自产物中的少量的Fe2P和FeP4,C元素来自做扫描电镜时用的铜网上的碳膜及吸附的表面活性剂(CTAB),K元素的存在,表明产物还吸附了少量的钾离子。

图3 (A,B)典型合成所得Fe2O3空心球的TEM图;(C)单个Fe2O3空心球的TEM图;(D)典型合成所得Fe2O3空心球的SEM图;(E)产物的EDS图Fig.3 (A,B)TEM of of Fe2O3hollow spheres;(C)TEM of a single Fe2O3hollow sphere;(D)SEM of Fe2O3hollow spheres;(E)EDS spectrum of Fe2O3hollow spheres
2.3 Fe2O3的紫外-可见光谱
室温下,将一定量所制备的α-Fe2O3空心球样品超声分散在无水乙醇中,测得样品的紫外-可见吸收光谱如图4所示。从图4可知,所制备的α-Fe2O3空心球样品在波长569 nm处显示很好的激子吸收,与体相材料的激子吸收峰相比产生了红移[31]。由于半导体纳米微粒的吸收带隙主要受到电子-空穴量子限域性、电子-库仑相互作用能和介电效应引起的表面极化能的影响。样品的吸收峰红移说明库仑作用能和表面极化能大于量子尺寸效应的影响[32]。

图4 Fe2O3空心球的紫外-可见吸收光谱Fig.4 UV-Vis spectra of Fe2O3hollow spheres
2.4 Fe2O3空心球的比表面积
图5显示的是α-Fe2O3空心球的孔径分布图和相应的N2吸附-脱附等温线。吸附-脱附等温线属于第Ⅲ类型。该α-Fe2O3空心球的BET比表面积为80 m2·g-1,孔径在3.2,10.8和16.8 nm出现3个峰值,平均孔径为8.5 nm,这说明空心球壳具有介孔结构,也表明α-Fe2O3空心球是由小的纳米粒子构成。与市售的粒径为0.2 μm的Fe2O3的比表面积(3 m2·g-1)相比,用水热法制备的α-Fe2O3空心球的比表面积较大。

图5 Fe2O3空心球的孔径分布图和相应的氮气吸附-脱附等温线(插图)Fig.5 Pore size distribution and the corresponding nitrogen adsorption-desorption isotherm(inset) of Fe2O3hollow spheres
2.5 影响Fe2O3空心球形貌和大小的因素
在合成Fe2O3的反应中,反应物的用量、反应时间、温度是几个重要的反应条件,以下就这几个方面对产物的形貌和大小的影响进行讨论。
2.5.1 反应时间的影响
图6A,B,C,D分别是反应时间为1,2,4和12 h,其他反应条件与典型合成Fe2O3空心球相同时的TEM图。随着反应时间的增加,其形状大小有所变化。当反应时间为1 h时,产物主要由Fe2O3实心粒子构成的。当反应时间增加到2 h时,产物由α-Fe2O3空心球构成,其粒径范围主要在125~190 nm之间。当反应时间分别增加到4,12 h时,产物也都是由α-Fe2O3空心球组成,但粒径范围分别在220~380 nm和200~575 nm之间,而反应时间为8 h时,所得α-Fe2O3空心球的粒径范围主要在200~560 nm之间(见图3),从上面的实验结果来看,反应时间达到8 h后,α-Fe2O3空心球的粒径范围变化不大。
2.5.2 反应温度的影响

图6 不同反应时间所得Fe2O3的TEM图Fig.6 TEM images of Fe2O3with different reaction times

图7 不同反应温度制得的Fe2O3粒子的TEM图Fig.7 TEM images of Fe2O3particles prepared with different temperatures
图7显示了不同的反应温度对Fe2O3空心球形貌和大小的影响。当反应温度降低到160℃时,产物主要还是α-Fe2O3空心球,粒径分布集中在200~260 nm之间(图7A);当反应温度升高到200℃时,α-Fe2O3空心球粒径分布集中在200~376 nm之间(图7B);都有团聚现象。
2.5.3 K3Fe(CN)6用量的影响
图8A和8B是K3Fe(CN)6用量分别为0.187 5和0.375 g,其他反应条件和典型合成α-Fe2O3空心球相同时所得α-Fe2O3的TEM图。从图8A可以看出,K3Fe(CN)6用量减少一半时,产物是小的Fe2O3粒子聚集成的实心粒子构成。当K3Fe(CN)6用量增大一倍时,产物是α-Fe2O3空心球,其粒径在220~420 nm之间(图8B)。K3Fe(CN)6用量减少,意味着[Fe(CN)6]3-离子离解产生的α-Fe2O3纳米粒子数量少,α-Fe2O3纳米粒子易聚集成的空隙少的纳米结构,内部空隙少则不易转化形成空心球结构 (见下面的形成机理部分)。
2.5.4 NH4H2PO4用量的影响
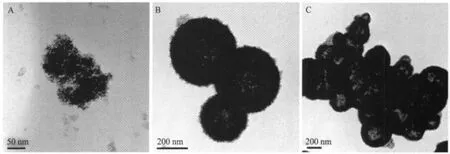
图8 不同K3Fe(CN)6用量制得的Fe2O3粒子的TEM图Fig.8 TEM images of Fe2O3particles prepared with different amounts of K3Fe(CN)6

图9 用不同浓度的NH4H2PO4制得的Fe2O3粒子的TEM图Fig.9 TEM images of Fe2O3particles prepared with different concentrations of NH4H2PO4
图9A,B是NH4H2PO4的浓度分别为0.005和0.02 mol·L-1,其他反应条件和典型合成相同时所得的Fe2O3的TEM图。当NH4H2PO4的浓度减少到0.005 mol·L-1时,产物中既有实心粒子也有齿轮状的粒子(图 9A)。当 NH4H2PO4的浓度增大到0.02 mol·L-1时,产物还是由α-Fe2O3空心球构成,其粒径集中在270~360 nm之间(图9B)。NH4H2PO4的浓度增加,溶液的酸度增加,[Fe(CN)6]3-离子的离解度增加,从上面的实验结果来看,[Fe(CN)6]3-离子的离解度增加有利于Fe2O3空心球的形成,这也意味着NH4H2PO4在α-Fe2O3空心球的形成中起了重要的作用。
2.5.5 CTAB用量的影响
图 10A、B和 C是十六烷基三甲基溴化铵(CTAB)用量分别为0.01,0.04 g和不加CTAB,其他反应条件和典型合成相同时所得Fe2O3的TEM图。当CTAB用量为0.01 g时,产物由α-Fe2O3空心球构成,但团聚严重(图10A);当CTAB用量为0.04 g时,产物由分散较均匀的α-Fe2O3空心球构成 (图10B);当不加CTAB时,产物由不规则的空心结构粒子构成,且团聚明显(图10C)。这些结果说明CTAB主要是起了防止空心球团聚的作用。

图10 不同CTAB用量制得的Fe2O3粒子的TEM图Fig.10 TEM images of Fe2O3particles prepared with different amounts of CTAB
2.6 Fe2O3空心球的可能形成机理
依据上述实验事实,我们推测α-Fe2O3空心球的形成过程可能涉及如下步骤:首先,[Fe(CN)6]3-缓慢地离解出铁离子;然后,铁离子与水作用形成FeOOH或Fe(OH)3,形成聚集体的FeOOH受热开始分解为H2O和Fe2O3[33]。由于聚集颗粒为纳米粒子,因此产生的聚集体内部为松散结构,存在许多空隙。当加热时间进一步延长,反应所产生的H2O会存在于聚集体内部空隙中。水热条件下,空隙中存在的H2O电离产生H+和OH-,其中H+促进了聚集体中的FeOOH和Fe2O3的溶解。该过程一方面使构成单个聚集体的分子趋向于有序排列,最终产生有序结构;另一方面使体系中产生了更多的空隙[30]。相关反应方程式如下:
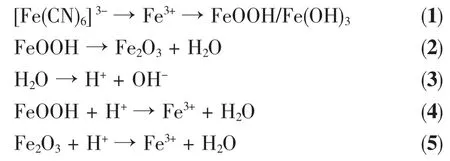
根据奥斯特瓦尔德熟化机制,在聚集体内的各个空隙处,小空隙处曲率半径小。其对应的Gibbs自由能相对高于曲率半径大的地方(即大空隙处),使小空隙周围物质溶解相对快,现象上表现为小空隙逐渐变大,不断和邻近空隙合并,变成较大空隙。如此往复,最终使聚集体变为中空结构。有关α-Fe2O3空心球的详细形成机理还有待于进一步的考察和研究。
2.7 Fe2O3空心球吸附苯酚的性能
我们选用苯酚作为本实验的研究对象,来考察α-Fe2O3空心球对有机污染物的吸附能力,是因为苯酚是污染水的有毒酚类物质中的一种。苯酚溶液的初始浓度为100 mg·L-1,pH=8。影响半导体材料光催化活性的因素较多,除了催化剂的用量、降解物的浓度等以外,还与催化剂的形貌有关。我们对自制的α-Fe2O3空心球及普通的实心 Fe2O3(平均粒径32 nm,按文献方法合成[34])进行的吸附苯酚的对比实验结果(见图11)也证实了这一结论。由图11知,不同形状的Fe2O3其吸附效果不同。图11为苯酚溶液浓度随吸附时间的变化图。图中的A曲线表示的是典型合成所得α-Fe2O3空心球的吸附曲线,从该曲线可知,随着吸附时间的增加,溶液中的苯酚浓度逐渐降低,直至300 min后苯酚浓度基本保持不变,α-Fe2O3空心球对苯酚的吸附量为97.3 mg·g-1。α-Fe2O3空心球对苯酚的吸附可能跟氧化铁空心球表面和苯酚之间的静电吸引作用有关。将使用过一次的α-Fe2O3空心球经过350℃煅烧2 h后重复使用(煅烧后的氧化铁粒子仍然为空心结构,见图12),所得的吸附曲线见图11B,再生的α-Fe2O3空心球对苯酚的吸附量达96.3 mg·g-1,在240 min后苯酚浓度基本保持不变。从曲线C可知,Fe2O3实心粒子对苯酚的吸附量达87.61 mg·g-1,在210 min后苯酚浓度基本保持不变。上述结果表明Fe2O3空心球吸附苯酚的性能优于实心Fe2O3粒子。

图11 Fe2O3空心球和350℃煅烧后的产物及实心粒子对苯酚的吸附曲线Fig.11 Phenol adsorption curve of Fe2O3hollow spheres, theproductcalcinedat350℃andtheFe2O3solid

图12 350℃煅烧后,Fe2O3空心球的TEM图(A)和SEM图(B)Fig.12 TEM(A)and SEM(B)of Fe2O3hollow spheres obtained after calcination at 350℃
3 结 论
我们利用铁氰化钾,磷酸二氢铵等作为反应物,以CTAB作表面活性剂,采用水热法高产率地合成了球壳具有介孔结构的α-Fe2O3空心球。Fe2O3空心球对苯酚具有良好的吸附性能。
[1](a)Hu Y,Jiang X Q,Ding Y,et al.Adv.Mater.,2004,16(11): 933-937
(b)Caruso F.Chem.Eur.J.,2000,6(3):413-419
[2](a)Caruso F,Caruso R A,Mhward H.Science,1998,282:1111 -1114
(b)Wang L,Sasaki T,Ebina Y,et al.Chem.Mater.,2002,14 (11):4827-4832
(c)Caruso F,Shi X,Caruso R A,et al.Adv.Mater.,2001,13 (10):740-744
(d)Radtechenko I L,Sukhorukov G B,Gaponik N,et al.Adv. Mater.,2001,13(22):1684-1687
[3]Kim S,Kim M,Lee W Y,et al.J.Am.Chem.Soc.,2002,124 (26):7642-7643
[4]Wang D,Caruso F.Chem.Mater.,2002,14(5):1909-1913
[5](a)Bao J C,Liang Y Y,Xu Z,et al.Adv.Mater.,2003,15 (21):1832-1835
(b)Walsh D,Lebeau B,Mann S.Adv.Mater.,1999,11(4):324 -328
[6]Braun P V,Stupp S I.Mater.Res.Bull.,1999,34(3):463-469
[7](a)Fowler C E,Khushalani D,Mann S.J.Mater.Chem.,2001, 11:1968-1971
(b)Fowler C E,Khushalani D,Mann S.Chem.Commun.,2001, 19:2028-2029
(c)Huang J,Xie Y,Li B,et al.Adv.Mater.,2000,12(11):808 -811
(d)Tartaj P,González-Carreo T,Serna C J.Adv.Mater., 2001,13(21):1620-1624
[8](a)Hubert D H W,Jung M,German A L.Adv.Mater.,2000, 12(17):1291-1294
(b)Schmidt H T,Ostafin A E.Adv.Mater.,2002,14(7):532 -532
[9]Liu T B,Xie Y,Benjamin Chu.Langmuir,2000,16(23):9015-9022
[10]Zhang D B,Qi L M,Ma J M,et al.Adv.Mater.,2002,14 (20):1499-1502
[11]Qi L M,Li J,Ma J M.Adv.Mater.,2002,14(4):300-303
[12]Liu Q,Liu H,Han M,et al.Adv.Mater.,2005,17(16):1995-1999
[13](a)Sun Y G,Xia Y N.Science,2002,298:2176-2179
(b)Sun Y G,Brian Mayers,Xia Y N.Adv.Mater.,2003,15: 641-646
[14]Yin Y D,Robert M R,Can K E,et al.Science,2004,304: 711-714
[15]Yang J H,Qi L M,Lu C H,et al.Angew.Chem.Int.Ed., 2005,44(4):598-603
[16]Liu B,Zeng H C.J.Am.Chem.Soc.,2004,126(51):16744-16746
[17]Li L L,Chu Y,Liu Y.J.Phys.Chem.C,2007,111(5):2123-2127
[18](a)Zhan J H,Lin H P,Mou C Y.Adv.Mater.,2003,15:621-623
(b)Chen D H,Chen D R,Jiao X L,et al.J.Chem.Mater., 2003,13:2266-2270
[19]Wang X,Li Y D.Angew.Chem.Int.Ed.,2003,42:3497-3500
[20]Hu Y,Chen J F,Chen W M,et al.Adv.Mater.,2003,15(9): 726-729
[21]Arul Dhas N,Kenneth S,Suslick.J.Am.Chem.Soc.,2005, 127:2368-2369
[22]Brown A S S,Hargreaves J S J,Rijniersce B.Catal.Lett., 1998,53:7-13
[23]Ohmori T,Takahashi H,Mametsuka H,et al.Phys.Chem. Chem.Phys.,2000,2:3519-3522
[24]Sun H T,Cantalini,C Faccio,et al.J.Am.Ceram.Soc., 1996,79:927-937
[25]Zhong L S,Hu J S,Liang H P,et al.Adv.Mater.,2006,18: 2426-2431
[26]Titirici M M,Antonietti M,Thomas A.Chem.Mater.,2006, 18:3808-3812
[27]Lu J,Chen D,Jiao X L.J.Colloid Interface Sci.,2006,303 (2):437-443
[28]Zeng S Y,Tang K B,Li T W,et al.J.Phys.Chem.C,2007, 111:10217-10225
[29]Lian S Y,Wang E B,Gao L,et al.Mater.Res.Bull.,2006, 41:1192-1198
[30]YU Hai-Yun(俞海云),CHEN Guo-Zhu(陈国柱),SUN Si-Xiu(孙思修),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2007,12(12):2116-2118
[31]Sherman D M,Waite T D.Am.Mineral,1985,70:1262-1269
[32]LI Dan-Zhen(李旦振),ZHEN Yi(郑 宜),FU Xian-Zhi (付贤智).Chinese J.Mater.Res.(Cailiao Yanjiu Xuebao), 2000,14:639-642
[33]Cao M,Liu T,Gao S,et al,Angew.Chem.Int.Ed.,2005, 44:2-6
[34]LU Jun(陆 俊),HE Yu-Zhou(何雨舟),GUO Yan-Hui (郭 艳 辉),et al.Zhejiang Chemical Industry(Zhejiang Huagong),2005,37(6):6-8
α-Fe2O3Hollow Spheres:Hydrothermal Synthesis and Phenol Adsorption Performance
YUAN Xiao-Wei1YANG Qian1LIU Qi*,1,2YU Li-Li1CHEN Qun1XU Zheng2
(1School of Chemistry and Chemical Engineering and Jiangsu Province Key Laboratory of Fine Petro-chemical Technology,Jiangsu Polytechnic University,Changzhou,Jiangsu213164)
(2The State Key Laboratory of Coordination Chemistry,Nanjing University,Nanjing210093)
Using potassium ferricyanide,NH4H2PO4as the reactants,α-Fe2O3hollow spheres were synthesized by a hydrothermal method.The samples were characterized by TEM,XRD,FESEM(field-emission scanning electron microscope),UV-Vis spectroscopy and low temperature nitrogen adsorption-desorption.The results show that the diameter of α-Fe2O3hollow spheres is 200~560 nm,and the BET surface area and the average diameter of pore is 80 m2·g-1and 8.5 nm,respectively.The effect of the reaction time,the amount of reactant and the reaction temperature on the morphology and size of α-Fe2O3hollow spheres was examined.The formation mechanism of the hollow spheres was proposed.The adsorption performance of α-Fe2O3hollow spheres to phenol was investigated at room temperature,and the capacity for phenol adsorption was 97 mg·g-1when the balance of adsorption was reached.
α-Fe2O3hollow spheres;nanomaterials;adsorption
O614.83+1;TB383
A
1001-4861(2010)02-0285-08
2009-08-12。收修改稿日期:2009-11-23。
国家自然科学基金(No.20671045,20971060);南京大学配位化学国家重点实验室自然科学基金和江苏省科技创新团队资助项目。*
。E-mail:liuqi62@163.com;Tel:0519-86330185;会员登记号:S060018987P。
袁晓卫,女,25岁,硕士研究生;研究方向:功能纳米材料。
猜你喜欢
杂志排行
无机化学学报的其它文章
- Synthesis and Crystal Structure of a Uranylcontaining Complex[U(CO3)3(H2O)2]·2H2O
- Synthesis,Crystal Structure and Antitumor Activity of a New Trinuclear Ni(Ⅱ)Complex Ni3(C14H8N3O5)2(C5H5N)4
- Synthesis,Crystal Structure and Luminescent Property of[CdCl(HL)(dpp)(H2O)]n·nH2O
- 一种新奇的d-f异双核配合物[Fe(phen)3]2[FeCe(tiron)3]·6H2O的水热合成、晶体结构和磁性
- Synthesis and Crystal Structure of a Two-Dimensional Hofmann-Type Bimetallic Complex Cu(DMF)2[Pt(CN)4]
- TiO2纳米管阵列薄膜制备及生长机理的研究
