锂离子电池负极材料Li4-xKxTi5O12结构和电化学性能
2010-11-09瞿美臻于作龙
李 星 瞿美臻 于作龙*,
(1中国科学院成都有机化学研究所,成都 610041)
(2中国科学院研究生院,北京 100049)
锂离子电池负极材料Li4-xKxTi5O12结构和电化学性能
李 星1,2瞿美臻1于作龙*,1
(1中国科学院成都有机化学研究所,成都 610041)
(2中国科学院研究生院,北京 100049)
采用固相反应的方法制备了尖晶石型Li4Ti5O12和K掺杂Li4-xKxTi5O12(x=0.02,0.04,0.06)。通过XRD、SEM、BET等对制备材料进行了分析。结果表明,K掺杂没有影响立方尖晶石型Li4Ti5O12的合成,同时也没有改变Li4Ti5O12的电化学反应过程。K掺杂Li4-xKxTi5O12具有比Li4Ti5O12小的颗粒粒径和比Li4Ti5O12大的比表面积、孔容积。适量的K掺杂能够明显改善Li4Ti5O12的电化学性能,尤其是倍率性能,但是过多的K掺杂却不利于材料电化学性能的提高。研究表明,Li3.96K0.04Ti5O12体现了相对较好的倍率性能和循环稳定性。0.5C下,首次放电比容量为161 mAh·g-1,3.0和5.0C下,容量保持分别为138和121 mAh·g-1。3.0C下,200次循环后容量保持为137 mAh·g-1。
锂离子电池;负极材料;尖晶石型钛酸锂;掺杂
作为一种新型锂离子电池负极材料,尖晶石型钛酸锂(Li4Ti5O12)[1-4]以其独特的性能特点引起了人们广泛关注,被认为可能取代目前商品化碳材料的负极材料之一。该材料具有较高电位(1.55 V vs Li),电极在工作过程中不与常用电解液溶剂反应,避免了电池在苛刻环境下(高温、低温、高倍率等)工作时带来的安全隐患[5]。另外,该材料为“零应变”电极材料,锂离子在其中嵌入和脱出过程中材料的晶体结构几乎不发生变化,理论上有无限长的循环寿命[6-7]。因此作为储能和动力锂离子电池负极材料有着很大的研究价值和商业应用前景。尽管如此,由于该材料属于绝缘体材料,电子导电性能差,大倍率环境下工作时容量衰减迅速,严重制约了其在生产生活中的应用。为了提高Li4Ti5O12的电子导电性,获得较好的倍率性能,研究人员做了大量工作,并且取得了显著成果。这些工作主要包括制备小粒径Li4Ti5O12[8-11];制备添加Ag、Cu、C等的 Li4Ti5O12复合物[12-15]和制备离子掺杂的 Li4Ti5O12[16-20]。 其中离子掺杂能提高Li4Ti5O12导电性能的原理是基于电荷补偿来实现的。研究发现,Li4Ti5O12的导电性随着Ti3+的含量增加而增加,因此通过适量的不等价离子如Mg2+、Al3+取代部分Li+的位置;Ta5+取代部分Ti4+的位置和Br-取代部分O2-的位置都能造成电荷补偿增加Ti3+的含量,从而提高Li4Ti5O12的导电性能。根据文献报道,离子掺杂的Li4Ti5O12往往具有较差的晶体结构,说明掺杂离子进入了晶胞中,造成晶格畸变。这个过程可能对Li4Ti5O12材料的颗粒大小和形貌造成了影响,而粒径大小是影响Li4Ti5O12电化学性能尤其是倍率性能的主要因素。这主要是因为小粒径能够缩短Li+的迁移路径,同时提高电极活性物质与电解液的接触面积,电极在大电流环境下工作时能够保证Li+在电极活性物质中快速嵌入和脱出,从而提高了电极材料的倍率性能[21-22]。因此,选择合适的掺杂离子,通过造成晶格畸变来制备小粒径Li4Ti5O12可能是提高其倍率性能的一条合适途径。目前,离子掺杂改善Li4Ti5O12导电性能的研究很多,但是研究的重点是电荷补偿,而关于掺杂离子对Li4Ti5O12材料颗粒大小影响的相关报道并不多。
本文考察了K+掺杂对Li4Ti5O12晶体结构、粒径大小、形貌和电化学性能的影响,并对产生上述影响的原因作了科学的解释和推测,希望能为同行提供一定的参考。选择K+掺杂的原因是其与Li+处于同一主族,直径比Li+稍大,可以较容易取代Li+的位置,造成晶格畸变;同时K+与Li+具有相同价态,可以避免由于不等价离子掺杂造成电荷补偿的干扰。作为比较,本文同时考察了纯相Li4Ti5O12的晶体结构、粒径大小和电化学性能。
1 实验部分
1.1 Li4Ti5O12和Li4-xKxTi5O12的制备
实验中用于制备纯相 Li4Ti5O12和 K+掺杂Li4-xKxTi5O12的原料 TiO2、CH3COOLi·2H2O和KOH均为分析纯。Li4Ti5O12和Li4-xKxTi5O12均采用固相反应制备。首先,把CH3COOLi·2H2O或CH3COOLi· 2H2O和KOH的混合物分别溶解在二次去离子水中,形成稳定的溶液。然后,按照化学计量比在上述溶液中分别加入粉体TiO2,磁力搅拌均匀后,90℃蒸馏至干,研磨,得到均匀混合的粉状前驱体。前驱体在800℃,空气氛围中煅烧12 h得到最终的产物 Li4Ti5O12和 Li4-xKxTi5O12。 其中,K的掺杂量在Li4-xKxTi5O12中所占的比例 x分别为 0.02、0.04和0.06。
1.2 电极片的制备、纽扣电池的组装及材料性能测试
电极混合物由活性物质 (Li4Ti5O12或 Li4-xKxTi5O12)、导电剂乙炔黑(AB)和粘结剂LA-132组成,三者在电极中所占的质量百分比为85∶10∶5。电极片的制备按照如下步骤进行。首先,把导电乙炔黑均匀分散在粘结剂LA-132中。然后,加入活性物质,搅拌均匀后得到三者均匀混合的浆料。浆料用医用刮刀均匀的涂布在铝箔上,烘干后打成直径约为1.2 cm的圆片。电极片上活性物质的质量为3.5 mg左右。上述电极片使用前在真空烘箱中烘烤16 h。纽扣电池由电极、隔膜和电解液组成。其中正极为上述制备的电极片,负极为金属锂片,隔膜为Celgard 2400,电解液为1 mol·L-1LiPF6的碳酸乙烯酯(EC)、碳酸二乙酯(DEC)和碳酸二甲酯(DMC),EC、DEC和DMC三者的体积比为1∶1∶1。纽扣电池的组装在充满氩气的干燥手套箱中进行。
采用X射线衍射(XRD)表征材料的晶体结构。XRD仪器为飞利浦X′Pert Pro MPD DY1219,Cu Kα作为衍射源。扫描电子显微镜(SEM)观察材料的粒径大小和形貌。SEM型号为FEI INSPECT-F。BET测试法表征材料的比表面积和孔容积。BET仪器型号为Builder SSA-4200。Solatron 1260交流阻抗仪测试电极片的阻抗值,测试频率范围为10-2~105Hz。循环伏安法的测试电压范围为1~3 V,扫描速率为0.2 mV·s-1,测试仪器型号为Arbin MSTAT4+。电池测试采用恒流充放电的方法,在25℃下进行,测试电压范围为1~3 V。
2 结果与讨论
2.1 样品XRD分析
图1为Li4Ti5O12样品和K掺杂Li4-xKxTi5O12(x= 0.02,0.04,0.06)样品的XRD图。样品测试过程中由于2θ偏移所带来的误差由Si内标校正。参照纯相尖晶石型Li4Ti5O12样品的标准XRD卡片 (PDF No. 26-1198),从图1中可以观察到,Li4Ti5O12样品与K掺杂Li4-xKxTi5O12样品具有几乎相同的相图且能与纯相尖晶石型Li4Ti5O12样品的标准XRD卡片很好吻合。说明两者皆属于立方尖晶石型Li4Ti5O12,K掺杂没有影响尖晶石型Li4Ti5O12的合成。另外,从图1中还可以观察到,K掺杂Li4-xKxTi5O12(x=0.02,0.04,0.06)样品的2θ有依次向低角度偏移的趋势。为显著起见,所有样品(111)晶面所对应的峰位置被放大,如图2所示。从图2中可以观察到,随着掺杂量的增加,K掺杂Li4-xKxTi5O12(x=0.02,0.04,0.06)样品的2θ向低角度偏移的趋势越来越显著。由布拉格方程:2dsinθ=nλ,可知d有逐渐增大的趋势。说明掺杂K已经进入尖晶石型Li4Ti5O12中Li的位置。因为K的离子半径(0.133 nm)比Li(0.060 nm)的大,所以导致晶面间距d的增大。同时,根据Rietveld方法计算出了 Li4Ti5O12样品和 K掺杂 Li4-xKxTi5O12(x= 0.02,0.04,0.06)样品的晶胞参数,如表1所示。从表1中可以看到,随着K掺杂量的增加,样品的晶胞参数逐渐增大。更进一步说明掺杂K进入了尖晶石型Li4Ti5O12的晶体结构中。
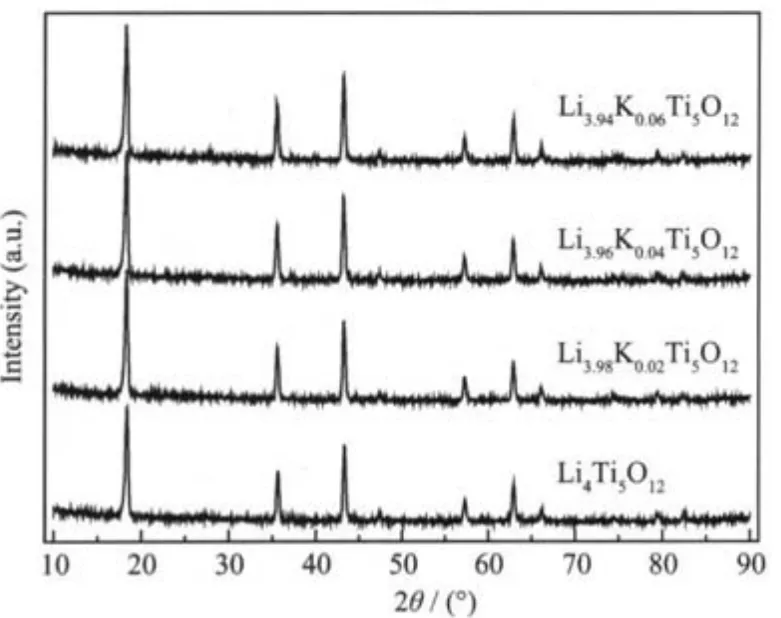
图1 样品Li4-xKxTi5O12(x=0,0.02,0.04,0.06)的XRD图Fig.1 X-ray diffraction patterns of synthesized Li4-xKxTi5O12(x=0,0.02,0.04,0.06)samples

图2 样品Li4-xKxTi5O12(x=0,0.02,0.04,0.06)的(111)晶面所对应峰位置的放大图Fig.2 Enlarged(111)peaks of synthesized Li4-xKxTi5O12 (x=0,0.02,0.04,0.06)samples

表1 样品Li4-xKxTi5O12(x=0,0.02,0.04,0.06)的晶胞参数Table 1 Lattice parameters of synthesized Li4-xKxTi5O12 (x=0,0.02,0.04,0.06)samples
2.2 样品SEM与BET分析

图3 样品Li4-xKxTi5O12(x=0,0.02,0.04,0.06)的SEM图Fig.3 SEM images of Li4-xKxTi5O12(x=0,0.02,0.04,0.06) samples
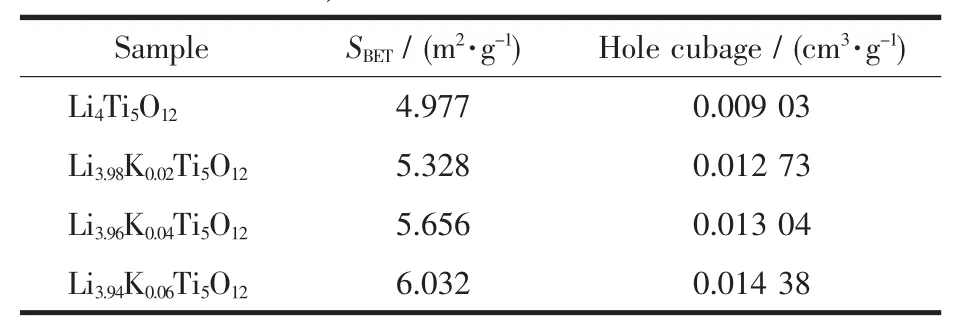
表2 样品Li4-xKxTi5O12(x=0,0.02,0.04,0.06)的BET面积和孔容积Table 2 BET surface area and hole cubage of synthesized Li4-xKxTi5O12(x=0,0.02,0.04, 0.06)
图3为Li4Ti5O12样品和K掺杂Li4-xKxTi5O12(x= 0.02,0.04,0.06)样品的SEM图谱。从图3中可以看到,K掺杂Li4-xKxTi5O12(x=0.02,0.04,0.06)样品的粒径明显小于没有K掺杂的Li4Ti5O12样品,且K掺杂样品的颗粒表面较之未掺杂样品的表面粗糙。Li4Ti5O12样品和 K掺杂 Li4-xKxTi5O12(x=0.02,0.04,0.06)样品的BET面积和孔容积如表2所示。从表2中可以看到,K掺杂Li4-xKxTi5O12(x=0.02,0.04,0.06)样品的比表面积和孔容积明显大于没有K掺杂的Li4Ti5O12样品,且样品的比表面积和孔容积随着K掺杂量的增加而增加。造成上述现象的原因可能是:掺杂的K进入到晶格结构中,造成晶格畸变;晶格畸变的产生阻碍了样品颗粒在热处理过程中的长大和团聚,因此导致K掺杂Li4-xKxTi5O12(x=0.02,0.04,0.06)样品的粒径明显小于没有 K掺杂的Li4Ti5O12样品、比表面积和孔容积明显大于没有K掺杂的Li4Ti5O12样品。另外,没有进入晶格结构中的K,在煅烧过程中会生成其相应的氧化物,该氧化物也可能会阻碍材料颗粒的长大和团聚。K的氧化物没有在XRD图中被检测出来可能是因为其含量较少的缘故。
2.3 交流阻抗(AC)分析

图4 Li4-xKxTi5O12(x=0,0.02,0.04,0.06)电极在1.55 V (vs Li+/Li)的交流阻抗谱图Fig.4 Ac impedance spectra of the Li4-xKxTi5O12(x=0, 0.02,0.04,0.06)electrodes at the voltage of 1.55 V(vs Li+/Li)
Li4Ti5O12电极和 K掺杂 Li4-xKxTi5O12(x=0.02,0.04,0.06)电极的阻抗谱图如图4所示。电极测试均在一个稳定的电位(1.55 V vs Li+/Li)下完成。从图4中可以观察到,所有阻抗谱图都由以下几个部分组成:高频区与实轴的交点,高频区半圆,中频区的半圆和低频区的直线组成。其中,高频区与实轴的交点所截取的阻值为欧姆阻值,包括电解液阻抗和电极阻抗;高频区半圆代表Li+在正极表面形成的SEI膜中的迁移过程;中频区半圆代表电荷传递过程;低频区的直线代表Li+在电极材料中的扩散阻抗,又叫韦伯阻抗[23]。为了获得相应的参数,在图4中引入了一个等效电路。其中,Rs代表电解液阻抗,Rct代表电子传递阻抗,CPE代表电双层电容,W代表韦伯阻抗。图4中实轴所对应的阻值Zre可由公式(1)表述。

其中,σw为韦伯阻抗系数,ω代表角频率。Zre与低频ω-0.5的函数关系如图5所示。从图5中可以看到Zre与低频ω-0.5近似成直线关系,直线的斜率为韦伯阻抗系数σw。将σw带入公式(2)可以求出Li+在电极材料中的扩散系数[24-25]。

其中,R为气体常数,T为绝对温度,A为电极片表面积,F为法拉第常数,C为Li+浓度。所得到的相关参数如表3所示。

图5 Li4-xKxTi5O12(x=0,0.02,0.04,0.06)电极实轴阻值与低频区的函数关系Fig.5 Relationship between real impedance with the low frequencies for the Li4-xKxTi5O12(x=0,0.02,0.04, 0.06)electrodes
从表3中可以看到,随着K掺杂量的增加,材料的电子导电性能和离子导电性能呈现先增加后减弱的趋势。其中Li3.96K0.04Ti5O12体现出最好的电子和离子导电性能。说明,当x=0.04时是最佳掺杂量。另外,从表3中还可以看到,当掺杂量为0.06时,材料的电子和离子导电性能反而不如未经过掺杂的Li4Ti5O12。说明,当K掺杂量过多时不利于材料电子和离子导电性能的提高。认为产生上述现象的原因是:K掺杂Li4-xKxTi5O12具有小的颗粒尺寸、大的比表面积和孔容积,缩短了Li+的迁移路径,增大了电极活性物质与电解液的接触面积,因此提高了材料的电子导电性能和离子导电性能。但是,由于K掺杂取代的是部分Li4Ti5O12中Li的位置,可能会阻碍电极在电化学过程中Li+的迁移,因此当K掺杂量较少时有利于材料电子导电性能和离子导电性能的提高,而当K掺杂量较多时反而不利于材料电子导电性能和离子导电性能的提高。

表3 Li4-xKxTi5O12(x=0,0.02,0.04,0.06)电极的阻抗参数Table 3 Impedance parameters of the Li4-xKxTi5O12(x=0,0.02,0.04,0.06)electrodes
2.4 循环伏安(CV)
Li4Ti5O12电极和 K掺杂 Li4-xKxTi5O12(x=0.02,0.04,0.06)电极的循环伏安谱图如图6所示。测试扫描速率为0.2 mV·s-1,扫描电压范围为1~3 V。从图6中可以看到,所有电极都表现出相似的氧化-还原峰,说明K的掺杂没有改变Li4Ti5O12材料的电化学反应过程。其中,Li3.98K0.02Ti5O12和Li3.96K0.04Ti5O12的氧化-还原峰较窄并且较尖锐,说明两电极具有较好的电子和离子导电性能。Li4Ti5O12和Li3.94K0.06Ti5O12的氧化-还原峰较宽并且较扁平,说明两电极具有相对较差的电子和离子导电性能。Li4-xKxTi5O12(x= 0,0.02,0.04,0.06)电极氧化峰-还原峰之间的电势差如表4所示。从表4中可以看到,以Li4Ti5O12电极氧化峰-还原峰之间的电势差作为参照,Li3.96K0.04Ti5O12表现出最小的氧化峰-还原峰电势差,而Li3.94K0.06Ti5O12表现出最大的氧化峰-还原峰电势差。说明,适量的K掺杂可以减小电极的极化,但是过多的掺杂反而不利于电极极化的减小。循环伏安法对样品测试所体现的趋势与交流阻抗法对样品测试所体现的趋势一致。

图6 Li4-xKxTi5O12(x=0,0.02,0.04,0.06)电极的循环伏安谱图Fig.6 Cyclic voltammograms of the Li4-xKxTi5O12(x=0, 0.02,0.04,0.06)electrodes

表4 Li4-xKxTi5O12(x=0,0.02,0.04,0.06)电极氧化-还原电位势差Table 4 Potential differences between anodic and cathodic peaks for the Li4-xKxTi5O12(x=0,0.02,0.04,0.06)electrodes
2.5 充放电性能研究
Li4Ti5O12电极和 K掺杂 Li4-xKxTi5O12(x=0.02,0.04,0.06)电极在不同倍率下的循环性能如图7所示。从图中可以看到,没有K掺杂的Li4Ti5O12电极在低倍率0.5C下表现出较高的放电容量和较好的循环性能。0.5C下,其首次放电比容量为165 mAh· g-1。尽管如此,随着充放电倍率的增加,其放电比容量呈现迅速衰减的趋势。1.0C时,其放电比容量保持为139 mAh·g-1,3.0C时,衰减为105 mAh·g-1,5.0C时,其放电比容量仅为87 mAh·g-1。与上述现象相反的是,K掺杂Li4-xKxTi5O12(x=0.02,0.04,0.06)电极,如Li3.98K0.02Ti5O12和Li3.96K0.04Ti5O12,在低倍率 0.5C下表现出相对较小的放电容量,但是随着充放电倍率的增加,其放电比容量衰减较之Li4Ti5O12电极小的多, 表现出较好的倍率性能。 Li3.98K0.02Ti5O12和Li3.96K0.04Ti5O12电极在 0.5C,1.0C,3.0C和 5.0C的放电比容量分别为 163,142,128,111 mAh·g-1和161,147,138,121 mAh·g-1。另外,从图7所示的电极在不同倍率下的循环性能图中可以看到,Li3.94K0.06Ti5O12电极表现出最差的放电比容量和倍率性能。其在0.5C,1.0C,3.0C和5.0C的放电比容量分别只有157,134,97和80 mAh·g-1。上述结果表明,适量的K掺杂虽然在一定程度上损害了材料的放电比容量,但是却可以明显改善材料的倍率性能;但是过多的K掺杂量不仅不利于材料倍率性能的提高,还不利于材料容量的发挥。认为导致上述现象的原因是:K掺杂 Li4-xKxTi5O12(x=0.02,0.04,0.06)电极材料具有比Li4Ti5O12电极材料小的粒径、大的比表面积和孔容积,可以使Li4-xKxTi5O12电极材料在电化学工作过程中缩短Li+的迁移路径,增大与电解液的接触面积,提高电子导电性能,从而使材料的电化学性能尤其是倍率性能得到明显提高。但是,由于K掺杂占据的是Li4Ti5O12中部分Li的位置,可能会阻碍Li4-xKxTi5O12电极材料在充放电过程中Li+的迁移,因此过多的K掺杂反而不利于材料电化学性能的提高。综合图7所示4种电极的放电容量和倍率性能,Li3.96K0.04Ti5O12电极体现出最好的电化学性能。因此认为,x=0.04时是最佳掺杂量。
图8为Li4Ti5O12电极和K掺杂Li4-xKxTi5O12(x= 0.02,0.04,0.06)电极经过上述倍率性能测试后回到3.0C下的循环性能测试。从图中可以看到,K掺杂Li4-xKxTi5O12(x=0.02,0.04,0.06)电极在经过200次充放电循环后容量衰减较小,而Li4Ti5O12电极则体现出较明显的容量衰减。说明K掺杂可以明显提高Li4Ti5O12材料循环性能。 在所有电极中,Li3.96K0.04Ti5O12体现了最好的循环性能,3.0C下,其放电比容量为138 mAh·g-1,200次循环后放电比容量为137 mAh·g-1,容量保持率为99.3%。

图7 Li4-xKxTi5O12(x=0,0.02,0.04,0.06)电极在不同倍率下的循环性能:0.5C,1~5;1.0C,6~10;3.0C,11~15;5.0C,16~20Fig.7 Cyclic performance of the Li4-xKxTi5O12(x=0,0.02, 0.04,0.06)electrodes at different rates:1st~5th cycles at 0.5C,6th~10th at 1.0C,11th~15th at 3.0C,16th~20th at 5.0C

图8 Li4-xKxTi5O12(x=0,0.02,0.04,0.06)电极在3.0C下的循环性能Fig.8 Cyclic performances of the Li4-xKxTi5O12(x=0,0.02, 0.04,0.06)electrodes at 3.0C
3 结 论
本文考察了K掺杂对Li4Ti5O12晶体结构、粒径大小、形貌和电化学性能的影响。结果发现,K掺杂能够阻碍材料颗粒在热处理过程中的长大和团聚,使K掺杂Li4-xKxTi5O12具有比Li4Ti5O12小的颗粒粒径,和比Li4Ti5O12大的比表面积、孔容积。K掺杂没有影响立方尖晶石型Li4Ti5O12的合成,同时也没有改变Li4Ti5O12的电化学反应过程。适量K掺杂在一定程度上会削弱Li4Ti5O12容量的发挥,但是可以明显提高Li4Ti5O12的倍率性能。这主要是因为K掺杂Li4-xKxTi5O12具有小的颗粒粒径、大的比表面积和孔容积,电化学反应过程中,能够缩短Li+的迁移路径、增大与电解液的接触面积、提高电子导电性能。尽管如此,过多的K掺杂反而不利于Li4Ti5O12电化学性能的提高。由于K掺杂占据的是Li4Ti5O12中部分Li的位置,可能会阻碍Li4-xKxTi5O12在充放电过程中Li+的迁移,因此过多的K掺杂反而不利于材料离子和电子导电性能的提高。研究发现,K的掺杂量为x=0.04时,Li3.96K0.04Ti5O12体现出相对较好的倍率性能和循环稳定性。
[1]Colbow K M,Dahn J R,Haering R R.J.Power Sources, 1989,26:397-402
[2]Zaghib K,Armand M,Gauthier M.J.Electrochem.Soc., 1998,145:3135-3140
[3]Guerfi A,Sevigny S,Lagace M,et al.J.Power Sources,2003, 119-121:88-94
[4]LIU Dong-Qiang(刘东强),LAI Qiong-Yu(赖琼钰),HAO Yan-Jing(郝艳静),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2004,20(7):829-832
[5]Wolfenstine J,Lee U,Allen J L.J.Power Sources,2006, 154:287-289
[6]Leonidov I A,Leonidova Q N,Perelyaeva L A,et al.Phys. Solid State,2003,45(2):2183-2186
[7]Aldon L,Kubiak P,Womes M,et al.Chem.Mater.,2004,16: 5721-5726
[8]Zaghib K,Simoneau M,Armand M,et al.J.Power Sources, 1999,81-82:300-305
[9]Guerfia A,Sévignya S,Lagacéa M,et al.J.Power Sources, 2003,119-121:88-94
[10]Nakahara K,Nakajima R,Matsushima T,et al.J.Power Sources,2003,117:131-136
[11]Abe Y,Matsui E,Senna M.J.Phys.Chem.Solids,2007,68 (5/6):681-686
[12]Huang S H,Wen Z Y,Zhang J C,et al.Solid State Ionics, 2006,177:851-855
[13]Dominko R,Gaberscek M,Bele U,et al.J.Eur.Ceram. Soc.,2007,27:909-913
[14]Liu H,Feng Y,Wang K,et al.J.Phys.Chem.Solids,2008, 69:2037-2040
[15]Yu H Y,Zhang X F,Jalbout A F,et al.Electrochim.Acta, 2008,53:4200-4204
[16]Chen C H,Vaughey T J,Jansen A N,et al.J.Electrochem. Soc.,2001,148:A102-A107
[17]Zhao H L,Li Y,Zhu Z M,et al.Electrochim.Acta,2008, 53:7079-7083
[18]Wolfenstine J,Allen J L.J.Power Sources,2008,180:582-585
[19]Qia Y L,Huang Y D,Jia D Z,et al.Electrochim.Acta, 2009,54:4772-4776
[20]Li X,Qu M Z,Yu Z L.J.Alloys Compd.,2009,487:12-17
[21]Amatucci G G,Badway F,Pasquier A D,et al.J.Electrochem. Soc.,2001,148(8):A930-A939
[22]Cheng L,Liu H J,Zhang J J,et al.J.Electrochem.Soc., 2006,153:A1472-A1477
[23]Shenouda A Y,Murali K R.J.Power Sources,2008,176: 335-339
[24]Shenouda A Y,Liu H K.J.Power Sources,2008,185:1386-1391
[25]ShenoudaAY,LiuHK.J.AlloysCompd.,2009,477:498-503
Structural and Electrochemical Characteristics of Li4-xKxTi5O12as Anode Material for Lithium-Ion Batteries
LI Xing1,2QU Mei-Zhen1YU Zuo-Long*,1
(1Chengdu Institute of Organic Chemistry,Chinese Academy of Sciences,Chengdu610041)
(2Graduate University of the Chinese Academy of Sciences,Beijing100049)
The spinel Li4Ti5O12and K-doped Li4-xKxTi5O12(x=0.02,0.04,0.06)were prepared by a solid state reaction.X-ray powder diffraction(XRD),scanning electronic microscopy(SEM)and Brunau-Emmertt-Teller(BET)were employed to characterize the synthesized materials.The results indicated that K-doping did not affect the synthesis of the cubic spinel Li4Ti5O12.Furthermore,the K-doping did not change the electrochemical reaction process of Li4Ti5O12.The K-doped Li4-xKxTi5O12(x=0.02,0.04,0.06)had smaller particle size,larger specific surface area and hole cubage than the pristine Li4Ti5O12without K doping.An appropriate amount of K doping was favorable to the electrochemical performances,and in particular the rate capability of Li4Ti5O12.However,a high amount of Zr-doping was adverse.The research suggested that Li3.96K0.04Ti5O12exhibited a relatively good rate capability and cycling stability.At the charge-discharge rate of 0.5C,3.0C and 5.0C,its discharge capacities were 161,138 and 121 mAh·g-1,respectively.After 200 cycles at 3.0C,its discharge capacity remained at 137 mAh·g-1.
lithium-ion battery;anode material;spinel lithium titanate;doping
TM912.9
A
1001-4861(2010)02-0233-07
2009-09-27。收修改稿日期:2009-11-04。
国家重点基础研究发展计划(973计划)项目(No.2006CB932703);中国科学院知识创新工程重要方向项目(No.KJCX2-YW-M01)资助。*
。E-mail:yzuolong@163.com
李 星,男,28岁,博士研究生;研究方向:锂离子电池负极材料及应用。
