mRNA /总RNA与水稻强弱势粒结实率和充实度的关系
2010-11-07黄升谋
黄升谋
(襄樊学院 化学工程与食品科学学院,湖北 襄樊 441053)
mRNA /总RNA与水稻强弱势粒结实率和充实度的关系
黄升谋
(襄樊学院 化学工程与食品科学学院,湖北 襄樊 441053)
通过探讨强、弱势粒结实率和充实度与mRNA/总RNA的关系,分析水稻强势粒和弱势粒结实率和充实度差异的机理,旨在提高水稻结实率和充实度. 结果发现:弱势粒中总RNA含量和单粒含量与强势粒差异不大,mRNA、蛋白质含量和单粒含量以及mRNA 与总 RNA之比低于强势粒. mRNA /总 RNA与强弱势粒结实率和充实度一致,mRNA /总 RNA低是弱势粒结实率和充实度低的原因. 因为mRNA/总RNA排除了籽粒灌浆的稀释作用,反映了水稻籽粒灌浆过程中基因转录活性的高低,与籽粒灌浆趋势一致,所以将其作为库活性的指标是适宜的.
mRNA /总RNA;水稻;强势粒;弱势粒;结实率;充实度
超高产杂交水稻特别是亚种间杂交水稻库容量大,穗大粒多,高产潜力很大,但由于其库活性较低,导致其运转率很低,特别是弱势粒结实率和充实度较低,影响了其产量进一步提高[1]. 因此,不少学者从植物激素及与籽粒灌浆有关的酶等方面对强、弱势粒进行了一些生理生化特性的研究[2-19]. 但由于以上研究只是在激素、酶水平揭示了强弱势粒结实率和充实度差异的一些相关现象,更深层次的原因仍不明确. 杂交水稻结实率和充实度较低的最重要的原因是弱势粒(库)活性较低,然而怎样表示库活性的大小还没有一个恰当的量化标准,水稻籽粒灌浆是个动态过程,籽粒中的活性物质不断被灌浆物质所稀释,不同籽粒灌浆程度不一,一些活性物质被稀释的程度也不一样,所以不同籽粒之间无论是用单位重含量还是用单粒含量来比较库活性都不恰当. 所以研究并找到一个有效的方法比较不同籽粒的(库)活性有着重要的理论与实践意义.
植物体内的功能物质——蛋白质是由脱氧核糖核酸(DNA)转录成核糖核酸(RNA),然后再由RNA翻译而成的. 总RNA包括rRNA、tRNA和mRNA,rRNA在生物体内稳定性较好,含量较高,能存在较长时间,称为长寿命RNA,而mRNA在植物体内不能长期存在,发挥功能后很快被RNA酶降解,mRNA含量较低,只占总RNA的1-5%,且随细胞的生理状况而变化,mRNA含量反映了基因转录活性的高低[20]. 然而水稻强、弱势粒在发育过程中由于受灌浆的影响,总RNA、mRNA和蛋白质被稀释,其含量难以真正反映籽粒基因转录活性,由于mRNA和总RNA在籽粒灌浆过程中都是以同样的倍数稀释,故mRNA 与总 RNA之比与籽粒灌浆稀释无关,反映了水稻籽粒灌浆过程中基因转录活性的高低. 当前,强、弱势粒核酸和蛋白质含量差异的研究鲜有报道,以mRNA与总RNA之比作为库活性的指标研究其与强弱势粒结实率和充实度关系尚无人涉足. 所以探讨强、弱势粒结实率和充实度与mRNA/总RNA的关系,对于了解强势粒和弱势粒结实率和充实度的差异的机理,提高水稻结实率和充实度具有重要的理论与实践意义.
1 材料与方法
1.1 实验材料
水稻(Oryza sativa )品种培两优500(培矮64s/500). 于单穗抽穗当天、第6天、第12天和第18天各取整齐一致的200穗,分别剥取强势粒(上部3个一次枝梗上抽穗当天开花的籽粒,第12天和第18天因其灌浆较多,子房破裂,难以剥下完整的子房,且籽粒内的浆液无法及时用液氮处理,mRNA很容易被RNA酶降解而不取)和弱势粒(下部3个二次枝梗上除去顶粒,抽穗后6天开花的籽粒)的子房,立即投入液氮中,置于-70℃冰箱保存.
1.2 结实率、充实度的考查
于成熟期取穗数相同的20株,分强势粒、弱势粒及其它籽粒考查其结实率、充实度. 充实度以结实籽粒千粒重与比重大于1.1g/m l的籽粒千粒重之比表示.
1.3 籽粒灌浆动态考查
于抽穗期选择整齐一致的穗挂牌标记450穗,从抽穗当天开始,每3天取一次样,每次取30穗,烘干,然后分强势粒、弱势粒称重,考查籽粒灌浆动态.
1.4 总RNA的提取、含量测定
按Qiagen公司的RNeasy Plant M ini kit的说明书进行. 先取100mg样品放入液氮中研磨并匀浆,后加入450µL的胍基硫氢酸缓冲液,并涡旋振荡,使核酸酶变性失活,以得到完整的核酸. 把样品液移入QIAshredder旋转柱中,在20℃下以18,000g离心2m in,上清液中加入225µL的乙醇,提供硅胶膜束缚核酸的条件,把样品加入到含有硅胶膜的RNeasy m ini旋转柱中,总RNA吸附到硅胶膜上,用缓冲液洗脱各种污染物. 最后用无核糖核酸酶的水把总RNA从RNeasy mini旋转柱中洗脱下来. 用DU-640核酸蛋白分析仪测定其含量和纯度.
1.5 mRNA的分离和纯化
按Qiagen公司oligtexTMKit说明书进行. 在250 Lμ的总RNA样品中加入250 Lμ OBB缓冲液和15 Lμ oligotex悬浮液并混合均匀,在70℃水浴中温育3m in,室温下放10m in,使mRNA的Poly-A与oligotex粒子杂交,然后在20℃下以18,000g离心2m in,以沉淀oligotex-mRNA复合物. 用400 Lμ的OW 2缓冲溶液重新悬浮oligotex-mRNA并转移到一个小旋转柱中,在20℃下以18,000g离心1m in,重复此步骤1次. 最后加OEB缓冲液于小旋转柱中,在20℃下以18,000g离心1min,把mRNA从oligotex-mRNA中洗脱下来.
1.6 蛋白质的提取和测定
蛋白质的提取和含量测定按文献[3]的方法进行.
2 实验结果与分析
2.1 强弱势粒结实率、充实度的差异
强弱势粒结实率、充实度的差异如表1所示.

表1 强弱势粒结实率、充实度的差异
从表1可知,培两优500强势粒结实率比弱势粒高25%,充实度高3.9%,可见两者的差异是明显的.
2.2 强弱势粒籽粒灌浆特
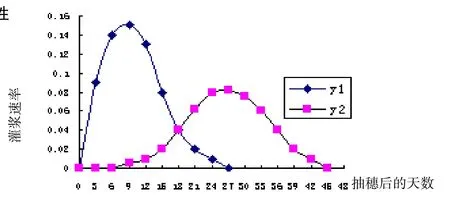
图1 强弱势粒灌浆强度曲线(y1:强势粒;y2:弱势粒)
从强弱势粒灌浆强度曲线(见图1)可知,培两优500为明显的异步灌浆型,强势粒灌浆起步早,抽穗后,灌浆强度迅速增加,8天到达高峰,然后迅速下降;弱势粒抽穗后0~6天灌浆处于停滞状态,以后开始缓慢上升,27天到达高峰,以后开始缓慢下降. 强势粒灌浆高峰期灌浆强度高,灌浆持续时间较短;弱势粒灌浆高峰期灌浆强度较低,持续时间较长.
2.3 强弱势粒总RNA、mRNA及蛋白质含量差异
强弱势籽粒子房中总RNA、mRNA及蛋白质含量如表2
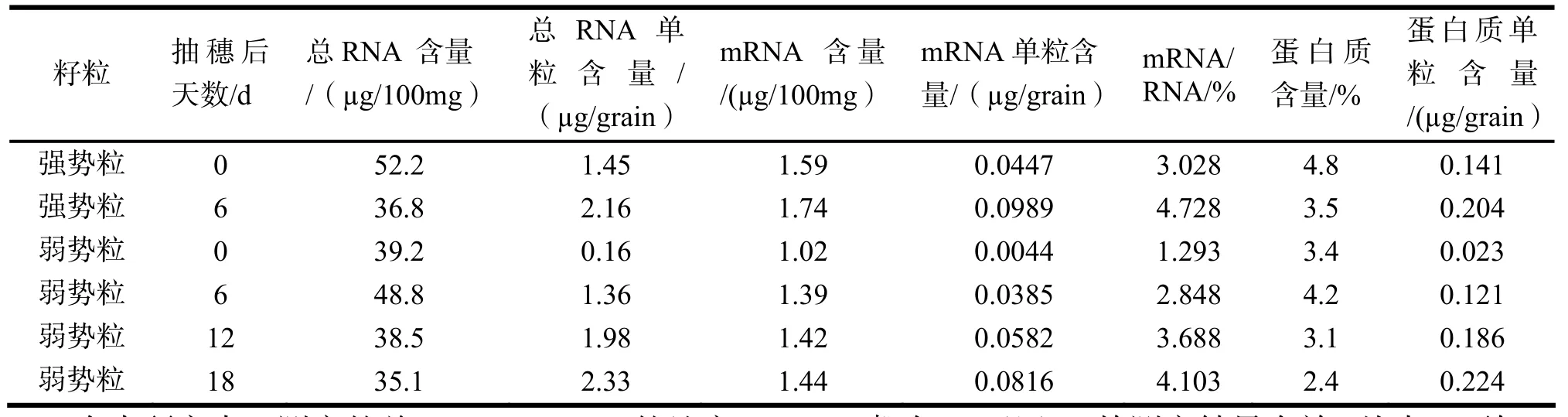
表2 强弱势籽粒子房中总RNA、mRNA及蛋白质含量
在本研究中,测定的总RNA、mRNA的纯度(260/280)都在1.9以上,故测定结果有效. 从表2可知,抽穗后0~6天,强势粒总RNA和蛋白质含量都有所降低,单粒含量都有所增加,mRNA含量和单粒含量、mRNA/总RNA有显著的增加. 弱势粒抽穗后0~6天,总RNA、mRNA和蛋白质含量和单粒含量都有所增加,mRNA/总RNA也有显著的增加,6~18天,总RNA和蛋白质含量都有所降低,单粒含量都有所增加,mRNA 含量和mRNA/总RNA也有显著的增加. 抽穗当天,弱势粒总RNA、mRNA和蛋白质含量和单粒含量以及mRNA /总RNA都低于强势粒;抽穗后第6天,弱势粒总RNA和蛋白质含量高于强势粒, mRNA含量和单粒含量、总RNA、蛋白质单粒含量以及mRNA /总RNA低于强势粒;开花当天(强势粒抽穗当天,弱势粒抽穗后第6天)和开花后第6天(强势粒抽穗后第6天,弱势粒抽穗后第12天),弱势粒中总RNA含量和单粒含量与强势粒差异不大,mRNA、蛋白质含量和单粒含量以及mRNA /总 RNA都低于强势粒. 不论是强势粒还是弱势粒,从抽穗、开花到开花后第18天,其总RNA、mRNA和蛋白质单粒含量都有显著的增加. mRNA /总RNA与强弱势粒结实率和充实度一致.
3 讨论
在本研究中,抽穗后0~6天,强势粒总RNA和蛋白质含量都有所降低,单粒含量都有所增加,mRNA含量和单粒含量、mRNA/总RNA有显著的增加,这是由于水稻抽穗当天,强势粒已开花受精,与籽粒灌浆有关的基因迅速表达,故强势粒总RNA和蛋白质单粒含量都有所增加,然而,由于此时强势粒已开花受精并迅速灌浆,总RNA和蛋白质增加的速度比不上籽粒灌浆的速度,所以强势粒总RNA和蛋白质含量都有所降低,由于mRNA含量增加的速度快于籽粒灌浆的速度,故其含量有所增加. 总RNA主要是由长寿命rRNA组成的,rRNA在生物体内稳定性较好,能存在较长时间,而mRNA由于籽粒已开花受精,与籽粒灌浆有关的基因迅速表达,虽然由于籽粒灌浆的稀释,含量有所下降,但由于mRNA量的增加快于总RNA的增加,故mRNA/总RNA有显著的增加.
弱势粒抽穗后0~6天,总RNA、mRNA和蛋白质含量和单粒含量都有所增加,mRNA/总RNA也有显著的增加,这是由于抽穗当天,弱势粒尚未开花受精,与籽粒灌浆有关的基因尚未表达,抽穗后6天,弱势粒开始开花受精,与籽粒灌浆有关的基因迅速表达,而籽粒灌浆刚刚开始,其总RNA、mRNA和蛋白质含量增加的速度大于籽粒灌浆稀释的速度,且mRNA量的增加快于总RNA的增加,故总RNA、mRNA和蛋白质含量和单粒含量都有所增加,mRNA/总RNA也有显著的增加.
弱势粒抽穗后6~18天,总RNA和蛋白质含量都有所降低,单粒含量都有所增加,mRNA 含量和mRNA/总RNA也有显著的增加. 这是由于此时弱势粒已开花受精,与籽粒灌浆有关的基因迅速表达,故其总RNA、mRNA和蛋白质单粒含量都有所增加. 然而,由于此时弱势粒已开花受精并迅速灌浆,总RNA和蛋白质增加的速度比不上籽粒灌浆稀释的速度,所以总RNA和蛋白质含量都有所降低,由于总RNA主要是由长寿命rRNA组成的,rRNA在生物体内稳定性较好,能存在较长时间,增加较少,而mRNA由于籽粒已开花受精,与籽粒灌浆有关的基因迅速表达,虽然由于籽粒灌浆的稀释,但含量变化不大. mRNA量的增加快于总RNA的增加,故mRNA/总RNA有显著的增加.
开花当天(强势粒抽穗当天,弱势粒抽穗后第6天)和开花后第6天(强势粒抽穗后第6天,弱势粒抽穗后第12天),弱势粒中总RNA含量和单粒含量与强势粒差异不大,mRNA、蛋白质含量和单粒含量以及mRNA /总 RNA也低于强势粒,说明强势粒受精后,基因表达活性较高,能产生较多与籽粒灌浆有关的功能蛋白质,籽粒(库)活性较高,吸引营养物质的能力较强,故结实率和充实度较高. 进一步分析表明,强势粒之所以能优先启动与灌浆有关的基因表达,可能与其开花受精较早有关,强势粒抽穗当天即开花受精,由于受精作用,启动新的基因转录,而弱势粒开花受精作用要晚6天左右. 只是由于出现较晚,启动灌浆较迟,此时水稻群体相对衰弱,源的供应不足,从而导致弱势粒结实率和充实度较低.
总RNA为长寿命RNA,比较稳定,且受到籽粒灌浆的稀释,其含量与籽粒(库)活性关系不大. 籽粒在灌浆后期积累了一些储藏蛋白,受到籽粒灌浆的稀释,故蛋白质也与籽粒(库)活性关系不大. mRNA虽与基因表达关系密切,但其含量受籽粒灌浆的稀释,虽与籽粒灌浆有一致的关系,却不够灵敏. 而mRNA 和总RNA在籽粒灌浆过程中都是以同样的倍数稀释,故mRNA/总RNA排除了籽粒灌浆的稀释作用,反映了水稻籽粒灌浆过程中基因转录活性的高低,与籽粒灌浆趋势一致,以其作为库活性的指标是适宜的.
[1] 黄升谋. 杂交水稻W6154s/早特青结实率的研究[J]. 湖南农业大学学报, 2001, 27(2): 87-88.
[2] 曹显祖, 朱庆森, 陆桂兴, 等. 水稻不同源库类型品种的结实生理特性[G]//中国植物生理学会. 第五次全国植物生理学会议论文摘要汇编. 上海: [出版者不详], 1990.
[3] 黄升谋, 邹应斌. 杂交水稻两优培九强弱势粒结实生理研究[J]. 作物学报, 2005, 31(1): 102-107.
[4] 王志琴, 杨建昌, 朱庆森, 等. 亚种间杂交稻籽粒充实不良的原因探讨[J]. 作物学报, 1998, 24(6): 782-786.
[5] 杨建昌, 苏宝林, 王志琴, 等. 亚种间杂交稻籽粒灌浆特性及其生理研究[J]. 中国农业科学, 1998, 31(1): 7-14.
[6] 杨建昌, 彭少兵, 顾世梁, 等. 水稻结实期籽粒和根系中玉米素与玉米素核苷含量的变化及其与籽粒充实的关系[J]. 作物学报, 2001, 27(1): 35-42.
[7] 杨建昌, 王志琴, 王庆森, 等. ABA与GA对水稻籽粒灌浆的调控[J]. 作物学报, 1999, 25(3): 341-347.
[8] 顾世梁, 朱庆森, 杨建昌, 等. 不同水稻材料籽粒灌浆特性的分析[J]. 作物学报, 2001, 27(1): 7-14.
[9] 杨建昌, 刘立军, 王志琴. 稻穗颖花开花时间对照乳发育的影响其生理机制[J]. 中国农业科学, 1999, 32(3): 44-51.
[10] 张祖建, 朱庆森, 王志琴. 水稻胚乳细胞计数方法研究[J]. 江苏农业研究, 1996, 17(2): 7-11.
[11] 张祖建, 朱庆森, 王志琴, 等. 水稻品种源库特性与胚乳细胞增殖和充实的关系[J]. 作物学报, 1998, 24(1): 21-27.
[12] 张祖建, 王志琴, 徐 生, 等. 水稻胚乳细胞增殖和充实与子房生理活性变化关系的研究[J]. 作物学报, 1998, 24(6): 670-676.
[13] 袁莉民, 张祖建, 郎有忠, 等. 杂交水稻胚乳解剖性状发生过程的研究[J]. 江苏农业研究, 2000, 21(1): 8-11.
[14] 杨建昌, 刘立军, 王志琴. 稻穗颖花开花时间对照乳发育的影响其生理机制[J]. 中国农业科学, 1999, 32(3): 44-51.
[15] JENNER C F, SIWED K, HAWKER J S. The synthesis of [14C]starch from[14C]sucroce in isolated wheat grains is dependent upon the activity of soluble starch synthase[J]. Aust J Plant Physiol, 1993(20): 329-335.
[16] KEELING P L, BACON P J, HOLT D C. Elevated temperature reduces starch deposition in wheat endosperm by reducing the activity of soluble starch synthase. [J]. Planta, 1993(191): 342-348.
[17] NAKAMURA Y, YUKI K, PARK S Y. Carbohydrate metabolism in the developing endosperm of rice grains[J]. Plant Cell Physiol, 1989, 30(6): 833-839.
[18] SM ITH A M, DENYER K, MARTIN C R. What controls the amount and structure of starch in storage organs? [J]. Plant Physiol, 1995(107): 673-677.
[19] 黄升谋, 邹应斌. 水稻强弱势粒核酸蛋白质代谢差异[J]. 中国水稻科学, 2004, 18(4): 374-376.
[20] 孙乃恩, 孙东旭, 朱德煦. 分子遗传学[M]. 南京: 南京大学出版社, 1990.
m RNA /total RNA in Setting Percentage and Filling Rate of Rice
HUANG Sheng-mou
(School of Chem ical Engineering and Food Science, Xiangfan University, Xiangfan 441053, China)
The relationship of the setting percentage and filling rate of inferior grains and superior grains between mRNA/total RNA was discussed to improve the setting percentage and filling rate of rice. It found that the difference of the contents and single-grain contents of the total RNA in the inferior grains ovaries were not significant w ith that in superior grains ovaries, the contents and single-grain contents of mRNA , protein and mRNA /total RNA in the inferior grains ovaries were lower than that in the superior grains ovaries. These showed that mRNA /total RNA was consistent w ith the setting percentage and filling rate of superior and inferior grains,the lower of mRNA /total RNA was the reason of the lower of the setting percentage and filling rate of inferior grains.
mRNA /total RNA; Rice; Superior grains; Inferior grains; Setting percentage; Filling rate
S511
A
1009-2854(2010)11-0030-04
(责任编辑:徐 杰)
2010-06-28
襄樊市科技攻关项目(2006); 湖北省教育厅科学基金重点项目(D200625005)
黄升谋(1962— ), 男, 湖北武汉人, 襄樊学院化学工程与食品科学学院教授.
