IPTG诱导变形链球菌葡糖基转移酶可溶性表达及活性初步测定*
2010-11-07汪林储冰峰王成龙刘洪臣邵宁生杨光董洁刘玉
汪林 储冰峰 王成龙 刘洪臣 邵宁生 杨光 董洁 刘玉
IPTG诱导变形链球菌葡糖基转移酶可溶性表达及活性初步测定*
汪林 储冰峰 王成龙 刘洪臣 邵宁生 杨光 董洁 刘玉
目的:提取变形链球菌GS5葡糖基转移酶GTF(glucosy ltransferase)催化活性区(CAT)的基因,利用IPTG诱导后获得可溶性表达,并检测活性。方法:利用PCR技术克隆CAT的基因片段,通过蛋白重组融合表达技术使其在大肠杆菌BL21中表达,利用异丙基硫代-β-D-半乳糖苷(IPTG)诱导含有质粒pET32-NusA-CAT的大肠杆菌,SDS-PAGE电泳进行检测;采用蒽酮硫酸法验证活性。结果:成功将CAT基因连入大肠杆菌BL21,获得可溶性的融合蛋白表达;并且融合蛋白具有生物学活性。结论:IPTG成功诱导克隆的变形链球菌葡糖基转移酶催化活性区基因并获得可溶性融合蛋白的表达,具有生物学活性。
变形链球菌;葡糖基转移酶;大肠杆菌
葡糖基转移酶(Glucosy ltransferase,GTF)是变形链球菌合成的重要致龋因子,催化蔗糖合成包括葡聚糖在内的多种胞外多糖[1],包含催化活性区(Cataly tic,CAT)和葡聚糖结合区(Glucan binding, GB或GLU)两个功能区段[2],催化活性区具有催化蔗糖水解的活性,能够催化蔗糖产生葡聚糖[3]。异丙基硫代-β-D-半乳糖苷(IPTG)是一种十分有效的乳糖操纵子的诱导剂可与阻遏物结合促进基因的表达,但是IPTG对人体具有潜在的毒性[4]。本实验拟通过PCR方法获得CAT区的基因片段,并将其克隆至原核表达载体pET-32-NusA中,摸索IPTG合适的诱导条件,使大肠杆菌BL21高表达其融合蛋白,为后续筛选GTF的拮抗剂打下基础。
1.材料和方法
1.1 材料
1.1.1 菌种及细胞株变形链球菌GS5购自首都医科大学附属口腔医院;大肠杆菌BL21和pET-32a由军事医学科学院基础所保存。
1.1.2 主要试剂DNA纯化回收试剂盒,琼脂糖凝胶DNA回收试剂盒,限制性内切酶XhoⅠ,H indⅢ均购自TaKaRa公司;细菌基因组DNA提取试剂盒购自法特捷公司;Taq DNA聚合酶,Pfu DNA聚合酶均购自天为时代公司;T4 DNA连接酶购自NEB公司。
1.2 实验方法
1.2.1 GTF的CAT基因表达载体的构建与鉴定质粒pET-32a和PCR产物分别进行H indⅢ和XhoⅠ双酶切及切胶回收,连接后转化E. coliBL21。双酶切pET-32-NusA载体(由军事医学科学院基础所保存)体系:pET-32-NusA载体3μl,H indⅢ1μl,XhoⅠ1μl,Buffer M 2μl,ddH2O13μl,总体积20μl。挑单克隆提取质粒做PCR和双酶切鉴定。
1.2.2 GTF融合蛋白的诱导表达及表达鉴定将测序鉴定后的重组质粒转化E.coli BL21,挑取单克隆过夜培养。将10μL连接产物加入200μl大肠杆菌感受态细胞BL21中(体积不超过感受态体积的5%),转入1m lM.S.A培养基,37℃摇床180r/m in培养约45m in。用原先钓取基因时合成的引物进行菌落PCR鉴定,1%琼脂糖凝胶电泳检测,并将该克隆测序。
1.2.3 重组GTF的诱导表达将重组菌培养扩增后加入IPTG至终浓度为0.1mmol/L诱导后进行蛋白电泳检测。超声破碎菌体,分别收取上清及沉淀,12%SDS-PAGE电泳。
1.2.4 重组GTF蛋白的可溶性鉴定收集诱导后菌液1m l,冰水浴中超声处理,之后4℃离心分别收集上清和沉淀,12%SDS-PAGE分析。将获得的上清液透析冻干并进行Western-Blot鉴定,天然的变形链球菌菌液处理方法相同。
1.2.5 重组GTF蛋白的生物活性初步测定采用蒽酮硫酸法对重组GTF蛋白进行生物活性测定,加入不同浓度的蔗糖与重组GTF蛋白孵育后进行OD630数值读取。
1.3 统计分析采用spss13.0对数据进行统计学分析。
2.结果
2.1 琼脂糖凝胶电泳结果以提取的变形链球菌GS5基因组DNA为模板,以合成的CAT-C基因上下游引物进行PCR,将PCR产物进行电泳,用H indⅢ,XholⅠ酶对PCR产物进行双酶切,酶切产物用1%琼脂糖凝胶电泳鉴定,切胶回收。
2.2 pET-32-NusA-CAT表达载体的构建及PCR鉴定将目的片段与表达载体连接后,转化大肠杆菌BL21挑取单克隆进行菌落PCR鉴定(图1)。
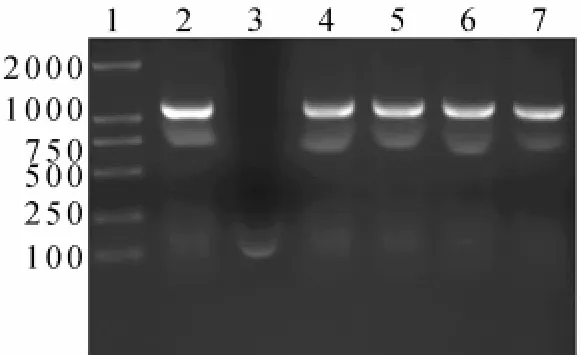
图1 重组菌菌落PCR鉴定
2.3 PCR产物测序结果及同源性分析结果显示所得到的序列与已公布的序列的同源性为98%。所得序列与网上公布序列比对结果:Score= 2054 bits(1068),Expect=0.0 Identities= 1108/1128(98%),Gaps=0/1128(0%)Strand= Plus/Plus。
2.4 重组GTF的诱导表达重组GTF在上清中表达量明显高于在沉淀中的表达,说明重组GTF是可溶性蛋白。
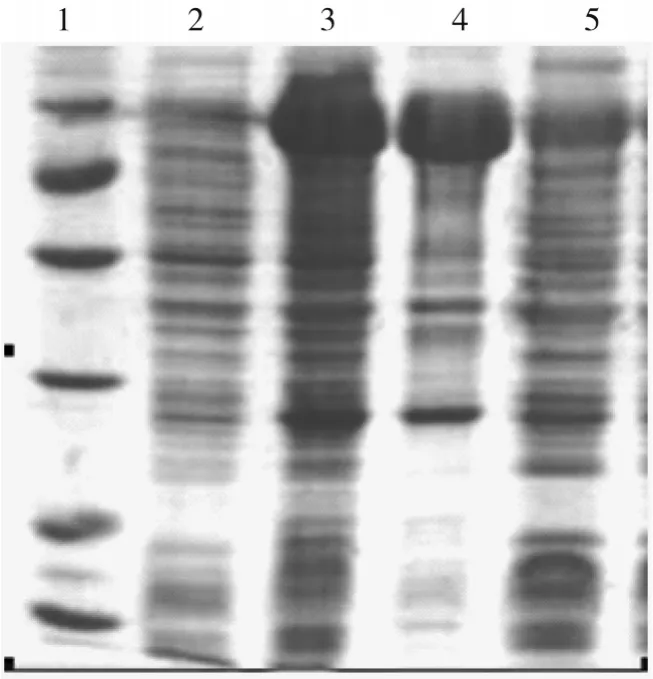
图2 重组GTF的诱导表达
2.5 W esrtern-blot结果将含有重组GTF的菌超声碎菌后上清透析冻干,与多抗抗体发生反应天然的变形链球菌同法处理,结果见图3。
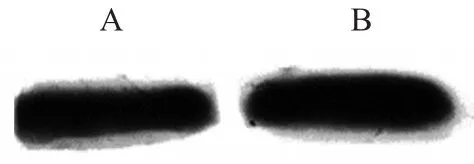
图3 W esrtern-blot结果A:重组GTF B:天然菌中提取GTF
2.6 蒽酮硫酸法初步测定重组GTF生物学活性随着参与反应的蔗糖浓度从糖浓度1到糖浓度3降低,OD630数值随之降低,见图4。
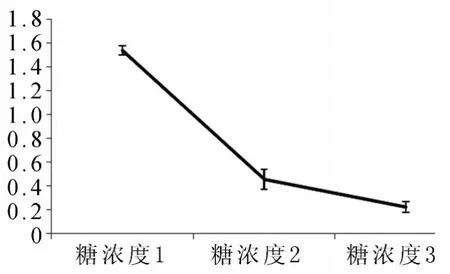
图4 蒽酮硫酸法初步测定重组GTF生物学活性经过统计学t检验P<0.05证实有统计学差异
3.讨论
在变形链球菌中,水解蔗糖并催化合成葡聚糖的葡萄糖基转移酶(GTF)已被广大学者公认为重要的致龋因子之一[5],由它产生的水不溶性葡聚糖能够促进细菌与牙表面及细菌之间的粘附,从而形成菌斑。GTF在不同血清型的变形链球菌中有着不同的种类,在C型中主要分为三种,分别是:GTF-I,GTF-S,GTF-SI,分别对应着基因gtfB,gtfD和gtfC[6,7]。GTF-I催化合成水不溶性葡聚糖(W IG),GTF-S合成水溶性葡聚糖(WSG),GTF-SI合成水不溶性和水溶性葡聚糖的混合物,其中gtfC编码的GTF-SI对致龋尤为重要[8]。Hanada和Kuram itsu等[6]已经在体外实验中证实,变形链球菌GS5gtfC基因缺失的突变体丧失了在光滑牙面的蔗糖依附性。
由于GTF种类比较多,并且在变形链球菌细胞胞浆内、细胞壁上以及细胞间质中均有分布,因此想获得GTF的步骤也比较纷繁复杂。一般采用硫酸铵盐析法即对细胞裂解物或发酵液进行沉淀,然后再用各种层析方法主要是羟磷灰石填充柱和PBE94聚焦色谱柱进行,但是此方法步骤多,酶量和酶活性损失大;亲和层析法即通过GTF与葡聚糖或右旋糖苷结合特异的亲和性来富集、分离和纯化各种GTF[9]。在1999年Jespersgaard等[10]用Sephadex G-100和Sephadex G-150层析柱进行亲和层析发酵液,洗脱,而得到富集GTF的组分。Yamashita等[11]依次利用DEAE-纤维素离子交换层析、右旋糖苷琼脂亲和(dex tran-agarose affinity)层析、TSK-gel Phey l-5PW高效液相(high performance liquidch romatography,HPLC)法分离纯化了GTF-SI、GTF-I、GTF-S等组分。相对于传统的层析方法来说,亲和层析特异性强,浓缩效率高并且反应条件温和,酶活性不易损失,纯化步骤也大大简化,但要得到大量的单一的GTF组分还是比较困难的。因此很多学者也尝试用基因工程的方法来表达其编码基因并获得纯的GTF[12,13]。
Hanada等(1988)研究表明,gtfC基因紧靠gtfB基因下游,与gtfB有高度同源性。用Southern印迹法分析证实多数同源基因含有7.3kb的Pst I片段,也由3个ORF组成。gtfC序列中A+T含量高达78%。GTF-SI蛋白质由1375个氨基酸残基组成,该序列中也同gtfB一样几乎不含半胱氨酸。GTF-SI整体呈亲水性,但在信号序列、一段肽内序列和3'端约50个氨基酸残基这3个区段呈疏水性[6]。
GTF中的催化活性区(CAT)是它的重要功能区段,具有催化蔗糖水解的活性。本实验采用异丙基硫代-β-D-半乳糖苷(IPTG)在探索了诱导物浓度对蛋白质表达量的影响后发现并不是IPTG诱导物浓度越大蛋白质表达量越多,在IPTG诱导重组GTF可溶性表达中,我们反复摸索条件,后来发现IPTG在终浓度为0.1mmol/L、诱导温度为30℃是上清中重组GTF含量最高,即能大量获得可溶性的重组GTF。由此我们在后续实验中可以简便高效的获得目的蛋白,通过蒽酮硫酸法进行活性检测。在实验中采用蒽酮硫酸法只是对重组GTF的生物学活性进行初步测定,在后续实验中还将进一步验证。本实验的目的在于利用IPTG诱导后完成GTF中催化活性区(CAT)在大肠杆菌BL21上的可溶性的表达,并对于重组GTF进行了生物活性初步测定,为后续实验打下基础。
[1]储冰峰,赵皿,宋江洪,等.变形链球菌葡萄糖基转移酶基因部分DNA克隆[J].牙体牙髓牙周病学杂志,1995,5(2): 71-73
[2]张彤,杨祖安,蒋小平,储冰峰,等.变形链球菌葡萄糖基转移酶基片段的亚克隆序列测定[J].北京口腔医学.1996,4(3): 108-110
[3]夏伟,王成龙,董洁,等.变形链球菌葡糖基转移酶催化活性区的分子克隆和表达[J].中华老年口腔医学杂志,2005,3 (4):193-195
[4]赵春丽,范秀君,赵冰,等.IPTG诱导浓度对重组人肝再生增强因子基因表达的影响[J].东北农业大学学报,2004,35 (4):441-445
[5]方会清,吴补领,苏凌云,等.老年人高龋患者牙菌斑中变形链球菌临床分离株合成胞外多糖能力的研究[J].中华老年口腔医学杂志,2006,4(2):65-66
[6]Hanada,N.,and H.K.Kuram itsu.Isolation and characterization of the Streptococcus mutans gtfC gene, coding for synthesis of both soluble and insoluble g lucans[J]. Infect.Imm un.1988,56(8):1999-2005
[7]K reth J,Zhu L.Roleof sucrose in the fitnessof Streptococcus m utans[J].OralM icrobiol Immunol.2008,23(3):213-219
[8]Ch ristina Jespersgaard,George Hajishengallis,M ichaelW. Russell Identification and Characterization of a Nonimmunog lobulin Factor in Human Saliva That Inhibits Strep tococcus m utans Glucosy ltransferase[J].In fection and Imm unity 2002,70(3):1136-1142
[9]Daniel J.Sm ith,W illiam F.K ing,Leigh A.Barnes Facilitated Intranasal Induction of Mucosal and System ic Immunity to Mutans Streptococcal Glucosy ltransferase Peptide Vaccines[J].Infection And Immunity.2001,69(8) 4767-4773
[10]Ch ristina Jespersgaard,George Hajishengallis,Terrence E. Greenw ay Functional and Imm unogenic Characterization of Tw o Cloned Regions of Streptococcus mutans Glucosy ltransferase I[J].Infection and Immunity 1999,67 (2):810-816
[11]Y Yam ashita,N Hanada,,T Takehara Purification of a fourth g lucosy ltransferase from Streptococcus sobrinus[J]. JBacteriol.1989,171(11):6265-6270
[12]Harrington DJ,Russell RRB.Multiple changes in cellw all antigens of isogenic mutans of Strep tococcus mutans[J].J Bacteriol.1993,175(8):5925-5933
[13]何奎芳,刘建国,刘天佳,等.变形链球菌表面蛋白可变区与葡聚糖合成的关系[J].口腔医学研究,2006,22(1):5-7
全国口腔颌面-头颈肿瘤综合序列治疗学术研讨会暨口腔颌面-头颈肿瘤综合治疗高级研修班第一轮会议通知
由中华口腔医学会口腔颌面外科专业委员会批准,口腔颌面-头颈肿瘤内科协作组主办、解放军总医院口腔医学中心承办的“第五次全国口腔颌面-头颈肿瘤内科学术会议”暨“国家级继续教育项目[项目编号:2010-08-02-020(国)]——口腔颌面头颈肿瘤的综合治疗高级研修班”将于2010年10月14日至17日将在北京举行,会议地点设在解放军总医院。届时将邀请口腔颌面外科专业委员会名誉主任委员、中国工程院院士邱蔚六教授、华西口腔医院王大章教授、第四军医大学刘宝林教授等知名专家将到会。参会人员将获得I类继续教育10学分。
1.征文内容:口腔颌面-头颈肿瘤的化疗、放疗、生物治疗、热疗、冷冻等综合治疗的相关临床治疗新方法、经验总结以及基础研究的新技术、新进展。
2.稿件要求:来稿请寄中文题目、作者单位和作者姓名,500字以内四段式结构中文摘要(包括目的、方法、结果和结论)各一份。请详细注明通讯地址、邮政编码和联系电话。
3.截稿日期:2010年9月20日(邮戳为准)。
4.会务费:每人1000元(包括工作午餐、讲义等),统一安排食宿,交通、住宿费自理。
5.会议地址:北京解放军总医院
6.联系方式:上海市制造局路639号,上海第九人民医院口腔颌面外科邮编200011联系人:任国欣电话:021-50398070 E-mail:renguoxincn@hotmail.com北京市海淀区复兴路28号,解放军总医院口腔外科一病区邮编100853联系人:席庆电话:13552706909 E-mail:xqsg@sina.com.cn
全国口腔颌面-头颈肿瘤内科协作组
解放军总医院
IPTG induction of the soluble catalytic region of S.mutansexpression and activity assay
WANG Lin,CHU Bing-feng,WANG Cheng-long,LIU Hong-chen,SHAO Ning-sheng,YANG Guang,DONG Jie,LIU Yu.(Institute ofStomatology,GeneralHospitalofChinese PLA,Beijing 100853,China)
Objective:To clone the catalytic region of Glucosyltransferase from StreptococcusmutansGS5 and express it in Escherichia coliBL21 by IPTG induction,obtain the soluble rGTFand activity assay.M ethod:PCR and construction of fusion protein technique,IPTG induction,anthrone-sulfuric acid assay.Result:The CAT genewascloned correctly and its fusion protein was expressed in E.coli by IPTG induction.The SDS-PAGE results showed that the rGTF is soluble,and anthrone-sulfuric acid assay demonstrated itsbiologicalactivity.Conclusion:The aimed gene and its fusion proteinwere gained successfully,and to be demonstrated itsbiologicalactivitywhich providesa base to the further research.
S.mutans;Glucosyltransferase;Escherichia coli
R780.1
A
1672-2973(2010)02-0094-04
2009-12-10)
国家自然科学基金资助项目(编号30440059)
汪林解放军总医院口腔医学研究所博士生北京100853
储冰峰解放军总医院老年口腔病科主任医师北京100853
王成龙解放军总医院口腔内科副主任医师北京100853
刘洪臣通讯作者解放军总医院口腔医学研究所所长主任医师教授北京100853
邵宁生军事医学科学院基础医学研究所研究员北京100850
杨光军事医学科学院基础医学研究所副研究员北京100850
董洁军事医学科学院基础医学研究所助理研究员北京100850
刘玉军事医学科学院基础医学研究所博士生北京100850
