海萤荧光素衍生物发光反应关键步骤的理论研究
2010-11-06任爱民闵春刚邹陆一任雪峰
孙 颖 任爱民 闵春刚 邹陆一 任雪峰
(吉林大学理论化学研究所,理论化学计算国家重点实验室,长春 130023)
海萤荧光素衍生物发光反应关键步骤的理论研究
孙 颖 任爱民*闵春刚 邹陆一 任雪峰
(吉林大学理论化学研究所,理论化学计算国家重点实验室,长春 130023)
用不同取代基对化学发光物质6-芳基-2-甲基咪唑[1,2-α]吡嗪-3-(7H)酮环(海萤发光的类似物)的芳基位进行取代,形成系列海萤荧光素类似物MIPa-MIPd;并采用B3LYP/6-311+G(d,p)方法,通过电子抽取能(EEP)的计算和自然电荷布居分析(NPA),研究了在气相、二甲亚砜(DMSO)和二甘醇二甲醚(DG)中海萤发光的类似物从阴离子变化到自由基过程中取代基的作用.结果表明:在这个过程中,吲哚在DG中作为取代基(MIPb)时的EEP最小,电荷变化最大,说明这种取代基有利于反应的进行.
密度泛函理论; 海萤荧光素; 化学发光; 电子抽取能; 自然电荷布居分析
海萤由于高的发光效率而成为研究热点.海萤把荧光素和荧光素酶喷射到海水中产生蓝色荧光(发光效率0.3),海萤荧光素的晶体结构在1957年由Shimomura等[1]测出.由于生物发光的灵敏度很高,所以海荧荧光素的研究对生物分子的快速敏感检测和对功能活性分子以及细胞的活动规律进行原位跟踪观察发挥着非常重要的作用[2].海荧荧光素在生物医学研究[3]、临床诊断、食品[4]以及环境检测[5-6]等方面的应用也越来越广泛,相关产品也逐步实现产业化和规模化[7].并且海萤荧光素及其荧光素酶都很稳定,可保存多年,这可用于某些特殊情况下的照明[8].但是海萤荧光素高效率的发光问题至今还没有清楚的理论描述.海萤生物发光通常的反应机理是海萤在体内荧光素酶和氧气等的作用下,发光分子(通常称为荧光素)被氧化成激发态,在退激的过程中发出可见光,所以生物发光本质也是化学发光,不同之处在于,在生物发光中激发态的形成往往伴随酶的作用[7,9].1966年研究者发现,一个咪唑并吡嗪酮环的存在是发光反应的核心,另外海萤荧光素的同系物也被合成出来,并用来研究海萤生物发光的机理[9-13].Takahashi等[14]对海萤生物发光的研究表明,咪唑并吡嗪酮环的阴离子(MIP-)和与氧气反应生成咪唑并吡嗪酮环的自由基(MIP·)的过程(如示意图1所示)对整个发光反应起到了关键的作用,并且决定了反应的速率[14-15].本文以海萤荧光素活性中心分子结构咪唑并吡嗪酮环为核心,在C6位上用不同的芳基取代(见图1),用密度泛函理论(DFT)[16-17],B3LYP方法[18-20]结合6-311+G(d,p)基组从理论上研究这些海萤荧光素衍生物的荧光活性中心分子的电子结构,从而从分子水平上理解C6位上取代基的变化对该发光反应决速步骤的影响.
1 理论方法


密度泛函理论研究化学发光现象的可靠性已得到广泛证实[21-22].本文运用Gaussian 03程序包[23],采用密度泛函理论DFT中的B3LYP泛函方法对类海萤荧光素发光过程中关键步骤(示意图1中的反应式(1))涉及的阴离子、自由基的结构进行了优化,考虑所研究分子6-芳基-2-甲基咪唑[1,2-α]吡嗪-3-(7H)酮环上7位H原子的重要性和相应自由基的活泼性,计算中采用了6-311+G(d,p)基组.文中对6-芳基-2-甲基咪唑[1,2-α]吡嗪-3-(7H)酮环(海萤发光的相似物)芳基位不同取代基分子(MIP)从阴离子到自由基的变化过程(示意图1中的反应式(1))的电子抽取能(EEP)和自然电荷布居进行了计算研究.在这里电子抽取能(EEP)定义为阴离子失去一个电子形成自由基所需的垂直电离能.运用自然键轨道(NBO)分析程序得到所计算分子中的原子自然电荷布居,分析各种分子内、分子间电荷变化.溶剂作用选用极化连续模型(PCM)[24]来模拟.溶剂二甲亚枫(DMSO)和二甘醇二甲醚(DG)的相对介电常数分别采用46.7和6.25.
2 结果与讨论
本文研究的化学发光反应过程(见示意图1)即MIP在碱性溶剂作用下失去 H+离子形成 MIP-, MIP-在氧气等的作用下,发生电子转移,即O2抽取了一个电子形成O-·20,使阴离子MIP-变成自由基MIP·,它们继续作用产生了发光分子(DT),发光分子被氧化成激发态(1AAP*),1AAP*在退激的过程中发出可见光.其中MIP-→MIP·过程为整个发光反应的决速步骤[14].对这个决速步骤有影响的因素除了骨架分子结构咪唑并吡嗪酮环外,取代基的影响是值得研究的.已有的报道结果[12-13]显示:在C6位上给电子基团取代咪唑并吡嗪酮环有较好的荧光效率,所以我们选择了三种给电子基团(如图1所示的a-c)和一种吸电子基团(d)对咪唑并吡嗪中心环的C6位进行取代,形成四种反应物MIPa,MIPb,MIPc, MIPd.
2.1 分子几何优化
示意图 1给出了MIP→MIP-→MIP·变化过程[14-15,25-27]的示意图,图1给出了C6位上不同芳基取代的MIP衍生物的具体分子结构,带有不同取代基的MIP分子阴离子和自由基优化结构如图2所示.


表1 MIPa-MIPd阴离子和自由基的C—C6、C═O键长及其差值Table 1 C—C6,C═O bond lengths and bond length differences of the anions and free radicals for compounds MIPa-MIPd
把不同取代基取代咪唑并吡嗪酮化物的中性自由基分子和阴离子作对比,结果表明:在气相中,给受电子基团与MIP间基本上保持在同一平面(二面角在179.15°-179.90°之间,而吸电子基团为173.85°),取代基与MIP连接处的C—C6键长有明显变化.有研究表明[14],当咪唑并吡嗪酮环在溶剂DG中时,其发光效率接近于海萤生物体本身,所以我们在前面优化的几何构型下,采用PCM模型在DG溶剂中再次优化其构型.部分优化结果如表1所示,结果表明:在MIP-变为MIP·时吸电子取代基团与咪唑并吡嗪酮环的角度发生的变化相对给电子基团偏大,因而吸电子基团取代时共轭减弱.阴离子与自由基中的C—C6键长差值的关系是MIPb=MIPc≈MIPa>MIPd,说明取代基为给电子性质时,从阴离子到自由基时C—C6键长变化比较大并且都缩短了(气相中缩短了0.0009-0.0010 nm,DG中缩短了0.0012-0.0013 nm),表明此时的自由基相对阴离子来说,取代基与咪唑并吡嗪酮环间共轭加强,而由吸电子基取代时C—C6键长也缩短了,但是幅度比较小(气相中缩短了0.0005 nm,DG中缩短了0.0006 nm).这样无论在气相还是溶剂中都呈现一个规律:具有给电子基的阴离子a,b,c相对吸电子基的阴离子d键长变化大,给电子基团与中心结构的π共轭相互作用加强,并且在溶剂中C—C6键长变化幅度都大于在气相中,说明溶剂增强了给电子基团与中心结构片段之间的相互作用.
2.2 电子抽取能的计算
由Takahashi等[14]的研究可知,咪唑并吡嗪酮环的阴离子(MIP-)与氧气反应生成咪唑并吡嗪酮环的自由基(MIP·)的过程(如示意图1所示)对整个发光反应起到了关键的作用,并且决定了反应的速率[15].电子抽取能EEP可评估一个分子失去电子的能力,EEP越小说明失去电子时需要的能量越小,即越容易失去电子.对于海萤衍生物荧光过程、性质和荧光效率来说,除了发光体本身分子结构起决定作用外,外界环境如溶剂的影响也不容忽视.已有实验报道[27-28]表明在非质子溶剂中海萤类似物的荧光效率较高,所以,我们选择了在DMSO和DG非质子溶剂中及气相中对MIPa-MIPd分子进行深入的理论研究.首先我们对反应物 MIPa--MIPd-的HOMO-LUMO能隙做了分析,结果列于表2.结果表明,它们的能隙在气相和DMSO中的顺序为MIPa-<MIPd-<MIPc-<MIPb-,在溶剂 DG中变为MIPa-<MIPb-<MIPc-<MIPd-,显然MIPb-在DG中的动力学稳定性降低,说明在类海萤环境DG中MIPb-在整个发光反应的决速步骤中优先于其他取代物MIPc--MIPd-.
其次分别计算了MIPa-MIPd分子的电子抽取能(表3),通过表3可知:无论是在气相中还是两种溶剂(DMSO和DG)中,给电子基取代物MIPa-MIPc的EEP总小于吸电子基取代物MIPd的,EEP越小,反应越容易进行.表3结果说明给电子基团作为取代基时更有助于反应快速进行.在DMSO中的EEP总体小于在DG溶剂中的EEP,说明海萤衍生物的化学发光反应决速步骤(1)在DMSO中比在DG中更快速,这点与实验报道[25]相一致.但在DG中,对不同取代基化合物的EEP比较发现,吲哚(b)取代物MIPb-最容易失去一个电子转化为自由基MIPb·,即EEP最小,反应较其他取代物更易进行,从而从理论上表明在类海萤环境DG下整个发光反应的决速步骤中吲哚取代时优先于其他取代MIP,并且b作为MIP分子的取代基时更接近海萤的原型[29-31],因此这是海萤在DG中发光效率比较高[27-28]的主要原因之一.

表2 反应物MIPa--MIPd-在不同介质中的HOMOLUMO能隙(ΔEH-L)Table 2 HOMO-LUMO energy gaps(ΔEH-L)for compounds MIPa--MIPd-in different media
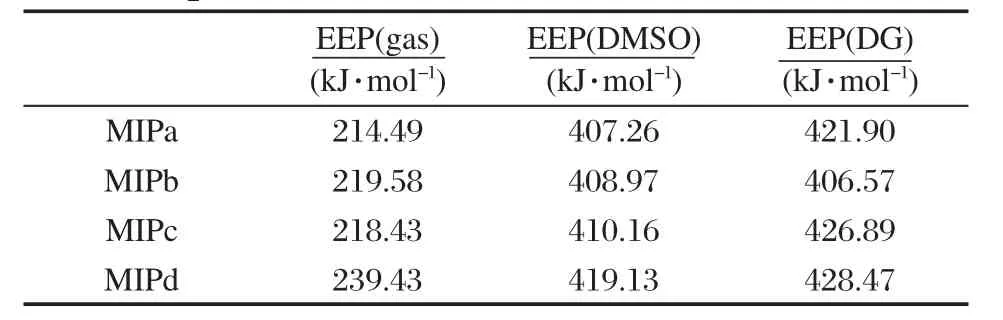
表3 MIPa-MIPd分子在不同介质中的电子抽取能(EEP)Table 3 Electron extraction potentials(EEP)for compounds MIPa-MIPd in different media
为了验证在不同溶剂中,对于反应过程MIP-→MIP·,咪唑并吡嗪酮环C6位上不同取代基Ar对决速步骤(1)的贡献作用,我们还比较了阴离子和自由基在各自最优构型下的能量差,结果列于表4.从表4中可以看出:取代基为a,b,c时的咪唑并吡嗪酮环的ΔE值一般都小于d,这说明给体取代时MIP-到MIP·这个过程中更容易进行.在DMSO中a,b,c取代物的ΔE值总体小于在DG中的ΔE,并且在DG中,吲哚取代(b)时能量差ΔE最小.这些结果与上面EEP计算结果一致,说明MIP自由基的弛豫能在非质子化溶剂中较小,可忽略,用EEP值可以判断不同取代基对这个反应的影响.
2.3 前线轨道及自然电荷布居分析
首先对四种取代基参与前线轨道的情况加以分析,所研究分子在气相和两种溶剂中的前线轨道用Gaussview软件绘出并示于图3中.
如图3所示,从LUMO轨道看,各种取代基的阴离子,其LUMO轨道在有溶剂和无溶剂参与时显示出特别明显的差别,LUMO在气相中基本由取代基组成,但在DMSO和DG中则完全由核结构MIP组成.而自由基分子的LUMO组成受溶剂影响不大,有无溶剂存在都完全由核结构MIP组成.由HOMO轨道看,气相中各种取代基参与轨道构成较小,只有在溶剂协助下,取代基才参与最高占据轨道的组成中.a,b,c三种给电子取代基在自由基分子的HOMO中所占成分远远大于吸电子取代基d,显然吸电子的苯唑呋喃基在MIP-→MIP·过程的活化作用不如其他三个给电子取代基.对于三个给电子基的活化自由基作用从轨道分布图上无法区分,需要进行电荷布居定量分析进行比较.

表4 MIPa-MIPd阴离子和自由基最优构型下的能量差Table 4 Energy differences between the optimized anions and free radicals for compounds MIPa-MIPd
利用自然键轨道(NBO)程序计算了MIPa、MIPb、MIPc分子中的原子布居数,采用自然电荷布居分析(NPA)法分析每一个原子的电荷,从而得到分子片段的电荷分布.分别对海萤核心结构的阴离子和自由基做了电荷布居分析,目的是研究MIP-→MIP·过程电荷转移的情况.
根据前面的计算,我们知道在DG中,在MIP-到MIP·这个过程中当吲哚(b)作为咪唑并吡嗪酮环C6位上的取代基时的EEP最小,其电子转移能力最强,在整个发光反应的决速步骤中起到了关键作用.在DG中咪唑并吡嗪酮环上C6位上的取代基是怎样影响中心环的电荷分布呢?我们对其进行了NBO计算分析,其结果示于图4.
其中的片段电荷是与取代芳基连接后海萤荧光素母体部分的电荷量.由图4可知,MIPa--MIPc-在DG中一个负电荷主要分布在中心环的三个N原子、酮基氧和甲基C上.离取代基最远端的N1、酮基O上聚集的电荷在b取代(MIPb-)时最多.b取代时,甲基C原子及酮基O上收集负电荷最多,失去一个负电荷变为MIP·时甲基C上获得负电荷(0.01895e)比a,c(0.01815e,0.01726e)取代时多,使得MIP·的2位C原子形成相对于MIP-更为缺电子的状态,利于O-·20的进攻.
图4也表现了MIP阴离子的静态诱导效应较强,导致酮基氧、甲基碳、N7位上和自由基C2上的电荷分布较多;MIP自由基的共轭效应增强,主要表现为C═O键长、取代基与MIP连接处的C—C6键长都变短.这样,从MIP阴离子到自由基过程中,酮基氧、N7和C2位上的电荷数变化相对其他原子要明显,尤其是酮基氧变化更加明显(见图4).在气相中从MIP阴离子到MIP自由基的过程中,MIPa-MIPc上C═O键长没有变化,但是在DG溶剂中时就发现当吲哚作为MIP取代基团时C═O键长相对其他取代基团变化大很多,而且b取代相对于a, c取代时整个MIP片段的电荷转移数最大,即b取代基对母体的影响最大,说明取代基为b时对这步反应过程起到了积极的作用.


MIP-到MIP·过程中咪唑并吡嗪酮环在DG溶剂中的电荷分布差值分别为0.88872e(a),0.90799e (b)和0.90321e(c).在溶剂DG中进行MIP-→MIP·的反应时,中心片段咪唑并吡嗪酮环(母体)的电荷差绝对值越大说明取代基给电子能力越强.因此,b和a,c相比是最好的给电子体.这个结果与电子抽取能的计算结论相一致.在MIP-→MIP·过程中,给电子基团吲哚取代基与咪唑并吡嗪酮环相连时单电子转移效率最大,促使反应MIP-→MIP·快速进行.
3 结 论
从理论上研究了海萤衍生物即以咪唑并吡嗪酮环为骨架,在C6位上用不同的芳基进行取代形成的一系列衍生物.对其发光反应的关键步骤中涉及的阴离子和自由基做了几何结构、键长变化、HOMOLUMO能隙分析、电子抽取能的计算和自然电荷布居分析.通过阴离子和自由基中的C—C6以及C═O键长分析表明,给电子基团与中心结构的π共轭相互作用都强于吸电子基团,并且溶剂效应增强了给电子基团与中心结构片段之间的相互作用.在DG中MIPb-的HOMO-LUMO能隙值变化比较大,吲哚作为咪唑并吡嗪酮环芳基(C6)位取代基时电子抽取能最小、阴离子和自由基之间的电荷差最大,表明在这种溶剂中其给电子能力增强、稳定性降低,更容易实现MIP-→MIP·这个过程,这对提高海荧类似物荧光效率起到了积极的作用.我们将在接下来的工作里研究海萤发光机理的全过程.总之,本研究从理论计算上验证了在DG这种溶剂中,咪唑并吡嗪酮环C6位的取代基为吲哚时类似海萤的原型,有较高的电荷转移效率和较低的HOMO-LUMO能隙和电子抽取能,增加海萤类似物发光反应过程的速率,有助于产生较高的发光效率.
1 Shimomura,O.;Goto,T.;Hirata,Y.Chem.Soc.Jpn.,1957,30: 929
2 Yang,Y.B.;Ji,S.M.;Zhou,F.K.;Zhao,J.Z.Biosensors and Bioelectronics,2009,24:3442
3 Wu,C.;Kawasaki,K.Anal.Chem.,2007,79:1634
4 Tan,D.J.;Gu,R.X.Food and Machinery,1994,3:25 [谭道经,顾瑞霞.食品与机械,1994,3:25]
5 Hu,Z.;Yin,J.G.;Jiang,N.;Chen,Q.J.Chin.J.Vet.Sci.,2008, 28:732 [胡 哲,尹继刚,姜 宁,陈启军.中国兽医学报, 2008,28:732]
6 Lin,H.Envi.Sci.,1981,6:67 [林 海.环境科学,1981,6:67]
7 Yang,X.L.Continuing Medical Education,2007,21:56 [杨晓林.继续医学教育,2007,21:56]
8 Zhang,J.C.;Wang,D.Y.Modern photochemistry.Beijing: Beijing Industry Press,2006:319-320 [张建成,王夺元.现代光化学.北京:北京工业出版社,2006:319-320]
9 Katsunori,T.Bioorg.Chem.,2007,35:82
10 Shimomura,O.;Johnson,F.H.;Masugi,T.Nature,1969,164: 1299
11 Shimomura,O.;Johnson,F.H.Methods Enzymol.,1978,57:331
12 Kishi,Y.;Goto,T.;Hirata,Y.;Shimomura,O.;Johnson,F.H. Tetrahedron Lett.,1966,7:3427
13 Kishi,Y.;Goto,T.;Inoue,S.;Sugiura,S.;Kishimoto,H. Tetrahedron Lett.,1966,7:3445
14 Takahashi,Y.;Kondo,H.;Maki,S.;Niwa,H.;Hiroshi,I.;Takashi, H.Tetrahedron Lett.,2006,47:6057
15 Kondo,H.;Igarashi,T.;Maki,S.;Niwa,H.;Ikeda,H.;Hirano,T. Tetrahedron Lett.,2005,46:7701
16 Hohenberg,P.;Kohn,W.Phys.Rev.B,1964,136:864
17 Kohn,W.;Sham,L.J.Phys.Rev.A,1965,140:1133
18 Becke,A.D.Phys.Rev.A,1988,38:3098
19 Becke,A.D.J.Chem.Phys.,1993,98:5648
20 Lee,C.;Yang,W.;Parr,R.G.Phys.Rev.B,1988,37:785
21 Navizet,I.;Liu,Y.J.;Ferre,N.;Xiao,H.Y.;Fang,W.H.;Lindh, R.J.Am.Chem.Soc.,2010,132:706
22 Min,C.G.;Ren,A.M.;Guo,J.F.;Li,Z.W.;Zou,L.Y.;Goddard, J.D.;Feng,J.K.ChemPhysChem,2010,11:251
23 Frisch,M.J.;Trucks,G.W.;Schlegel,H.B.;et al.Gaussian 03. Revision B.01.Pittsburgh,PA:Gaussian Inc.,2003
24 Mennucci,B.;Tomasi,J.J.Chem.Phys.,1997,106:5151
25 Hirano,T.;Takahashi,Y.;Kondo,H.;Maki,S.;Kojima,S.; Hiroshi,I.;Haruki,N.Photochem.Photobiol.Sci.,2008,7:197
26 Okajima,T.;Tokuda,K.;Ohsaka,T.Bioelectrochem.Bioenerg., 1996,41:205
27 Goto,T.Pure Appl.Chem.,1968,17:421
28 Johnso,F.H.;Satchel,H.D.;Taylor,E.C.;Shimomura,O. Chemiluminescence and fluorescence of cypridina luciferin and of some new indole compounds in dimethylsufoxide//Bioluminescence in Progress.Princeton:Princeton University Press,1966:67
29 Goto,T.;Inoue,S.;Sugiura,S.;Nishikawa,K.;Isobe,M.;Abe,Y. Tetrahedron Lett.,1968,37:4035
30 Toya,Y.;Kayano,T.;Sato,K.;Goto,Y.Chem.Soc.Jpn.,1992, 65:2475
31 Nakamura,H.;Aizawa,M.;Takeuchi,D.;Murai,A.;Shimomura, O.Tetrahedron Lett.,2000,41:2185
Theoretical Investigation of the Key Reaction for the Chemiluminescence of Cypridina Luciferin Analogues
SUN Ying REN Ai-Min*MIN Chun-Gang ZOU Lu-Yi REN Xue-Feng
(State Key Laboratory of Theoretical and Computational Chemistry,Institute of Theoretical Chemistry,Jilin University, Changchun 130023,P.R.China)
A series of 6-aryl-2-methylimidazo[1,2-α]pyrazin-3-(7H)-ketone based derivatives MIPa-MIPd(cypridina luciferin analogues)were investigated using the B3LYP/6-311+G(d,p)method,and we modeled a 6-site replacement by different substituents.The effect of different substitutions on cypridina luciferin analogues in their transition from anions to free radicals was studied by electron extraction potentials(EEP)and natural charge population analysis(NPA) in gas phase,dimethyl sulfoxide(DMSO),and diglyme(DG).The calculated results indicated that MIPb(3-indolyl as the substituent)had a lower EEP and a larger natural charge population change occurred at the MIP moiety in DG when transitioning from the anion to its free radical than in the other solvents.We also showed that 3-indolyl,as a substituent,accelerated the luminescent reaction of MIP.
Density functional theory; Cypridina luciferin; Chemiluminescence; Electron extraction potential; Natural charge population analysis
O641
Received:June 7,2010;Revised:July 17,2010;Published on Web:September 3,2010.
*Corresponding author.Email:aimin_ren@yahoo.com;Tel:+86-431-88498567.
The project was supported by the National Natural Science Foundation of China(20673045,20973078),Start Fund for Returned Overseas People, China((2008)890),and Major State Basic Research Development Program of China(973)(2002CBN613406).
国家自然科学基金(20673045,20973078),留学回国人员启动基金(外交司留(2008)890号)和国家重点基础研究发展计划项目(973)
(2002CBN613406)资助
ⒸEditorial office of Acta Physico-Chimica Sinica
