再生水环境中304不锈钢生物膜腐蚀电化学特征
2010-11-06许兆义李久义
李 进 许兆义 李久义 焦 迪
(北京交通大学市政与环境工程系,北京 100044)
再生水环境中304不锈钢生物膜腐蚀电化学特征
李 进*许兆义 李久义 焦 迪
(北京交通大学市政与环境工程系,北京 100044)
研究了以再生水作为循环冷却系统补水的北京某热电厂冷却塔底粘泥中分离纯化培养出来的硫酸盐还原菌(SRB)生长特性.采用原子力显微镜(AFM)、扫描电镜(SEM)、能谱分析仪(EDS)和电化学交流阻抗(EIS)方法研究了304不锈钢(SS304)表面生物膜特征及其主要成分和不锈钢/生物膜界面电化学行为.结果显示,再生水环境下304不锈钢表面形成的生物膜是由吸附的SRB菌体及以含碳有机物为主的胞外聚合物和FeS腐蚀产物构成.浸泡前期(前7 d)SS304电极表面阻抗值主要由SS304表面钝化膜的贡献;浸泡后期(14 d后),电极体系阻抗值由不锈钢表面钝化膜和生物膜共同贡献.
再生水;304不锈钢; 硫酸盐还原菌; 生物膜; 原子力显微镜; 交流阻抗谱
将城市再生水作为发电厂工业循环冷却系统的补充水对节约水资源具有重大的意义.但是污水再生回用仍存在着一些问题:就再生水而言,其浊度、化学耗氧量(COD)、有害离子、总含盐量和微生物等水质指标均高于各种淡水的用水标准,这些物质在循环冷却水系统中经过生物化学反应可能形成大量粘泥沉积于管壁.在厌氧条件下,硫酸盐还原菌(SRB)大量繁殖,产生粘液物质,加速垢的形成.当金属表面有微生物存在时,将进行特殊的生物化学反应,改变金属表面的物理、化学性质,促进粘泥下微生物腐蚀[1].
由于再生水的推广使用,国内许多新建电厂采用不锈钢材料作为凝汽器的管材,以减缓设备的失效.然而不锈钢对SRB、Cl-和还原性硫化物引起的局部腐蚀非常敏感[2-3].
微生物细菌吸附到不锈钢表面是生物膜形成的第一步,在缺氧条件下硫酸盐还原菌能够在不锈钢表面上形成生物膜.研究表明生物膜是由细菌和它们的胞外聚合物以及腐蚀产物组成的[4].在生物膜中,微生物生活在一个与自由悬浮状完全不同的微生态环境中,微生物大体上是不动的,被包藏于水化的有机质中.微生物不仅可将水中组分转变成不溶性的生物质,使之沉积于固体表面,而且还可将本身并不沉积的物质带到表面上而形成污垢,为厌氧腐蚀提供场所.微生物附着于金属表面后,由于新陈代谢活动产生了胞外聚合物质(EPS).EPS中含有多糖、蛋白质、核酸等物质[4].EPS对生物膜的结构完整性起主要作用.生物膜结构和形态对不锈钢腐蚀有显著影响[5],如多孔生物膜不仅可以捕获细菌分泌的代谢产物,还可以使不锈钢表面溶液组分浓度,pH值和氧浓度在局部发生较大的改变,形成浓度梯度[6],导致金属表面的局部腐蚀.而含硫化物致密的生物膜在某些情况下对金属表面具有保护作用[7-8].微生物腐蚀的关键在于生物膜与金属基体间的相互作用[9-11].
不锈钢基质表面状态以及表面生物膜结构对不锈钢合金钝化膜点蚀的发生和发展有很大关系.本工作的目的是应用AFM、SEM和EDS表面分析技术定性和定量地研究再生水环境下SS304表面生物膜结构的形态;采用电化学阻抗谱研究SS304 SRB生物膜界面的电化学腐蚀特性.
1 材料与方法
1.1 实验菌种与培养
实验菌种取自以再生水作为循环冷却系统补水的北京某热电厂冷却塔底粘泥,将5 g粘泥加入到45 mL无菌水中,充分振荡、静置,取上层清液,即粘泥浸出液.将浸出液接入分离富集培养基中进行厌氧培养.采用稀释涂布-叠皿夹层培养法分离、纯化菌种,重复分离纯化2-3次,获得可以转接、保存的纯种SRB,4℃以下保存在冰箱中作为实验用菌种.
实验采用修正的Postgate B、Postgate C[12]两种液体培养基和修正的Postgate E固体培养基.修正的Postgate B培养基用于SRB菌种的富集培养,修正的Postgate E固体培养基主要用于SRB菌种的分离提纯.
实验用培养基采用Postgate C培养基,其成分为KH2PO40.50 g,NH4Cl 1.0 g,CaCl2·2H2O 0.060 g, Na2SO44.5 g,MgSO4·7H2O 0.060 g,乳酸钠(80%)6 mL,酵母浸膏1.0 g,FeSO4·7H2O 0.0040 g,柠檬酸钠0.30 g,蒸馏水1000 mL,用HCl和NaOH(0.05 mol·L-1)调节pH在7.0-7.2范围内,在0.14 MPa灭菌锅中消毒20 min,快速冷却后加入经紫外线消毒30 min的半胱酸胺盐酸盐和抗坏血酸.
冷藏的菌种使用时需要活化.将冷藏的菌种置于培养箱中于(37±1)℃恒温2 h,移取20 mL菌种接种到灭菌的300 mL碘量瓶中,加入灭菌的培养基至瓶口.通氮气10 min赶走培养基中的溶解氧,塞好瓶塞,使用液体石蜡将口密封.将接种的培养基放入恒温培养箱中于(37±1)℃恒温培养,24 h后若培养基变成黑色,即为所需要的具有一定活性的菌种.
硫酸盐还原菌的检测由于SRB可以将SO2-4还原,生成H2S气体,把浸有AgNO3液体的试纸条置于液体培养基瓶口,Ag+遇到H2S发生化学反应,试纸条慢慢从边缘向内变黑,证明存在SRB;如果3 min内(时间长了,空气中的氧气会把Ag离子氧化变黑)试纸没有变黑,就表明没有硫化氢产生,不存在SRB.
实验中所用的培养基、无菌水等在121℃、0.14 MPa压力下,经高压蒸汽锅灭菌20 min;培养皿、移液管等用具采用干热灭菌;且实验相关操作均在经紫外灭菌过的无菌操作台中进行.实验中所用化学试剂均为分析纯试剂,所用水为三级水.
1.2 实验用水
将具有活性的SRB接种于实验用再生水中,以考察SRB在再生水中生长特性.实验用再生水取自发电厂循环冷却系统,其水质见表1.
1.3 不锈钢试片的制备
实验材料选用304不锈钢管材,用以研究再生水环境下304不锈钢表面SRB生物膜形成与发展特性.材料主要成分质量分数:C为0.040%,Si为0.40%,Mn为1.0%,P为0.030%,S为0.0040%,Cr为18.1%,Ni为8.1%,其余为Fe.
将304不锈钢管材加工成面积为1 cm2的圆形试片,用耐水砂纸逐级打磨至1200#,再用0.5 μm的金刚石研磨膏抛光.之后用丙酮除油,无水乙醇脱水,备用.
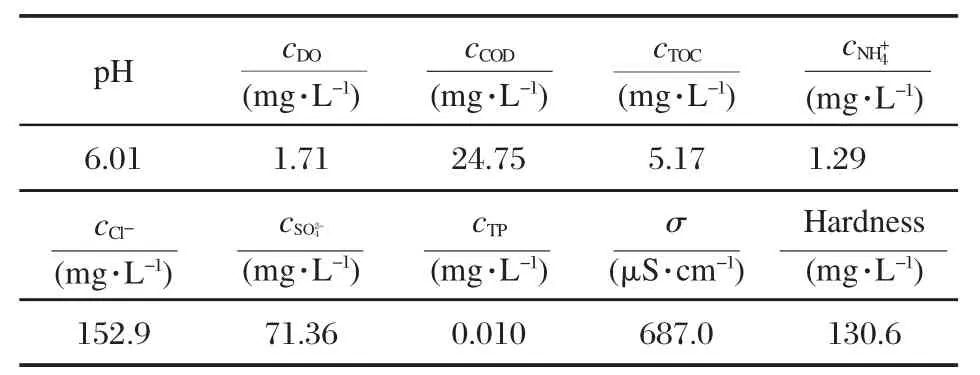
表1 发电厂循环冷却系统的再生水水质Table 1 Quality analysis of reclaimed water from power plant
1.4 试样表面分析
取纯化的SRB菌液,采用真空抽滤泵经2.5 μm的微孔滤膜过滤.将截留在微孔滤膜上的细菌溶在一定量的无菌水中,配成细菌悬液.滴加一滴于碳膜铜网上,近干燥时,用2%磷钨酸溶液滴加在样品上进行染色1-2 min,自然干燥后,在HITACHI H-800型(日本)透射电子显微镜下观察SRB形态.
SRB为革兰氏染色阴性.通过革兰氏染色[13],使用COIC XSZ-3G光学显微镜(重庆光电仪器有限公司)观察细菌是否为革兰氏染色阴性.
应用日本SHIMADZU公司SPM-9500J3型扫描探针显微镜即原子力显微镜(AFM)和LEICAS440i型(德国)电子扫描显微镜(SEM)以及能谱分析仪(EDS)对试片表面生物膜的特征、成分和膜下腐蚀形貌进行定性和定量分析.将接种了SRB的再生水置入广口瓶,并充氮气20 min以驱赶氧气,然后将经过灭菌处理的不锈钢试片置入该再生水中,并将瓶口密封放入生化培养箱中,在(37±1)℃恒温条件下厌氧培养.经浸泡不同时间将304不锈钢试片取出,用无菌水轻轻清洗表面,然后用2.5%戊二醛在4℃下固定2 h,用磷酸缓冲溶液和无菌水分别清洗干净,在空气中自然干燥后备用.另准备一组样品,用超声波清洗机去除掉表面生物膜后对膜下腐蚀形貌进行观察.
AFM采用接触式扫描模式,探针由氮化硅制成,弹性系数0.16 N·m-1,最大扫描范围30 μm×30 μm,扫描频率 0.5 Hz.使用 AFM自带 SPM-offline2.2软件对试片表面粗糙度进行分析.表面粗糙度可定量地反映试片表面形成生物膜的厚度、均匀程度和腐蚀程度等特征.本实验中的粗造度以均方根粗糙度(RMS)表示,即使试片表面各点相对于零平面的高度数值的均方根.
1.5 电化学测试
在制备好的SS304试片背后焊接导线,用环氧树脂密封在塑料圆环内,制成电极.用耐水砂纸逐级打磨至1200#,再用0.5 μm的金刚石研磨膏抛光,之后用丙酮和无水乙醇擦洗干净,用来研究再生水环境下304不锈钢/SRB生物膜界面电化学特性.电化学测试采用三电极系统,工作电极由304不锈钢材料制成,参比电极为饱和甘汞电极(SCE),辅助电极为铂电极.
不锈钢电极在含SRB再生水中浸泡过程同1.4节所述.分别在浸泡1、3、7、14和20 d时取出电极,测定304不锈钢电极的电化学阻抗谱.另准备一组在无菌再生水中浸泡的电极,作为空白对照.交流阻抗谱的测定采用美国EG&G公司的273A恒电位仪测试系统以及M398软件.测定频率范围为0.05 Hz-100 kHz,正弦电压信号幅值为5 mV,在37℃恒温条件下测定.
2 实验结果与分析
2.1 硫酸盐还原菌形貌与生长规律
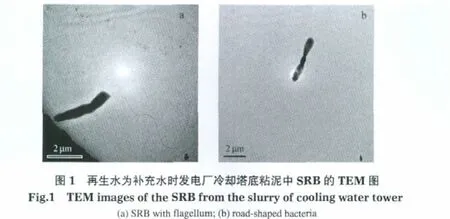
将接种SRB的培养基于(37±1)℃下恒温培养14 d后,取出处理后,采用TEM观察到的SRB形貌见图1.发电厂循环冷却塔底粘泥中SRB的细胞形状基本为细小杆状,具有鞭毛.经革兰氏染色检测,为革兰氏染色阴性.
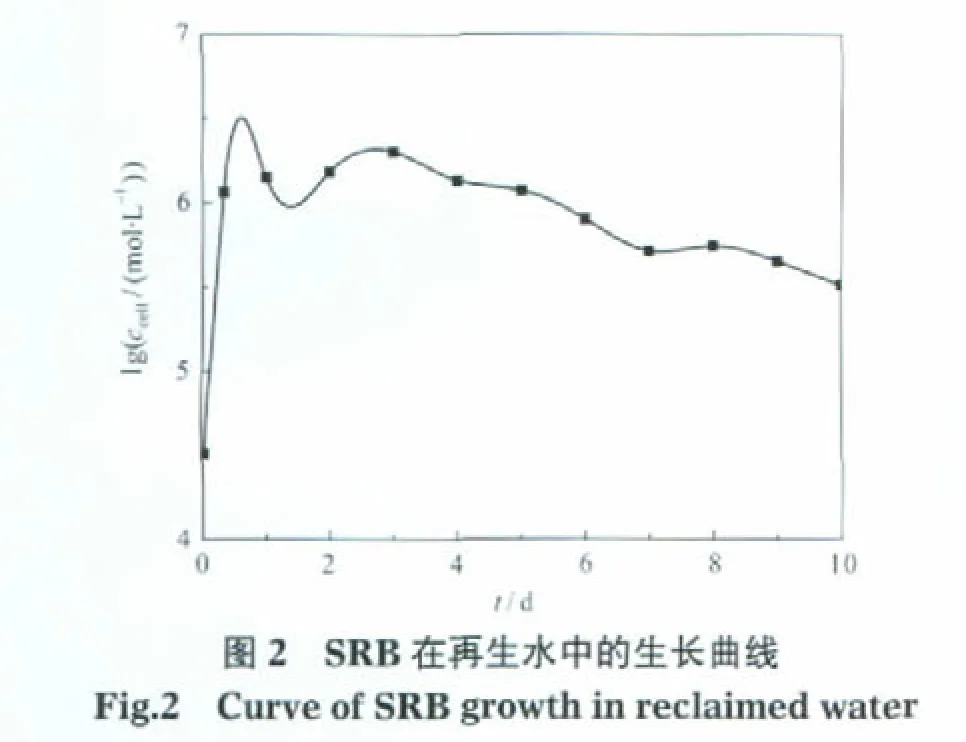
SRB在再生水中生长规律如图2所示.由图2可以看出SRB的生长分为三个阶段.0-8 h为指数生长期,细胞新陈代谢活动旺盛,细菌数量增加了近2个量级.8 h-3 d为稳定生长期,细菌活性保持在较高水平,代谢活动稳定.在3 d时细菌数量达到峰值2.0×106mL-1.3-10 d为衰亡期,细菌数量逐渐减少.结果表明在再生水环境下,SRB可以在相对长的时间内稳定生长.
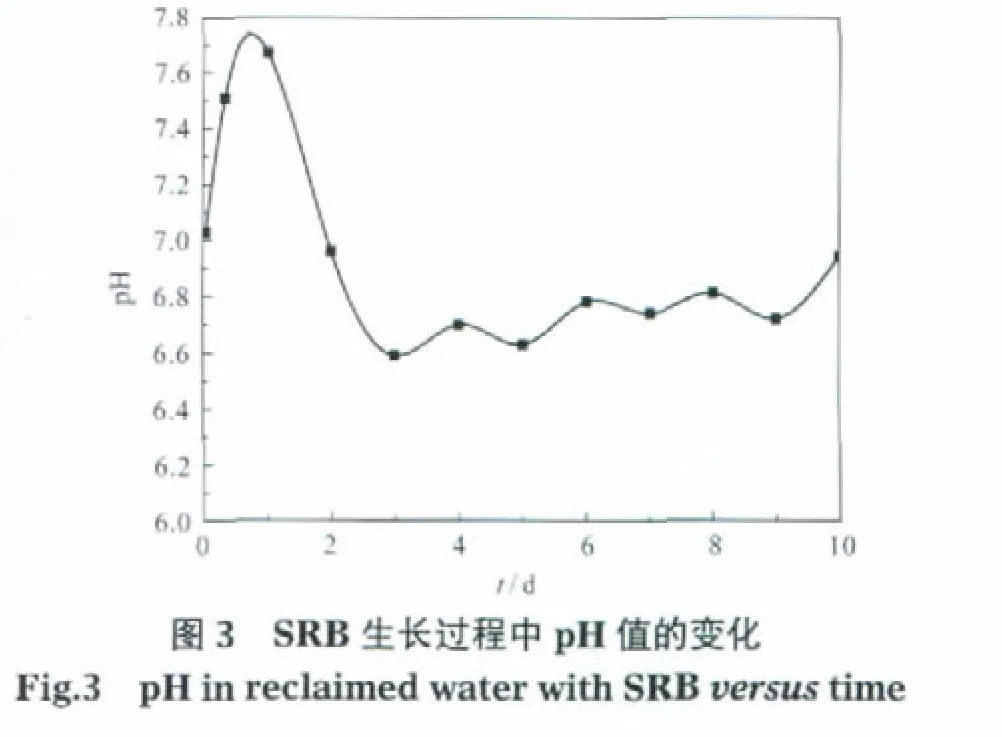
图3显示了介质pH值随SRB生长时间的变化规律.pH值从接种SRB 1 h的7.03逐渐增大到1 d的7.67,随后迅速降低.3 d时pH值降到最小值6.59,之后基本维持在6.70-6.80.对应图2中SRB的生长曲线可以看出,在SRB指数生长期,介质pH值升高;在稳定生长期内pH值下降.这种现象与SRB的代谢活性有关.氢化酶的阴极去极化理论[14]认为,SRB含有一种氢化酶,它能利用在阴极区产生的氢离子将硫酸盐还原成H2S或硫化物,化学反应如式(1)-(3)[15].

SRB处于生长对数期时,细胞代谢旺盛,硫酸盐还原菌的活性强,生成的S2-多,H+被消耗的就多,从而导致pH值升高.当SRB处在稳定生长期时, SRB新陈代谢产生的H2S和有机酸不断积累,使得pH值降低.
2.2 不锈钢表面SRB生物膜特性
图4为AFM观察的304不锈钢试片的原始表面和在接种SRB的再生水中浸泡1、7和14 d后试片表面形貌.相应浸泡时间试片表面SEM图像(图5)的EDS成分分析见表2.
从图4a可以看出,浸泡前试片表面很光滑,仅有抛光留下的印痕.应用SPM-offline 2.2软件进行表面粗糙度分析知,浸泡前304不锈钢试片表面的均方根粗糙度(RMS)值为(8.61±2.1)nm.而在含SRB的再生水中浸泡后,试片表面形貌显著改变.SRB首先以单个细菌的形式在试片表面附着,随后逐步以菌落的形式形成生物膜.浸泡1 d时,试片表面有少量的SRB附着(图4b).7 d时吸附的SRB量增多(图4c),EDS分析(表2)显示有少量的S元素出现,质量分数为0.23%.说明此阶段SRB还原SO2-4生成的具有还原性的S出现在不锈钢基体表面.14 d时试片表面生物膜基本形成(图4d),生物膜厚度(同样用RMS值表示)为(222.9±16.06)nm.此阶段,由表2分析可知,S元素含量从7 d时的0.23%升高到3.14%;此外,试片表面C元素出现,质量分数达到65.52%,远大于其基体的C含量,这可能是SRB代谢活动产生的以含碳为主的胞外聚合物(EPS)等有机物质引起的;而金属元素Fe、Cr、Ni和Mn的含量变化,表明基体表面溶解的金属离子逐渐扩散进入生物膜层,且含量随膜层厚度增加逐渐降低.
试片表面S元素含量主要源于在厌氧条件下, SRB利用硫酸盐作为电子受体将其还原为H2S或硫化物的过程.Marcus[16]研究指出,S2-是加速金属溶解的催化剂,它可以减弱金属键之间的结合,降低反应的活化能.研究者[17-18]证实了H2S为阴极还原反应,可加速金属的腐蚀速率,当有二价铁离子存在时,形成二价铁的硫化物沉积在金属表面[19],反应如式(4)和(5)所示. S2-与溶解下来的Fe2+迅速结合,并以FeS沉积物的形式离开金属表面,此过程促进了阳极去极化作用.FeS在电极表面逐渐沉积,与吸附在电极表面的SRB菌体及细菌胞外聚合物共同形成生物膜.
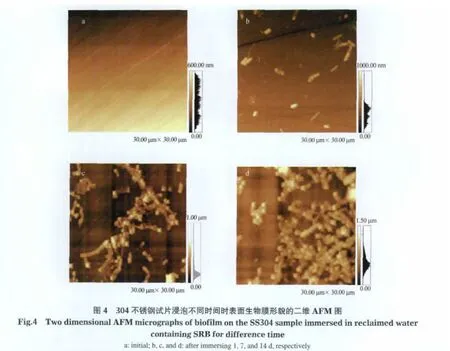

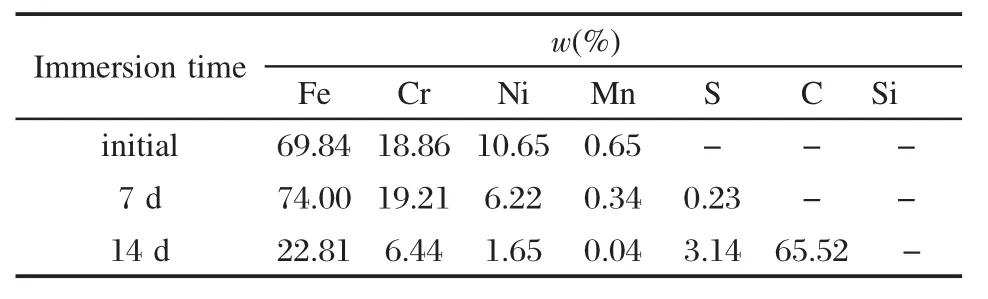
表2 浸泡不同时间试片表面成分分析Table 2 Composition analysis on the SS304 surface for different immersion time


生物膜中C含量的增加间接地反映出,随时间推移,吸附到试片表面的SRB数量逐渐增多,SRB代谢产生的以含碳为主的胞外聚合物(EPS)及有机酸含量增加.EPS不仅对生物膜结构的完整性起至关重要的作用,而且它还可以直接参与金属腐蚀溶解过程[20].EPS中所含有的—NH、—COOH、—OH官能团具有捕获许多高价金属离子(如Ca2+、Mg2+、Cu2+和Fe3+)的能力[21],它对金属的生物膜腐蚀产生重要影响[22-23].不锈钢材料一旦发生点蚀,EPS通过捕获溶解的金属离子,形成Men+(EPS)[21]的络合物,加速不锈钢材料的溶解.这个溶解过程意味着不锈钢材料遭受到了生物膜的腐蚀.正如实验结果所示,随试片表面S和C元素含量增加,304不锈钢基体金属原子逐渐溶解并扩散进入生物膜层中.
图6为浸泡14 d去掉表面生物膜后304不锈钢试片表面腐蚀形貌.
浸泡14 d去掉生物膜后,304不锈钢试片表面整体依然比较平整光滑,但在局部有明显的蚀坑(图6(a,b)),蚀坑最深处为541.2 nm,局部腐蚀速率相当于每年0.014 mm.SRB生物膜对不锈钢的腐蚀主要为点蚀特征.
2.3 304不锈钢/SRB生物膜界面电化学特性
图7和图8是304不锈钢电极在无菌再生水(作为参照系)和接种SRB的再生水中浸泡不同时间的Nyquist和Bode图.


从图7中可以看出,304不锈钢电极在无菌再生水和接种SRB的再生水体系中电极容抗弧随浸泡时间延长不断减小,容抗弧半径减小意味着电极表面阻抗值降低.1-7 d浸泡期间,两个体系中304不锈钢电极的Nyquist图均显示近1/4圆弧,表明电极阻抗值较大,电极表面溶解速率较低.此阶段,在有菌介质中已观察到电极表面有SRB吸附(图4(b, c)),但还未形成完整的生物膜层.两个体系的电极阻抗值主要来自于表面钝化膜的贡献,电极表面的电极过程为活化极化控制.浸泡14 d,两个体系的容抗弧显示为半圆,容抗弧半径显著下降;20 d时,无菌体系电极容抗弧半径与14 d相比下降不多;而有菌体系电极容抗弧半径远远小于14 d时的容抗弧半径,且小于无菌体系的容抗弧半径.这表明电极表面钝化膜局部受损,引起电极阻抗值大大降低.浸泡14 d后,生物膜在电极表面基本形成(图4 d),在生物膜下SRB以硫酸盐为电子受体将其还原为硫化物如H2S以及生物代谢产生的有机酸,降低了电极表面局部环境的pH(pH<6.7)值,破坏了不锈钢表面的钝化膜层.一般认为不锈钢表面的钝化膜由两部分组成[24],内层以铬的氧化物为主,称阻挡层,是产生钝化的主要部分;外层主要以铁的氧化物和氢氧化物为主.当溶液显酸性,即pH较低(pH<7)时,可能会加速外层氢氧化物以及铁的氧化物的溶解导致不锈钢的腐蚀.
从图8来看,304不锈钢电极在无菌和有菌介质中的相角图有不同的变化.相角-频率曲线中相位角峰值即时间常数位于中高频区时,与电极表面氧化膜的电化学响应有关;相位角峰值出现在低频区时则与生物膜的生长和稳定性有关.浸泡1 d后,在无菌体系中,304不锈钢电极的相角-频率曲线相角峰值位于高中频区,随时间推移,相角峰值和低频端相角值有所降低,特别是浸泡14-20 d时,低频端相角值显著降低,表明304不锈钢电极表面钝化膜受到再生水中Cl-等无机阴离子的侵蚀.而在有菌体系浸泡1 d,304不锈钢电极的相角-频率曲线相角峰值位于中低频区;随时间推移,相角峰值向低频端稍有移动,且低频端相角值逐渐降低,这与生物膜的生长特性有关;浸泡14-20 d,相角-频率曲线中相角峰值显著下降,预示不锈钢表面的钝化膜受到破坏;高频端相角值增加,这可能与具有半导体性质的FeS腐蚀产物形成的异质相有关系.
采用图9中两个等效电路对有菌体系的交流阻抗图谱进行拟合.由于浸泡前期(前7 d)生物膜还不完整,电极体系Bode中只显示一个时间常数,故采用图9(a)等效电路对浸泡1 h到7 d的交流阻抗谱进行拟合;浸泡后期(14 d后),电极表面由钝化膜层和生物膜层构成,应为两个时间常数,所以采用图9 (b)等效电路拟合14和20 d的交流阻抗谱.
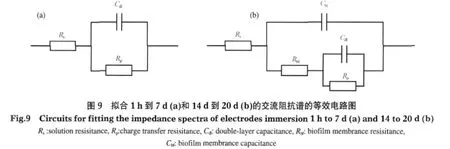
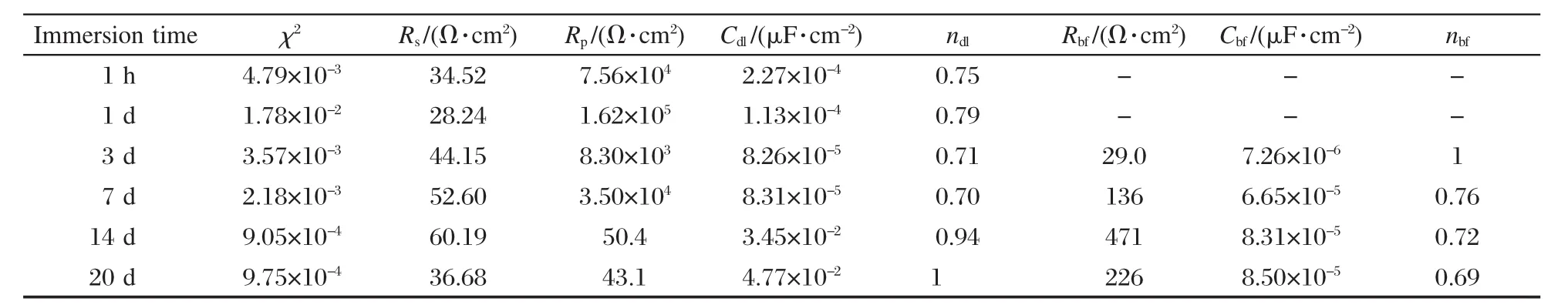
表3 有菌体系中304不锈钢电极交流阻抗谱的拟合参数值Table 3 Fitted parameters for EIS spectra of SS 304 electrodes exposed in reclaimed water with SRB for different time
对有菌体系304不锈钢电极的交流阻抗谱拟合结果见表3.表中卡方检验值χ2是最常用的拟合度指标,若检验结果差异不显著且χ2值越接近于零,则表明模型拟合程度越好.由表3可知,对304不锈钢电极交流阻抗谱拟合的 χ2值均在 9.75×10-4-1.78×10-2范围,表明拟合数据与实验数据吻合较好.
在整个浸泡期间,有菌体系的溶液电阻Rs值变化不大,在28.24-60.19 Ω·cm2范围内,表明溶液导电性良好.
钝化膜极化电阻Rp的变化意味着腐蚀过程中电荷转移的难易程度,电容值Cdl的变化主要与双电层的介电性能及电极表面粗糙度相关,双电层电容可以表示为Cdl=ζκαA/d,其中ζ是真空电容率,κ是介质的介电常数,A是电极表面积,d是电容极板间距,α是电极表面粗糙度.浸泡前7 d,304不锈钢电极的极化电阻Rp较大,在1.62×105-8.30×103Ω· cm2范围内变化,表明此期间304不锈钢电极表面钝化膜耐蚀性良好;14 d时,极化电阻Rp显著下降,降到50.4 Ω·cm2.这意味着电极表面钝化膜可能出现点蚀,使腐蚀电荷转移变得容易.同时,钝化膜电容值Cdl随着浸泡时间逐渐变大,从7 d时的8.31× 10-5μF·cm-2增大到 14 d时的3.45×10-2μF·cm-2,电容值明显增大可能的原因有,其一是电极表面出现点蚀,使钝化膜变得粗糙,引起电极表面双电层电容增加;其二是双电层间介电常数增加,具有半导体性质的硫化铁的生成是介电常数增加的原因.根据反应(4)和(5),此阶段,由于生物膜下SRB腐蚀,产生的硫铁化物在电极表面形成异质相,引起双电层间介电常数的增加.
SRB及其代谢产物和腐蚀产物等在电极表面形成的生物膜,其电化学行为类似一个电容,其阻抗反应用生物膜电阻Rbf和电容Cbf表示.浸泡前14 d,随浸泡时间延长,304不锈钢电极的电阻Rbf和Cbf值逐渐增加,表明电极表面生物膜逐渐发展并趋于完整.而20 d时,304不锈钢电极的Rbf值下降,这可能与SRB的脱附使生物膜变得疏松有关.
浸泡前7 d,304不锈钢电极的钝化膜极化电阻Rp值远远大于电极表面生物膜电阻Rbf,显示此阶段304不锈钢电极表面的电化学过程应为活化极化控制,而浸泡14 d后,由电极/生物膜界面电化学参数变化可知,304不锈钢电极表面生物膜电阻Rbf值大于其钝化膜极化电阻Rp,说明304不锈钢电极表面生物膜对基质和腐蚀产物扩散的阻碍作用有所显现,由此推测此阶段电极反应过程是受活化极化和扩散步骤共同控制.
3 结 论
(1)从北京某热电厂冷却水塔塔底粘泥中分离得到的硫酸盐还原菌在实验所用再生水环境中可以繁殖生长.
(2)在304不锈钢表面SRB优先选择单层排列吸附,然后逐渐聚集形成菌落.在再生水环境下,304不锈钢表面形成的生物膜是由吸附的SRB菌体及以含碳有机物为主的胞外聚合物和腐蚀产物FeS构成的.随着浸泡时间延长,304不锈钢表面由SRB代谢产生的S和C含量增加.
(3)在浸泡前期(前7 d),304不锈钢电极表面阻抗值主要来源于304不锈钢表面钝化膜的贡献,电极表面的电化学反应过程主要受活化极化控制;浸泡后期(14 d后),生物膜在电极表面形成,电极体系阻抗值由不锈钢表面钝化膜和生物膜共同贡献,电极表面的电化学反应过程受活化极化和扩散步骤控制.
1 Beech,I.B.;Sunner,J.Biocorrosion,2004,15:181
2 Moreno,D.A.;Ibars,J.R.;Ranninger,C.;Videla,H.A.Corrosion,1992,48(3):226
3 Stott,J.F.D.Corrosion Sci.,1993,35:667
4 Wingender,J.;Neu,T.R.;Flemming,H.C.Microbial extracellular polymerics substances:characterisation,structure and function. Berlin:Springer Press,1999
5 Sheng,X.X.;Ting,Y.P.;Pehkonen,S.O.Corrosion Sci.,2007, 49:2159
6 Dexter,S.C.Corrosion test and standard:application and interpretation.In:Baboian,R.ASTM.Philadephia:PA,1995
7 Dubiel,M.;Hsu,C.H.;Chien,C.C.;Mansfeld,F.;Newman,D.F. Appl.Environ.Microbiol.,2002,19(1):65
8 Gonza′lez,J.E.G.;Santana,F.J.H.;Mirza-Rosca,J.C.Corrosion Sci.,1998,40:2141
9 Buchanan,R.A.;Stansbury,E.E.Fundamentals of coupled electrochemical reactions as related to microbially influenced corrosion[C]//Dowling,N.J.;Mittleman,M.W.;Danko,J.C. Microbially influenced corrosion and biodeterioration.Knoxville: TN,1991:5,33
10 Videla,H.A.;de Mele,M.F.L.;Brankevich,G.J.Biofouling and corrosion of stainless steel and 70/30 copper nickel samples after several weeks of immersion in seawater[C]//Videla,H.NACE International,Houston,1989
11 Videla,H.A.Int.Biodeterior.Biodegrad.,2001,48:176
12 Postgate,J.R.The sulfate reducing bacteria.Cambridge:CU Press, 1984
13 Ma,F.;Ren,N.Q.;Yang,J.X.Pollution control microbiology experiment.Harbin:Harbin Institute of Technology Press,2002 [马 放,任南琪,杨基先.污染控制微生物学实验.哈尔滨:哈尔滨工业大学出版社,2002]
14 Hardy,J.A.Br.Corros.J.,1983,18(4):190
15 von Wolzogen Kukr,C.A.H.;van Vlugt,L.S.Water,1934,18: 147
16 Marcus,P.Electrochim.Acta,1998,43(1-2):109
17 Little,B.;Wagner,P.Electrochim.Acta,1992,37(12):2185
18 Sanders,P.F.;Hamilton,W.A.Biological and corrosion activities of sulphate——reducing bacteria within natural biofilms[C]// Dexter,S.C.Biologically induced corrosion.NACE International, Houston:TX,1986:47
19 Beech,I.B.Microbiol.Today,2003,30:115
20 Fang,H.H.P.;Xu,L.C.;Chan,K.Y.Water Res.,2002,36:4709
21 Beech,I.B.;Sunner,J.Curr.Opin.Biotechnol.,2004,15(3):181
22 Kinzler,K.;Gehrke,T.;Telegdi,J.;Sand,W.Hydrometall,2003, 71:83
23 Rohwerder,T.;Gehrke,T.;Kinzler,K.;Sand,W.Appl.Microbiol. Biotechnol.,2003,63:239
24 Chler,S.M.;Vogel,A.;Mathiece,H.J.Corrosion Sci.,1991,32: 925
Characteristics of the Microbiologically Influenced Corrosion of 304 Stainless Steel in Reclaimed Water Enviroment
LI Jin*XU Zhao-Yi LI Jiu-Yi JIAO Di
(Department of Municipal and Environmental Engineering,Beijing JiaoTong University,Beijing 100044,P.R.China)
The growth characteristics of sulfate reducing bacteria(SRB)in real reclaimed water were studied. Characteristics of the biofilm and its main components on the surface of stainless steel 304(SS304)sample immersed in reclaimed water with SRB,the electrochemical behavior of the interface between the SS304 sample and the biofilm were investigated using atomic force microscopy(AFM),scanning electron microscopy(SEM),energy disperse spectroscopy(EDS),and electrochemical impedance spectroscopy(EIS).The results show that this strain of SRB can survive in reclaimed water.A biofilm formed on the surface of SS304 and consisted of microbial cells,a carbohydrate component from extracellular polymeric substances(EPS)and a corrosion product such as FeS.During the early immersion period (before 7d),the impedance value mainly originated from the contribution of passivation film on the SS304 electrode surface.During the later immersion period(after 14 d),the impedance value was mainly due to the combined effect of the passivation film and the biofilm on the SS304 electrode surface.
Reclaimed water;Stainless steel 304; Sulfate reducing bacteria; Biofilm;AFM;EIS
O646
Received:February 24,2010;Revised:April 28,2010;Published on Web:July 20,2010.
*Corresponding author.Email:jinli@bjtu.edu.cn;Tel:+86-10-51684077.
The project was supported by the Datang International Power Generation Co.,LTD,China(TX06-15).
大唐国际发电股份有限公司项目(TX06-15)资助
ⒸEditorial office of Acta Physico-Chimica Sinica
