黑曲霉诱变产酶活性与稻壳中木聚糖定向酶解的研究
2010-11-04刘宝亮曹桂萍
刘宝亮,曹桂萍
(常州工学院理学院,江苏常州 213002)
黑曲霉诱变产酶活性与稻壳中木聚糖定向酶解的研究
刘宝亮,曹桂萍
(常州工学院理学院,江苏常州 213002)
采用紫外线照射诱变黑曲霉,筛选出低纤维素酶活的木聚糖酶高产菌株,研究了最优诱变条件,分析了诱变后黑曲霉产木聚糖酶的活性,测定了木聚糖酶对温度和p H值的稳定性。并初步探讨了木聚糖浓度、加酶量对酶解的影响。结果表明,最优诱变条件为:紫外照射功率40W、照射距离28 cm、诱变时间2.5 min;黑曲霉产木聚糖酶的最适温度为50℃、最适p H值为4.2。木聚糖浓度对木聚糖的酶解没有影响,加酶量对木聚糖的酶解有一定影响;在木聚糖浓度为30 g·L-1、加酶量为2%~5%时,酶解效果较好。
黑曲霉;诱变;木聚糖酶;低聚木糖
低聚木糖(Xylo2oligosaccharide),又称木寡糖,是由2~7个D2木糖以β21,42木糖苷键结合而构成的低聚糖,是一种附加值高的功能性食品添加剂,其主要有效成分为木二糖。在日本,低聚木糖被认为是最有前途的功能性低聚糖[1],已实现工业化生产并广泛应用。
国内外对木聚糖酶进行了较多的研究,已报道从黑曲霉[2,3]、海枣曲霉[4]、木霉[5]、短小芽孢杆菌[6]、梭状芽孢杆菌[7]、链霉菌[8]的培养液中纯化得到木聚糖酶。鉴于丝状真菌产酶的特点,如产生木聚糖酶胞外酶,便于酶的分离提取;产木聚糖酶的水平比一般细菌和酵母菌高;可以同时产生降解木聚糖支链所需的几种辅助酶等,便于工业化应用,因而对丝状真菌,尤其是曲霉属和木霉属的研究较多[9,10]。低聚木糖生产用酶要求不含β2木糖苷酶或β2木糖苷酶活性低。由于木聚糖总是伴随着纤维素共存的,自然界中只产木聚糖酶或只产内切木聚糖酶的菌种较少,因此,基因突变是从自然界中获得低纤维素酶活的木聚糖酶或无(低)β2木糖苷酶活木聚糖酶优良菌株的重要方法。
作者在此采用紫外线照射诱变黑曲霉,筛选出低纤维素酶活的木聚糖酶高产菌株,分析了诱变后产木聚糖酶的活性,并对木聚糖酶定向酶解木聚糖进行了研究。
1 实验
1.1 原料、试剂及仪器
稻壳,市售;黑曲霉(A.niger),哈尔滨市微生物研究所。
所用试剂均为市售分析纯。
MJ2160B2Ⅱ型霉菌培养箱、SPX21502Z型振荡培养箱,上海跃进医疗机械厂;洁净操作台,上海博迅实业有限公司医疗设备厂;电热手提式压力蒸汽消毒器,哈尔滨市松花江医疗器械厂;显微镜;离心机。
1.2 培养基
(1)斜面培养基:PDA培养基。
(2)平板培养基:以木聚糖粗提物10%作为碳源,取代察氏培养基中蔗糖,再加0.2%的胆酸钠。
(3)摇瓶培养基:改进M andels培养基。
斜面得平板培养温度:32℃。
1.3 黑曲霉的诱变
1.3.1 诱变步骤
出发菌株→增殖培养→新鲜斜面菌种→孢子悬液浓度调至5×106个·mL-1→紫外线照射→稀释涂粗木聚糖平板→挑选大的菌株→摇瓶初筛→复筛→高产菌株。
1.3.2 最佳诱变条件的确定
将培养7 d的黑曲霉孢子斜面加入适量的无菌水,刮下孢子置于盛有玻璃珠的三角瓶中,在往复式摇床上振荡0.5 h(200 r·min-1),使孢子分散,稀释成1×106~1×107个·mL-1孢子悬液;将孢子悬液均匀铺于已灭菌的直径为9 cm的培养皿中,成1 mm左右的薄层;于40 W紫外灯下,距离28 cm处照射2~5 min;稀释成一定的浓度梯度,涂布于PDA培养基上,28~30℃避光培养3~4 d,将诱变前后的稀释液平板计数,以致死率在85%的诱变条件为最佳。
1.4 黑曲霉诱变产酶活性的测定
采用DNS(3,52二硝基水杨酸)法测定酶活。以自制木聚糖为底物,以1 mg·m L-1木糖为标准品。
(1)酶液制备:将诱变后的孢子在斜面培养基上增殖培养,用无菌蒸馏水制成孢子悬液,然后接种于产酶培养基中,于28℃培养120 h后,于 4000 r·min-1离心10~20 min,即得供试酶液。
(2)酶活测定:移取1.8 mL木聚糖底物于25 mL具塞试管中,于40℃保温5 min;加入0.2 mL酶液,于40℃反应20 min;立即加入3 m L DNS试剂,混合均匀,于沸水浴中保温5 min,显色;用冷水迅速冷却后,加入20 m L蒸馏水,混匀,测定480 nm处的光吸收值。空白管则先加0.2 m L酶液,于沸水浴中保温5 min,使酶失活后,再加3 m L DNS试剂和1.8 m L木聚糖底物,混合均匀,于沸水浴中显色5 min,用冷水迅速冷却后,加入20 mL蒸馏水,混合均匀。
(3)酶活力单位:在40℃和p H值4.8的条件下,每分钟产生1μmol还原糖所需酶量定义为1个酶活力单位。
(4)标准曲线的绘制:将1 mg·mL-1标准木糖溶液用缓冲溶液稀释成0 mg·m L-1、0.1 mg·m L-1、0.2 mg ·m L-1、0.3 mg ·m L-1、0.4 m g ·m L-1、0.5 m g ·m L-1、0.6 mg ·m L-1、0.7 m g ·m L-1、0.8 m g·m L-1标准木糖稀释液,设3个重复。其中以0 m g·m L-1木糖为空白对照,分别取0.2 mL标准木糖稀释液于25 m L具塞试管中,加入1.8 m L木聚糖底物,40℃保温20 min;加入3 m L DNS试剂,混合均匀,于沸水浴中保温5 min,显色;用冷水迅速冷却后,加入20 m L蒸馏水,混匀,测定480 nm处的光吸收值,绘制木糖标准曲线(图1)。
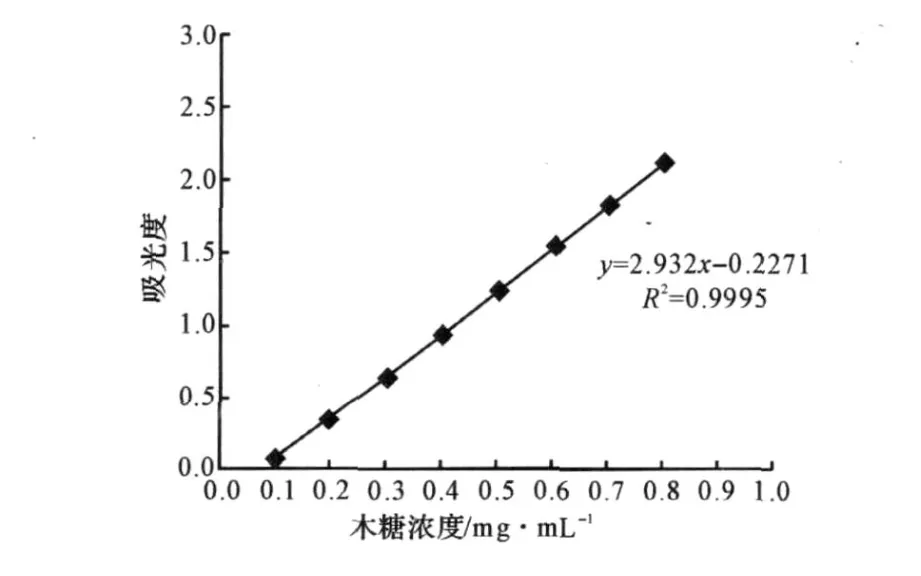
图1 木糖的标准曲线Fig.1 The standard curve of xylose
(5)黑曲霉诱变产木聚糖酶的性质测定:分别在p H值3.0~7.0保温 4 h、在 30~80℃保温 1 h,用DNS法测酶活。
1.5 木聚糖的酶解
(1)以木聚糖为原料,采用木聚糖酶定向酶解木聚糖制备低聚木糖。酶解条件为:木聚糖浓度20~50 g·L-1、酶液用量1%~10%,在p H 值为4~6、温度为40~50℃条件下水解4~24 h。取少量水解液经适当稀释,用DNS法测定还原糖浓度。
(2)取发酵液调p H值至中性,滤去不溶物,清液以DNS法测木糖质量;再用8%的硫酸于121℃水解1 h,经中和后以DNS法测木糖质量。酸解后与酸解前木糖质量的比值即为低聚木糖聚合度,酸解后木糖质量除以总木聚糖质量即得低聚木糖的含量。
2 结果与讨论
2.1 黑曲霉紫外诱变条件的确定
2.1.1 紫外线的诱变机理
紫外线之所以能够杀菌或诱变,主要是紫外线的光谱与核酸(特别是DNA)的吸收光谱一致,DNA对254 nm的紫外线有强烈的吸收作用,所以DNA最易受紫外线的影响。DNA吸收紫外线后,可引起其结构发生改变,其中最主要的是诱导了胸腺嘧啶二聚体的形成(胸腺嘧啶二聚体多数是在一条DNA链上相邻的两个嘧啶之间形成,也可能在两条DNA链之间形成);从而使DNA分子变形,并干扰了DNA复制碱基的配对关系,最终发生突变。2.1.2 最优诱变条件的确定
因为实验室紫外灯的功率和照射距离是固定的,所以控制磁力搅拌器的转速,均匀搅拌黑曲霉悬浮液,通过调整紫外照射时间来确定黑曲霉的最佳照射强度。菌落诱变的最佳照射强度要求致死率在85%左右,即存活率约为15%。
将经紫外线照射的1.47×106个·m L-1孢子悬液稀释一定倍数,涂平板,28℃培养2~3 d,取出,进行菌落计数,计算存活率,结果见表1。

表1 照射时间对菌体存活率的影响Tab11 Effect of irradiation time on fungus survival rate
由表1可知,随着紫外照射时间的延长,存活率不断下降;当紫外照射时间为2.5 m in时,存活率最接近15%。因此,确定黑曲霉的最佳诱变时间为2.5 min。
确定最优诱变条件为:紫外诱变时间2.5 m in、紫外照射功率40 W、紫外照射距离28 cm。
2.2 黑曲霉诱变产木聚糖酶的活性
将1×106~1×107个·m L-1孢子悬液均匀地铺于已灭菌的9 cm的培养皿中,成1 mm左右的薄层。于40 W紫外灯下,距离28 cm处照射2.5 min,稀释适当倍数后,涂布于显色筛选培养基平板上,28~30℃避光培养3~4 d,挑取透明圈大的菌落初步测定酶活性,选出木聚糖酶活力最大的诱变菌种。其中加质量分数为0.1%的胆酸钠抑制菌落生长。
黑曲霉诱变产酶方法有固态培养和液体培养两种方法。本实验采用液体培养的方法进行黑曲霉诱变产酶,探讨酶活性的影响因素。
2.2.1 温度对酶活的影响
分别在 30℃、40℃、50℃、60℃、70℃测同一酶样的酶活力,结果见图2。
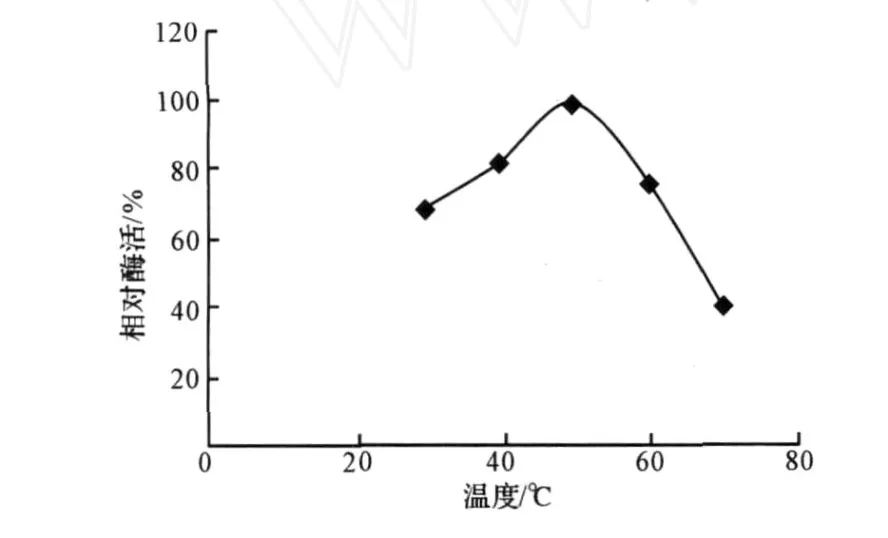
图2 温度对酶活的影响Fig.2 Effect of temperature on xylanase activity
由图2可知,50℃时,黑曲霉诱变产木聚糖酶的相对酶活最大。因此,选择50℃作为酶反应的最佳温度。
2.2.2 酶的热稳定性
分别在30℃、40℃、50℃、60℃、70℃、80℃水浴中保温1 h,测定酶活力,结果见图3。
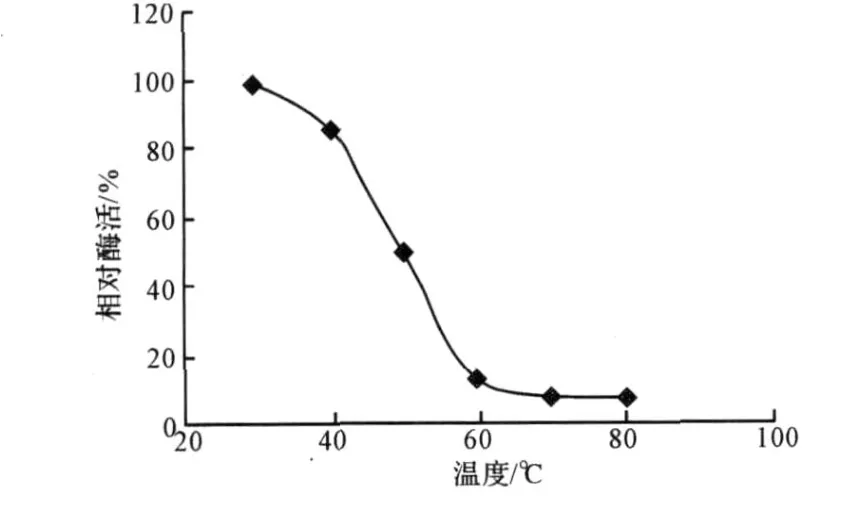
图3 木聚糖酶的热稳定性Fig.3 The xylanase stability to heat
由图3可知,随着温度的升高,相对酶活逐渐降低;在50℃,相对酶活降低为原来的 46%;在 60~80℃时,木聚糖酶的活性基本消失。
2.2.3 p H值对酶活的影响
分别在 p H 值为 3.0、4.0、5.0、6.0、7.0 的缓冲溶液中进行反应,反应温度为50℃,测同一酶样的酶活力,结果见图4。
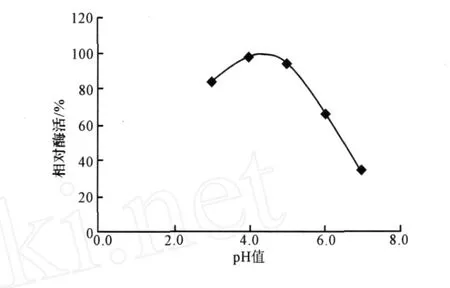
图4 pH值对酶活的影响Fig.4 Effect of pH value on xylanase activity
由图4可知,p H值为4.2时,黑曲霉诱变产木聚糖酶的相对酶活最大;p H值为4.0~5.0时,相对酶活超过80%;p H值大于5.5时,相对酶活下降很快。因此,选择4.2作为酶反应的最佳p H值。
2.2.4 酶的p H值稳定性
分别在p H 值为 3.0、4.0、5.0、6.0、7.0 的缓冲溶液中,于35℃水浴中保温4 h,测定酶活力,结果见图5。

图5 木聚糖酶的p H值稳定性Fig.5 The xylanase stability to p H value
由图5可知,p H值为4.0~6.0时,木聚糖酶比较稳定,相对酶活在75%以上。
2.3 定向酶解的研究
木聚糖酶作用于木聚糖底物时,酶解效果会受到诸多因素的影响,主要表现在以下两个方面:
2.3.1 酶系的组成
木聚糖从仅由β21,42糖苷键连接的多聚木糖线形分子到高分支的异质多糖,其结构变化很大。通常所能提取到的木聚糖均是高分支化的,包括42O2甲基2葡萄糖醛酸基、L2阿拉伯糖基等。酶解具有分支的木聚糖需要几种水解酶的共同作用,主要包括β21,42木聚糖内切酶和β21,42木糖苷酶。由于酶的来源不同,木聚糖酶的作用方式以及水解产物也不同。β21,42木聚糖内切酶从木聚糖主链内部作用于木糖苷键,采用随机降解的方式将木聚糖水解成低聚木糖。当以聚合度较高的木聚糖为水解底物时,β21,42木聚糖内切酶活力较高。然而随着木聚糖链长的缩短,水解速度减慢。一般来说,木聚糖酶不水解木二糖,有限水解或根本不水解木三糖。因此,木聚糖的水解产物主要是木二糖、木三糖以及2~4个木糖残基取代的低聚物。链长和有取代基的产物类型取决于每个木聚糖酶的作用方式。Dekker曾采用不同的木聚糖酶水解阿拉伯木聚糖和葡萄糖醛酸基木聚糖得到不同取代基的木聚糖。经过比较,发现多数木聚糖酶降解木聚糖主链后,产生的低聚木糖在主链的非还原性末端留有取代基。这说明,取代基的存在可能对木聚糖酶具有空间阻遏作用。此外,还发现一些水解产物如木三糖对木聚糖酶活力有抑制作用。
β21,42木糖苷酶是外切糖苷酶,作用于低聚木糖的末端,释放出木糖残基。大多数微生物半纤维素系统都具有β21,42木糖苷酶活力,而且已从许多真菌和细菌合成的木聚糖酶中分离纯化出该酶。一般认为,纯化得到的β21,42木糖苷酶对木聚糖不具有活性。虽然许多木聚糖酶都能水解木聚糖或低聚木糖释放出木糖,但仅β21,42木糖苷酶能水解木二糖。
总之,酶系的组成直接影响到酶解速度和酶解产物。在低聚木糖的制备过程中,如果要获得含高活力的木聚糖内切酶且不含或仅含少量β21,42木糖苷酶的酶系,就需要通过一定的分离手段来达到这一要求。
2.3.2 酶解条件
从稻壳原料中提取的木聚糖碱液必须经过预处理才能用于酶解。用98%的 H2SO4溶液中和碱液至p H值为8.0左右,产生絮凝状沉淀,先用滤纸过滤,除去沉淀,再超滤去除Na2SO4盐,即得浓缩脱盐后的木聚糖液。
酶对底物的作用过程是一个生物转化的过程,受酶用量、底物木聚糖的浓度、酶解时间、酶解p H值、酶解温度的影响。在此,主要对底物木聚糖浓度和酶用量的影响进行探讨。
(1)底物浓度对酶解的影响(表2)
从表2可以看出,随着木聚糖浓度的增加,酸解前木糖质量没有太大的变化,酸解后木糖质量逐渐增加,但增加的比例并不是很明显,聚合度逐渐增大,但是在木聚糖浓度为20~50 g·L-1时,平均聚合度没有明显的增加,在木聚糖浓度为30 g·L-1时,聚合度最大。因此,选择浓度为30 g·L-1的木聚糖液进行定向酶解木聚糖。
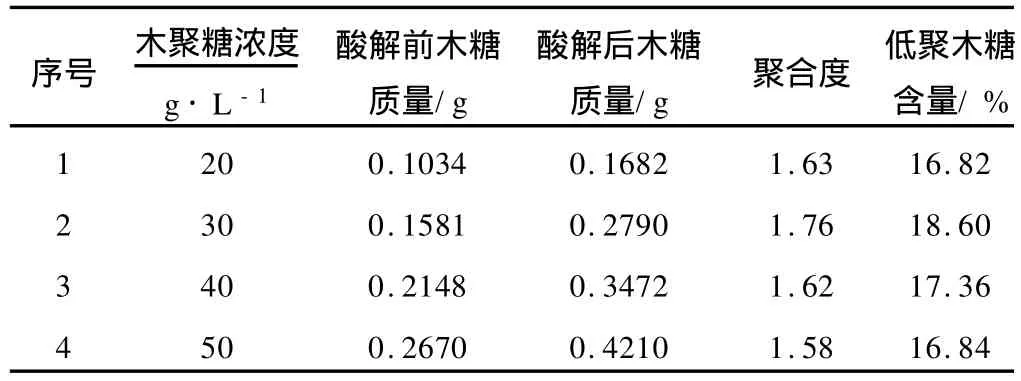
表2 底物浓度对酶解的影响Tab12 Effect of substrate concentration on enzymolysis
(2)加酶量对酶解的影响(表3)

表3 加酶量对酶解的影响Tab13 Effect of enzyme dosage on enzymolysis
从表3可以看出,随着加酶量的增加,木糖质量逐渐增加,聚合度逐渐降低。这是因为木聚糖酶是复合酶,含有β21,42木糖苷酶,它能降解木二糖,因此,随着木聚糖酶浓度的增加,低聚木糖的聚合度降低。综合考虑,选择加酶量为2%~5%,得到的低聚木糖聚合度为2~3,低聚木糖含量相差不大。
3 结论
(1)采用紫外照射诱变黑曲霉产木聚糖酶,确定最佳诱变条件为:诱变时间2.5 min、紫外照射功率40 W、照射距离28 cm。
(2)采用DNS法测定木聚糖酶活性,筛选出了木聚糖酶活性最高的菌株,并对诱变后菌种产木聚糖酶的性质进行了测定。确定木聚糖酶的最适温度为50℃,且温度越低,酶活力保持时间越长;温度越高,酶活力下降越快;在60~80℃时,酶活性基本消失。确定木聚糖酶的最适p H值为4.2,在木聚糖酶的p H值为4.0~6.0时,酶比较稳定。
(3)木聚糖底物浓度对木聚糖的酶解没有明显影响;加酶量对木聚糖酶解有一定的影响,随着加酶量的增加,木聚糖的聚合度逐渐减小。因此,在底物浓度一定的情况下,可以采用较少的加酶量进行酶解。在木聚糖底物浓度为30 g·L-1、加酶量为2%~5%时,酶解效果较好。
[1] 邬义明.植物纤维化学(第二版)[M].北京:中国轻工业出版社,1995:2242270.
[2] 福本寿一郎,迁阪好夫,竹西繁行.Study on the hemicelluloses[J].日本农芸化学会志,1970,44(10):4472456.
[3] 陈惠忠,高培基,王祖农.黑曲霉An276木聚糖酶系的酶学研究[J].微生物学报,1991,31(2):1002107.
[4] 曾宇成,张树政.海枣曲霉木聚糖酶的提纯和性质[J].微生物学报,1987,27(4):3432349.
[5] Milagres A M F,Lacis L S,Prade R A.Characterization of xyla2 nase p roduction by a local isolate ofPenicilium janthinellum[J].Enzyme Microb Technol,1993,15(3):2482253.
[6] Watanalai Panbangred,A tsuhiko Shinmyo,Shinchi Kinoshita,et al.Purification and p roperties of endoxylanase p roduced byBacil2lus pum illus[J].Agric Biol Chem,1983,47(5):9572963.
[7] Patrice Pellerin,Michele Gosselin,Jean2paul Lepoutre,et al.Enzy2 matic p roduction of oligosaccharides from co rncob xylan[J].En2 zyme M icrob Technol,1991,13(8):6172621.
[8] Marui Masaki,Nakanishi Kotoyoshi,Yasui Tsuneo.Purification and p ropertiesof three typesof xylanases induced bymethylβ2xy2 loside fromStreptom ycessp.[J].Agric Biol Chem,1985,49(12):339923407.
[9] W rong K,Tan L,Saddler J.Functional interactions among three xylanases fromTrichoderma harzianum[J].Enzyme Microbiol Technol,1986,8(10):6172622.
[10] Johnson K,Ross N.Enzymic p roperties ofβ2mannanase fromPolyporus versicolor[J].Enzyme Microbiol Technol,1990,12(12):9602964.
Study on Enzyme Activity of Xylanase from M utated Aspergillus N iger and Enzymolysis of Xylan in Paddy Hull
L IU Bao2liang,CAO Gui2ping
(School of Science,Changzhou Institute of Technology,Changzhou213002,China)
The strain p roducing high2yield xylanase w ith low enzymatic activity of cellulase was screened through mutation ofAspergillus nigerby UV2ray.The enzymatic activity of xylanase from mutatedAspergil2lus nigerw as analyzed.The xylanase stability to temperature and p H value w as determined.The effectsof xylan concentration and xylanase dosage on enzymolysis were discussed.The bestmutation conditionsofAspergillus nigerwere as follow s:UV power 40 W,distance 28 cm,irradiation time 2.5 min.The op timum conditions for p roduced xylanase were as follow s:temperature 50℃,p H value 4.2.The results showed that xylan concentra2 tion had no effect on enzymolysis,xylanase dosage affected enzymolysis obviously,the enzymolysis efficiency was the best w ith 30 g·L-1xylan concentration,2%~5%xylanase dosage.
Aspergillus niger;mutation;xylanase;xylo2oligosaccharide
Q 939 Q 814
A
1672-5425(2010)06-0073-05
2010-01-20
刘宝亮(1977-),男,河北唐山人,讲师,从事生物质热化学转化利用和植物有效成分提取的研究。E2mail:lbliang1977@163.com。
