小蓟炒炭前后蒙花苷的含量测定△
2010-11-03李璐罗建光孔令义
李璐,罗建光,孔令义
(中国药科大学天然药化教研室,江苏 南京 210009)
质量标准
《中国药典》2010年版一部品种质量标准修订项目 (YS-234,236),国家重大科技专项(20092X09502-011)
*孔令义,E-mail:cpu_lykong@126.com
小蓟炒炭前后蒙花苷的含量测定△
李璐,罗建光,孔令义*
(中国药科大学天然药化教研室,江苏 南京210009)
目的比较小蓟炒炭前后蒙花苷含量的变化。方法采用Agilent ZORBAX SB -C18(4.6mm×250mm,5μm)色谱柱,柱温30℃,流动相为甲醇-0.5%醋酸(55∶45),检测波长为326nm,流速为1.0mL·min-1。结果蒙花苷在0.01~1.00μg线性关系良好,r=1.000,平均回收率为98.6%,RSD=2.48%(n=6)。结论该方法方便,准确,重现性好,为小蓟和小蓟炭的质量控制提供依据,并有助于小蓟合理炮制工艺的制定。
小蓟;炒炭;蒙花苷;高效液相色谱法
小蓟为中医临床常用之凉血止血要药,来源于菊科植物刺儿菜Cirsiumsetosum(Willd.) MB.的干燥地上部分。夏、秋二季花开时采割,除去杂质,晒干。小蓟具有清热凉血、止血、祛瘀等功能,历代临床上有生用和炒炭用。据文献报道,两者均具有促进血液凝固的作用[1]。小蓟中止血有效成分主要为黄酮类成分[2],包括蒙花苷(Linarin)、芦丁(Rutin)、刺槐素(Acacetin)等。经过对小蓟的系统研究[3],发现小蓟所含黄酮类成分中,以蒙花苷的含量最高,为其主要成分。故本文选择蒙花苷作为指标成分,用HPLC法测定小蓟药材和小蓟炭中蒙花苷的含量,为小蓟和小蓟炭质量标准的制定提供依据,同时为小蓟炭的炮制工艺研究提供监测方法。
1 仪器与试药
1.1仪器
Agilent1200高效液相色谱仪(美国安捷伦公司),包括G1322A在线脱气机,GB1312A二元泵,GB1329A自动进样器,G1316A柱温箱,G1315DDAD检测器,G1362ARID检测器,ChemstationRevB.03.02工作站,ZORBAXSB-C18(4.6mm×250mm,5μm)色谱柱;UP2200H型超声波提取器 (40KHz,100W),十万分之一电子天平(METTLERTOLEDO)。
1.2试药
蒙花苷为本实验室自制,经MS,1H-NMR,13C-NMR鉴定结构,HPLC测定纯度达98.5%以上。水为纯净水(乐百氏食品饮料有限公司),甲醇(江苏汉邦科技有限公司)为色谱纯,冰醋酸(南京化学试剂有限公司)为分析纯。10批小蓟药材样品除江苏、安徽定远两地为浙江中医药大学中药饮片厂提供外,其余均购自各地药材公司。经中国药科大学生药学研究室张勉教授鉴定为菊科植物刺儿菜Cirsiumsetosum(Willd.) MB.的干燥地上部分。10批小蓟炭为分别取以上10批小蓟药材,参照《中国药典》2005版(附录ⅡD)[4]炒炭法炒至外焦黑色,筛去灰屑获得。
2 方法和结果
2.1色谱条件
色谱柱:AgilentZORBAXSB-C18(4.6mm×250mm,5μm)色谱柱;流动相:甲醇-0.5%醋酸(55∶45);流动相流速:1mL·min-1;柱温:30℃;检测波长:326nm。对照品与样品的色谱图见图1。
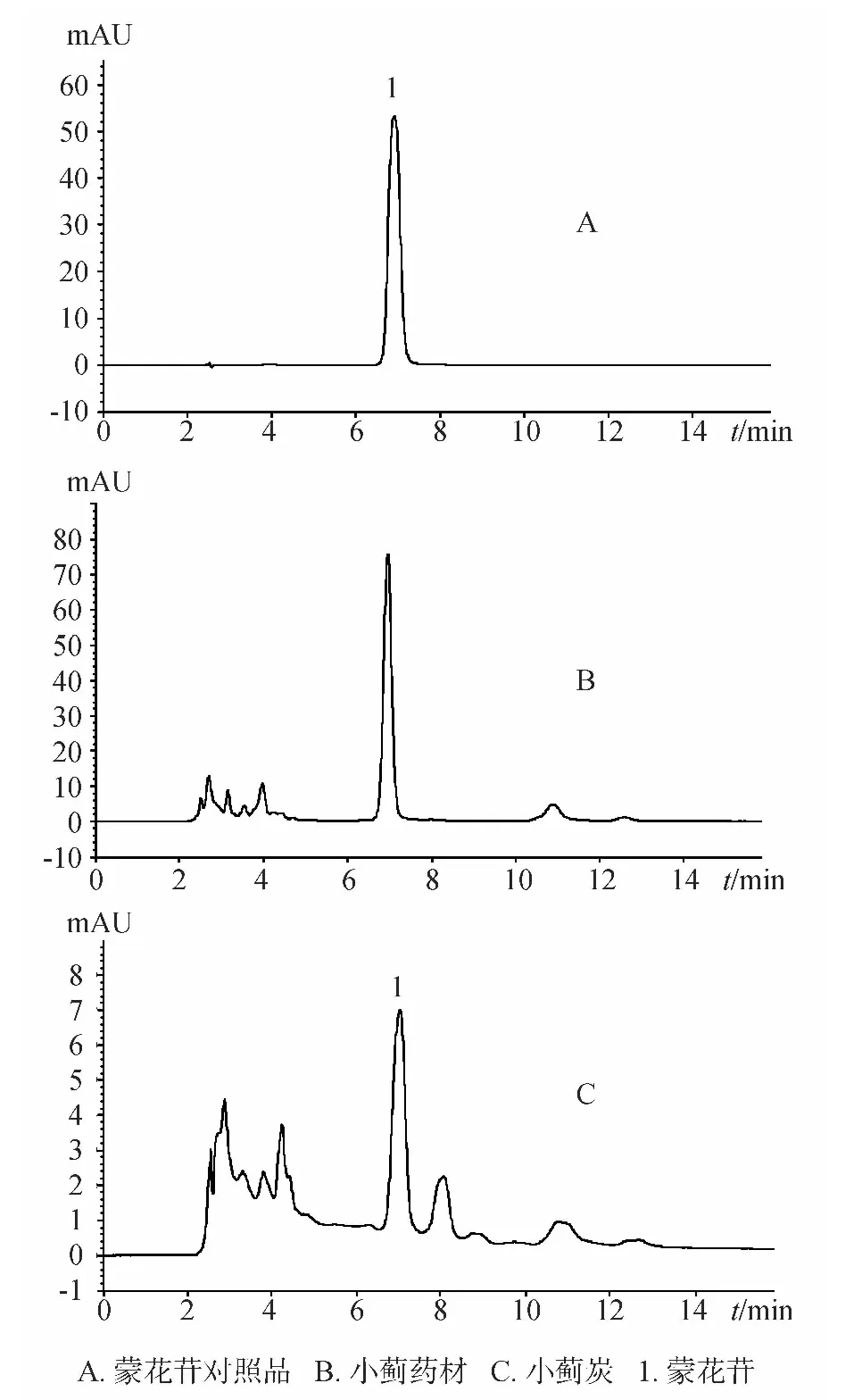
图1 小蓟HPLC图
2.2对照品溶液的制备
取蒙花苷对照品适量,精密称定,加甲醇制成每1mL含0.1mg的溶液。
2.3供试品溶液的制备
取本品粉末(过四号筛)约0.1g,精密称定,置具塞锥形瓶中,精密加入甲醇10mL,密塞,称定重量,超声处理15min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,作为供试品溶液。
2.4线性关系考察
精密称取蒙花苷对照品适量,加甲醇制成每1mL含0.1mg的溶液,作为对照品储备液。上述储备液分别进样0.10,0.50,2.00,6.00,8.00,10.00μL,按2.1项下色谱条件进行HPLC分析,记录峰面积,以进样量(μg)为横坐标,峰面积为纵坐标进行回归计算。结果表明,蒙花苷在检测范围内显示了良好的线性关系,线性方程为Y=2 048.2X+3.361 6,r=1.000,线性范围为0.01~1.00μg。
2.5稳定性试验
精密称取小蓟药材粉末0.1g(过四号筛),按2.3项制备供试样品,分别于0,2,4,6,8,10,12h进样,蒙花苷的RSD=0.41%,结果表明,供试品溶液在12h内稳定。
2.6精密度试验
精密吸取对照品溶液,连续进样6次,记录各色谱峰峰面积,RSD=0.28%,表明仪器精密度良好。
2.7重现性试验
精密称取同批次小蓟药材粉末0.1g(过四号筛)6份,按2.3项制备供试样品并分析,以蒙花苷的含量为考察指标,蒙花苷的RSD=1.44%,表明重现性良好。
2.8加样回收率试验
精密称取已知含量的药材粉末0.05g,共6份,精密加入对照品溶液适量,按2.3项制备供试品溶液,计算蒙花苷的加样回收率,结果见表1。

表1 蒙花苷加样回收率试验
2.9样品测定
分别取10个批次小蓟药材和对应的小蓟炭粉末(过四号筛),按2.3项制成供试品溶液。小蓟药材含量测定为取小蓟药材供试品溶液5μL,小蓟炭含量测定为取小蓟炭供试品溶液10μL,分别在2.1项色谱条件下进样,记录各色谱峰的峰面积,每个样品重复3次。含量测定结果见表2。结果表明小蓟炒炭后蒙花苷含量明显降低。
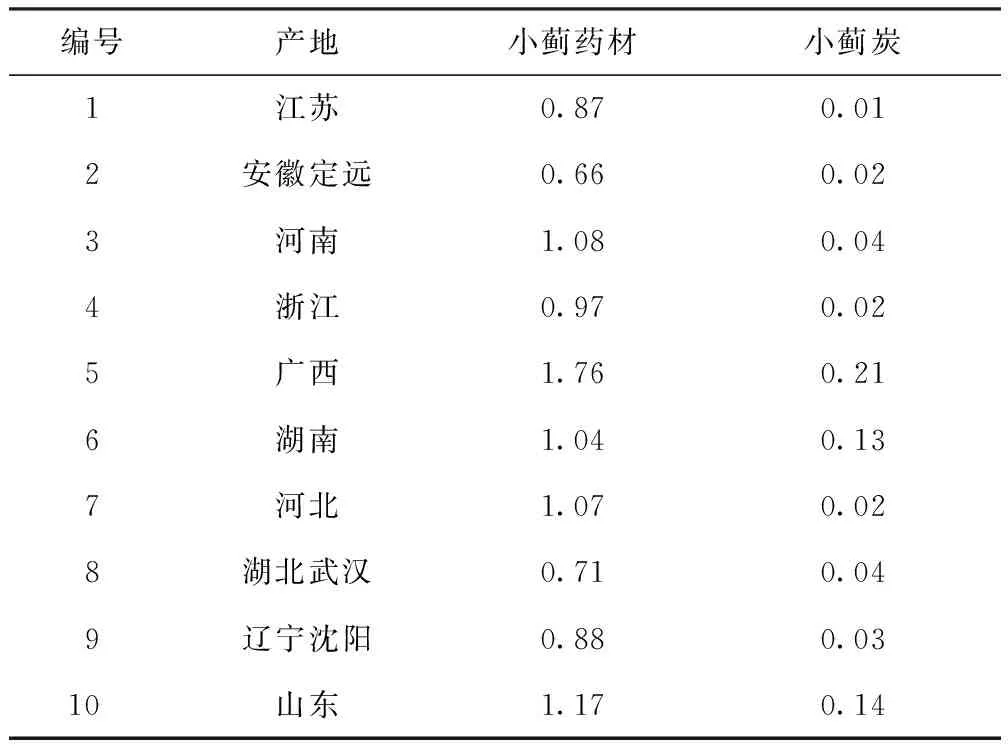
表2 小蓟和小蓟炭中蒙花苷的含量 /%
3 讨论
蒙花苷为小蓟的主要成分,为小蓟的有效成分之一,其含量测定方法较多,有紫外分光光度法、薄层扫描法、高效液相法,其中以高效液相法居多,文献中曾有人采用乙腈-水系统用HPLC法测定小蓟中蒙花苷的含量[5]。本文考察了不同浓度的甲醇-水和乙腈-水系统,并考察了不同的酸浓度,结果表明采用甲醇-0.5%醋酸(55∶45),蒙花苷和其他成分能达到很好的分离,并且出峰时间较早(约7min),是一种比较经济省时的方法。供试品溶液的制备方法,我们考察了不同的提取溶剂和提取方式,结果表明取0.1g药材加甲醇10mL超声15min,能将小蓟中的蒙花苷提取完全,并且操作简便易行。
小蓟炒炭后蒙花苷含量明显降低,为小蓟药材蒙花苷含量的十分之一到几十分之一,说明炒炭过程对黄酮类成分有很明显的破坏性作用,炒炭后黄酮类成分含量明显降低。因各产地小蓟的生长环境和采收时节的差异,小蓟药材的外观和质地等存在着一些差别,因此导致炒炭后蒙花苷含量的变化程度并不一致,并且炮制火候和时间的差别等对蒙花苷含量变化程度也有很大的影响。总的来说,小蓟炒炭后蒙花苷含量明显降低。

[1] 山东省中医药研究所药理组.30种中药炒炭前后止血的研究[J].药学通报,1965,11(12):562.
[2] 楼之芩,秦波.常用中药材品种整理和质量研究[M].北京:北京医科大学中国协和医科大学联合出版社,1995:711.
[3] 潘珂,尹永芹,孔令义.小蓟化学成分的研究[J].中国现代中药,2006,8(4):7-9.
[4] 国家药典委员会.中国药典(一部)[S].北京:化学工业出版社,2005:附录20.
[5] 刘翔.小蓟质量标准的研究[J].南京中医药大学学报,2006,22(4):263-264.
DeterminationofLinarininHerbaCirsiiandItsCarbonizedProduct
Li Lu, Luo Jianguang, Kong Lingyi
(DepartmentofNaturalMedicinalChemistry,ChinaPharmaceuticalUniversity,NanjingJiangsu210009,China)
Objective: To compare the Linarin contents of Herba Cirsii and its carbonized product.MethodsAnalyzing by Agilent ZORBAX SB-C18(4.6mm×250mm,5μm) column, at30℃, methanol-0.5% acetic acid (55∶45) was used as the mobile phase, and the detection wavelength and the flow rate were326nm and1.0mL·min-1, respectively.ResultsIn the concentration range of0.01~1.00μg, the calibration curve revealed a good linearity relationship (r=1.000), and the average recovery rate was98.6% with RSD=2.48% (n=6).ConclusionThe proposed method was found to be relatively simple, precise and reproducible, which provided an basis for the quality control of Herba Cirsii and its carbonized product, and the method can be used to formulate the reasonable technology of processing.
Herba Cirsii; Carbonizing, Linarin; HPLC
2010-02-25)
