PS0312菌株发酵产淀粉酶及温度与pH值对酶活力的影响
2010-10-28李炜东肖琼娜
张 镜,李炜东,肖琼娜
(1.嘉应学院生命科学学院,广东 梅州 514015;2.梅州市质量计量监督检测所,广东 梅州 514072)
PS0312菌株发酵产淀粉酶及温度与pH值对酶活力的影响
张 镜1,李炜东2,肖琼娜1
(1.嘉应学院生命科学学院,广东 梅州 514015;2.梅州市质量计量监督检测所,广东 梅州 514072)
PS0312菌株是具有特殊生物学特性的青霉菌株。以三角瓶固体培养研究不同条件与菌株产淀粉酶的关系,以及温度与pH值对酶活力的影响。结果表明:PS0312菌株以麸皮30.04%、大豆饼粉3.70%、谷壳3.70%及55.56%蒸馏水组成的培养基固体发酵湿麸曲淀粉酶产量最高。单因子试验结果表明:以培养基pH3、108个/mL的种子液接种量1.85%、培养温度28℃、培养时间96h产淀粉酶量最大。PS0312菌株产淀粉酶在pH2.0~10.0内具较高活性,酶活大小与pH值的关系成双峰形;pH3的条件下酶活性最高,相对酶活100%;pH9的条件下酶活次之,相对酶活84.98%。酶反应最适温度为60℃,90℃条件下相对酶活为39.06%。研究表明:PS0312菌株发酵产淀粉酶是一种在强酸、强碱条件下都具有较高的酶活性和耐高温的特殊的酸性、中温淀粉酶,可在较宽的温度与pH值范围下应用。
PS0312菌株;青霉属;固体发酵;淀粉酶
淀粉酶广泛应用于食品、发酵、纺织、造纸业、分析化学、制药业和化学药品工业等,是产量最大的一类酶制剂,占酶制剂市场份额约25%[1-4]。其中主要是中性α-淀粉酶,因其酸性与碱性条件下酶活不高,已不能满足相关行业发展的要求。酸性α-淀粉酶的最适pH4~5,在pH2下仍保持较高的酶活力,可以在低pH值条件下液化淀粉,用于酸性条件下淀粉原料的加工,如烧酒和高麦芽糖浆的生产等[5-6]。酸性α-淀粉酶可与糖化酶一起协同水解淀粉质原料可简化生产工艺、降低环境污染,用于开发适合于胃酸性环境(pH2.0 左右)的消化助剂,具有突出的医疗效果,亦可用于动物饲料、发酵饮料等[7-11]。中温酸性α-淀粉酶的最适温度在40~60℃,水解淀粉无需高温可节约能量[12]。碱性淀粉酶的最适pH8~9与多数洗涤剂的pH值范围相近,已大量用于洗涤工业中,是继基础洗涤剂中加入蛋白酶后的第二类酶制剂,还用于医药、淀粉水解、分析化学、纺织等[13-14]。
从广东省梅州市内采集土样分离获得的PS0312青霉菌株(Penicillium sp.),耐强酸和强碱环境,在pH2~10内均能生长,在pH3的条件下生长最快,在pH8~9下次之,pH4~7内生长速率较低,生长速率与pH值关系曲线呈“双峰形”[15]。菌株产淀粉酶的活性与pH值的关系亦与生长速率与pH值的关系相近,此酶具有独特的应用价值。研究PS0312菌株产淀粉酶的条件以及酶活与pH值及温度的关系,旨在为其开发利用提供参考。
1 材料与方法
1.1 菌种来源
从土样中分离、纯化获得PS0312菌株,菌种由嘉应学院生命科学学院实验室保藏。
1.2 试剂与仪器
葡萄糖、3,5-二硝基水杨酸、磷酸氢二钠、柠檬酸、氢氧化钠、可溶性淀粉等均为分析纯。
FAII604A电子分析天平 上海精天电子仪器厂;NU-440-400E生物安全柜 美国纽艾公司;U-2800紫外-可见分光光度计 日本日立公司;SS-325立式高压蒸汽灭菌锅 日本多美公司;PHs-3C pH计 上海智光仪器仪表有限公司。
1.3 方法
1.3.1 种子液制备
按常规方法制备PDA培养基[16],PS0312菌种接于PDA斜面,28℃恒温培养120h后再次转接至PDA斜面,28℃恒温培养144h备用。以无菌水洗下斜面分生孢子,调孢子浓度为108个/mL为种子液。
1.3.2 培养基制备与菌株固体发酵
将培养基各成分加入三角瓶(250mL,下同)内混匀,60℃水浴1h,121℃灭菌60min,冷却后接入种子液,设定条件下静置培养,每24h内定时搅拌麸曲4次。
1.3.3 淀粉酶活力测定
准确称取适量湿麸曲,加入10倍蒸馏水或缓冲液、室温浸泡4h,充分搅拌,4500r/min离心20min,取上清液定溶为粗酶液。以稍修改的DNS法测定粗酶液α-淀粉酶活力[17],实验制作的葡萄糖标准曲线的回归方程(R2=0.9995)线性范围0~0.5mg/mL。酶液以pH4.4、60℃下1min水解可溶性淀粉产生葡萄糖1mg为1个酶活力单位(U)。
1.3.4 培养基附加氮源对菌株产淀粉酶的影响
称取麸皮10g、谷壳1g及15mL蒸馏水加入三角瓶内,分别加入大豆饼粉或花生饼粉,灭菌冷却后接种子液0.5mL,搅匀,28℃培养120h,准确称取适量湿麸曲,制备粗酶液,测定湿麸曲α-淀粉酶酶活。
1.3.5 培养基加水量对菌株产淀粉酶的影响
准确称取大豆饼粉1g、麸皮10g及谷壳1g(简称基础培养基)装入三角瓶,分别加不同体积蒸馏水,灭菌冷却后接种子液0.5mL,28℃培养120h,称取适量湿麸曲制备粗酶液,测定湿麸曲α-淀粉酶酶活。
1.3.6 培养温度对菌株产淀粉酶的影响
在装基础培养基的三角瓶内加入蒸馏水15mL,灭菌冷却后分别接种子液0.5mL,不同温度下培养120h,取样测定湿麸曲α-淀粉酶酶活。
1.3.7 培养时间与菌株产淀粉酶的关系
在装基础培养基的三角瓶内加入蒸馏水15mL,灭菌冷却后接种子液0.5mL,28℃恒温培养,定时取样测定湿麸曲α-淀粉酶酶活。
1.3.8 接种量对菌株产淀粉酶的影响
在装基础培养基的三角瓶内加入14.75、14.5、14、13mL的蒸馏水,灭菌冷却后分别接种子液0.25、0.5、1、2mL(对应的接入量体积分数分别为0.9%、1.8%、3.6%、7.3%),28℃培养120h,取样测定湿麸曲α-淀粉酶酶活。
1.3.9 培养基pH值对菌株产淀粉酶的影响
在装基础培养基的三角瓶内分别加不同pH值的缓冲液15mL,灭菌冷却后接种子液0.5mL,28℃恒温培养120h,取样测定湿麸曲α-淀粉酶酶活。
1.3.10 pH值对菌株产淀粉酶酶活力的影响
称取适量湿麸曲,分别加入10倍质量体积不同pH值的缓冲液,制备粗酶液,以相应的pH值缓冲液及60℃条件下测定淀粉酶酶活。
1.3.12 温度对菌株产淀粉酶酶活力的影响
称取适量湿麸曲,分别加入pH 3.0的磷酸缓冲液制备粗酶液,将酶液与可溶性淀粉不同温度下反应,测定相应条件下淀粉酶的酶活。
1.3.13 数据分析
所有实验3次重复,实验数据以SPSS 10.0进行统计分析,以 LSR 法进行差异显著性比较,以Excel 2003作图。
2 结果与分析
2.1 附加氮源对PS0312菌株产淀粉酶的影响
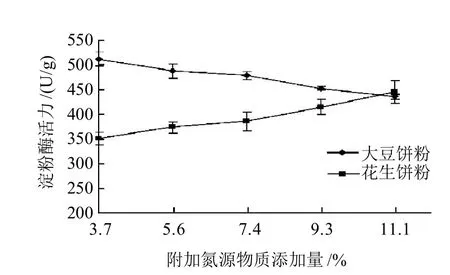
图1 外加氮源与PS0312菌株产淀粉酶的关系Fig.1 Effects of the type and amount of nitrogen source on amylase production
菌株于含大豆饼粉作为附加氮源配制的培养基上28℃培养120h,由图1可知,随着培养基中大豆饼含量的增加麸曲中淀粉酶的酶量逐渐降低,含3.7%大豆饼粉培养基的麸曲酶活为512U/g,产酶量最大,培养基大豆饼粉含量11.1%的麸曲酶量最低,将前者下降15.04%。相反,菌株以含花生饼粉的培养基培养,麸曲淀粉酶酶量随花生饼粉含量的增加而增大,含11.1%花生饼粉培养基麸曲的酶量较含3.7%花生饼粉培养基麸曲的酶活高21.35%,但比含3.7%大豆饼培养基麸曲的酶量低13.09%,而含3.7%花生饼粉麸曲的酶活则较3.7%大豆饼培养基麸曲的酶活低31.64%。实验表明添加花生饼粉氮源物质不仅可显著提高淀粉酶的产量,而且花生饼粉的用量低。韩科等[18]以麸皮为主要成分的固体培养基发酵米曲酶菌株,结果附加5%大豆饼粉的麸曲淀粉酶酶活比加等量花生饼粉麸曲酶活仅高14.6%。
2.2 加水量对PS0312菌株产淀粉酶的影响
菌株于不同加水量的培养基上28℃培养120h后湿麸曲的淀粉酶活力见图2。菌株在加水量为55.6%的培养基产酶量最高,湿麸曲酶活为470.67U/g,统计分析得知酶活与其余加水量培养基上培养的淀粉酶活差异极显著(P<0.001)。含水量低的培养基活性水不足,菌株生长受到抑制,当增大含水量时产酶量提高显著,含水量高于55.6%不利培养基内的通气,影响菌株的正常生长与产酶,麸曲的酶活力不高。培养观察发现在含水量55.6%的培养基上菌株生长的延滞期较短、培养基上菌丝体茂盛。
刘永乐[19]对一黑曲霉菌株固体发酵,以含水量50%培养基(麸皮:水质量比1:1)麸曲的产淀粉酶量最大,含水量达54.5%时其产酶量显著下降。本研究以培养基中添加3.7%谷壳,可提高培养基的通透性与增加菌株生长的表面积,因而以培养基含水量55.6%的麸曲的酶量最大,而且培养基中添加极廉价谷壳可减少成分的使用量,可降低培养基成本。
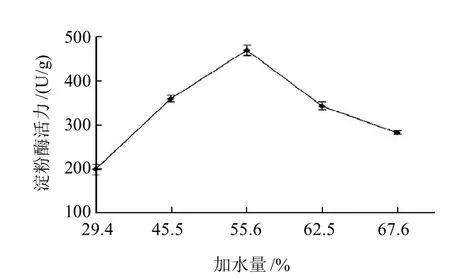
图2 加水量与PS0312菌株产淀粉酶的关系Fig.2 Effect of the amount of water added to the solid medium on amylase production
2.3 培养温度对PS0312菌株产淀粉酶的影响
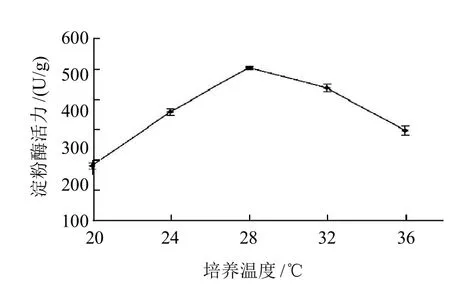
图3 培养温度与PS0312菌株产淀粉酶的关系Fig.3 Effect of culture temperature on amylase production
由图3可知,菌株在不同温度下固体发酵后,以28℃培养温麸曲的淀粉酶酶量最大,酶活为498.18U/g,32℃培养的麸曲的淀粉酶量次之,酶活436U/g。20℃培养温麸曲的淀粉酶酶量最低,湿麸曲的酶活仅为179.55U/g,比36℃培养的酶活低43.35%,差异极显著。PS0312菌株固体培养产淀粉酶的最适与黑曲霉菌株AS-Y相近,但PS0312菌株耐高温性更佳,36℃培养麸曲的淀粉酶相对酶量达到59.94%,显著高于黑曲霉AS-Y菌株高温条件下的产酶量[19]。培养观察发现20℃培养菌株的生长很差、延滞期较长,36℃培养菌株对数生长期较短,28℃培养菌株的生长状况良好。
2.4 培养时间对PS0312菌株产淀粉酶的影响
由图4可知,菌株28℃培养48h及以后每24h取样测定湿麸曲的淀粉酶活力,结果培养96h及120h麸曲的酶活最高,分别为533.65U/g及548.53U/g,数据统计分析表明两者间的差异不显著。培养144h湿麸曲的淀粉酶酶活力仅为429.60U/g,与96h及120h培养的湿麸曲的酶活差异极显著(P<0.01)。结果表明菌株培养96h湿麸曲淀粉酶酶活最高,培养144h酶活降低可能是已产生的淀粉酶被蛋白酶分解,或是受菌株代谢产物增加的影响使酶的活力下降。观察发现培养时间48~72h时,培养基表面上逐渐出现白色菌丝;96~120h时培养基表面长出少量孢子,菌株处于稳定期,菌丝体量达到最大值,并有少量的色素产出;120h后,培养基表面长出大量孢子,菌株进入衰亡期。
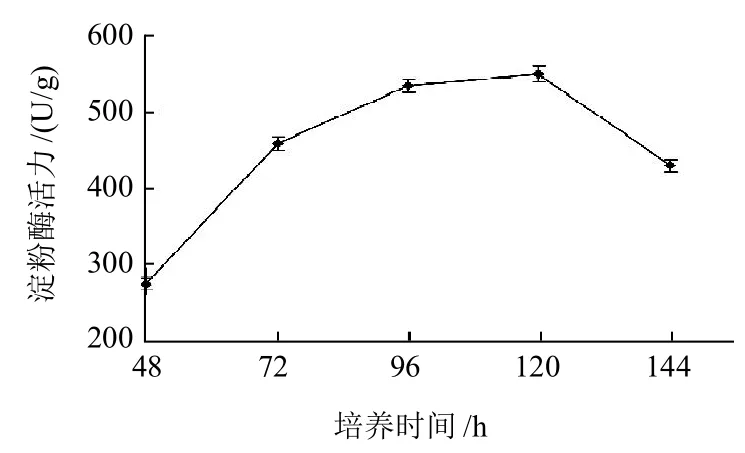
图4 培养时间与PS0312菌株产淀粉酶的关系Fig.4 Effect of culture time on amylase production
2.5 接种量对PS0312菌株产淀粉酶的影响
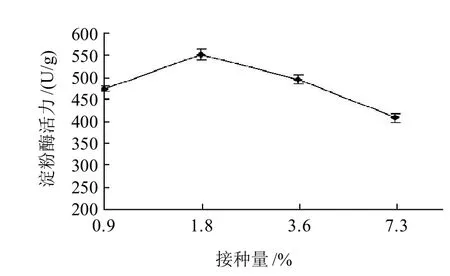
图5 接种量与PS0312菌株产淀粉酶的关系Fig.5 Effect of inoculum size on amylase production
由图5可知,接种量1.8%的产淀粉酶量最高,酶活541.36U/g;接种量7.3%的湿麸曲的淀粉酶的酶量最低,酶活412.76U/g。而接种量1.8%的酶活与其余3个接种量湿麸曲酶活差异的极显著(P<0.001)。结果表明:固体发酵1.8%的接种量对菌株产淀粉酶最有利,低于或高于1.8%的接种量都不利于菌株产淀粉酶,尤其是高接种量不仅不会随接种量的增大而增加产酶量,反而使酶产量显著下降。
较大接种量大可缩短微生物发酵前期的繁殖时间,形成生产菌的优势。接种量过大则会引起菌丝大量繁殖,使单位体积内的养料和溶氧不足,干扰正常代谢[20]。或可能菌丝生长过快产生的代谢产物过多而影响了淀粉酶的产生。接种量过低则发酵中菌株生长进入平稳期所需的时间较长,培养120h淀粉酶的累积尚未最大值。
2.6 培养基pH值对PS0312菌株淀粉酶活力的影响
由图6可知,PS0312菌株产淀粉酶的pH值范围很宽,培养基pH2~12都能产生淀粉酶,其中以在pH3.0的培养基上培养的酶量最高(621.88U/g),pH9.0培养基上培养的酶量次之(517.26U/g),pH7.0培养基培养的酶量(240.84U/g)为两者间的最低值,产酶量与pH值的关系呈双峰型曲线,且与菌株平板培养pH值与生长速率的关系基本一致[15],此外菌株在pH2及pH11的培养基上培养的产酶分别为pH3培养基培养的63.77%与26.25%。微生物固体发酵较易污染菌,而PS0312菌株产淀粉酶最适pH3强酸性条件,此pH值条件下进行菌株产淀粉酶的固体发酵则具抑制多数杂菌生长的效果,染菌机率相对较低。文献表明不论是产酸性、中性或是碱性淀粉酶的微生物发酵,培养基的pH值与淀粉酶的酶产量的关系都系单峰形[21-22],而未见有与PS0312菌株呈双峰形的类似报道。
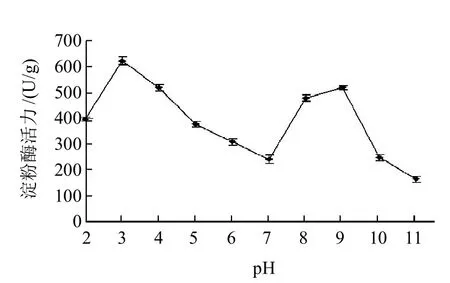
图6 培养基pH值与PS0312菌株产淀粉酶的关系Fig.6 Effect of medium pH on amylase production
2.7 缓冲液pH值对淀粉酶活力的影响
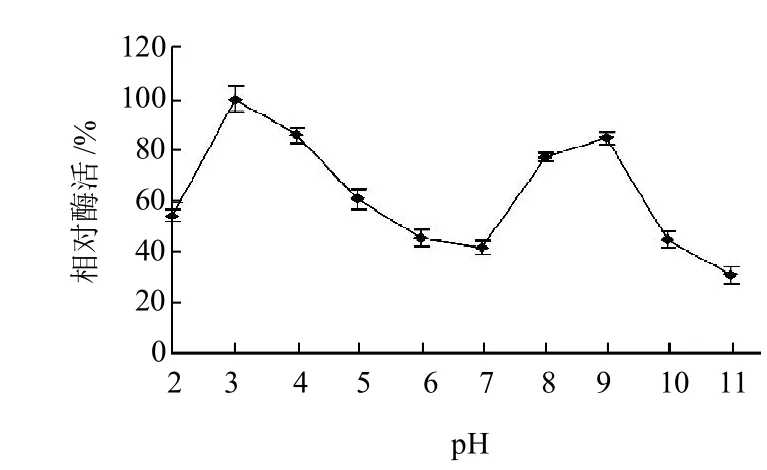
图7 缓冲液pH值对PS0312菌株产淀粉酶活性的影响Fig.7 Effect of pH on amylase activity
固体培养的麸曲以不同pH值的缓冲液制备粗酶液,相应pH值缓冲液测定淀粉酶酶活。由图7可知,淀粉酶在pH3.0缓冲液内的酶活最高,相对酶活定为100%,与其余pH值缓冲液中淀粉酶的酶活差异极显著(P<0.001)。淀粉酶pH 4.0~7.0条件下淀粉酶的活性逐渐下降,在pH7.0下的相对酶活为41.90%。菌株产淀粉酶在pH2.0缓冲液中的相对酶活达54.73%,当pH9.0的相对酶活为84.98%,为第二高峰,pH>10.0下的酶活再次速率下降。结果表明:菌株所产淀粉酶不仅是典型的酸性淀粉酶,而且在碱性条件下仍具较高的活性,即pH值与PS0312菌株产淀粉酶活性的关系呈双峰形。pH值与PS0312菌株产淀粉酶量的关系与pH值与菌株产的关系基本一致,也与pH与该菌株在琼脂平板上的生长速率的关系基本一致[15]。陈远钊[23]报道一水生假丝酵母菌株产酸性α-淀粉酶的最适pH4.0,pH2.0时相对酶活为48%,但当pH8.0时相对酶活不足20%。陈波等[24]报道一微生物菌株产酸性α-淀粉酶的最适pH值为4.4,而碱性条件的酶活极低,在pH接近8.0时的相对酶活仅约20%,均未见pH值与淀粉酶酶活力呈双峰形关系的文献报道,且多数文献报道微生物酸性α-淀粉酶的最适pH4~5[25-26],高于PS0312菌株淀粉酶最高酶活力的pH值,PS0312菌株的淀粉酶可在更酸的条件使用。另外,PS0312菌株产淀粉酶在碱性条件的相对酶活较高,又可在碱性条件下,比其他酸性淀粉酶的应用范围更宽。
2.8 温度对淀粉酶活力的影响
以pH3.0缓冲液制备菌株麸曲淀粉酶粗酶液,不同温度下测定酶活,结果见图8。PS0312菌株产淀粉酶在30~60℃内随温度升高酶活相应增大,60℃下的酶活最高,相对酶活定为100%。当温度为65℃的酶活下降4.26%,与60℃下的酶活差异显著(P<0.05),而大于65℃下的酶活迅速下降,但在80℃与90℃下时的相对酶活仍分别达63.79%及41.62%。结果表明,PS0312菌株产淀粉酶为中温性淀粉酶,但对高温具有较强的耐热性。陈波等[24]报道一微生物菌株产酸性α-淀粉酶反应的最适温度为60℃,当温度升至80℃时的相对酶活低于50%。胡元森[27]报道芽孢杆菌菌株产酸性淀粉酶酶活45℃时最大,超过55℃酶酶活急剧下降, 80℃时的酶活力约为20%。

图8 温度对PS0312菌株产淀粉酶活性的影响Fig.8 Effect of temperature on amylase activity
3 结 论
PS0312菌株固体发酵产淀粉酶,制备培养基的初始含水量55.56%、培养基pH3、以浓度为108个/mL的孢子悬浮液接种的接种量1.8%、培养温度28℃、培养96h淀粉酶量大、酶活最高。
PS031 2菌株产淀粉酶系耐高温中温性淀粉酶。PS0312菌株产淀粉酶酶活最高温度为60℃,为中性淀粉酶,生产应用可以节约能量、降低产品的生长成本[7]。且在30℃与90℃下的相对酶活均较高,可以在较大的温度范围内使用。陈波等[21]报道一野生型青霉菌株产酸性α-淀粉酶当温度高于70℃的酶活迅速下降,80℃下的相对酶活小于50%,PS0312菌株产淀粉酶80℃的相对酶活达63.79%。
PS0312菌株产淀粉酶碱性条件下具高活性的酸性淀粉酶。目前报道的微生物酸性与碱性淀粉酶适宜pH值范围较窄[23-24,28-29],其生产应用都有一定的限制。PS0312菌株产淀粉酶活性在pH2~10的范围内均具较高活,其中以pH3的活性最大,但pH9.0的相对酶活力达84.98%,是开发酸性及碱性条件都适用的特殊淀粉酶重要的微生物资源。
开发菌株产淀粉酶有待进一步提高菌株的产酶量。本研究所用菌株为从土样分离获得的野生型菌株,野生型菌株发酵生产的目的产物的产量有限,有待通过诱变育种获得高产突变菌株,或构建高效表达的基因工程菌后方可作为工程菌用于产业化开发。
[1] 孟庆红. 淀粉酶的作用机理及在面包和饲料中的应用[J]. 粮食与饲料工业, 1997(6): 34.
[2] 张树政, 伦世仪, 朱庆裴, 等. 酶制剂工业[M]. 北京: 科学出版社,1998: 456-556.
[3] CASTRO G R, FERRERO M A, MENDEZ B S, et al . Screening and selection of bacteria with high amylolytic activity[J]. Acta Biotechnol,1993, 13: 197-201.
[4] CECI L N, LOZANO J E. Amylase for apple juice processing: effects of pH, heat, and Ca2+ions[J]. Food Technol Biotechnol, 2002, 40(1) : 33-38.
[5] MORIMURA S, ZHANG W X, ICHIMURA T, et al. Genetic engineering of white shochu-koji to achieve higher levels of acid stable αamylase and gluco-amylase and other properties when used for shochu making on a laboratory scale[J]. J I Brewing, 1999, 105(5): 309-314.
[6] WILKINSON S, STEVENS J, BEDFORD S, et al. Purified acid-stable α-amylase from fungal origin: US, 5962276[P].1999-05-10.
[7] 欧阳平凯. 化工产品手册[M]. 3版. 北京: 中国轻工业出版社, 1999:1-46.
[8] BEDFORD M R, AUTIO K. Microscopic examination of feed and digested from wheat - fed broiler chickens and it s relation to bird performance[J]. Poult Sci, 1996, 75: 1-14.
[9] RITZ C W, HALET R M, SELF B B, et al . Endogenous amylase levels and response to supplementation feed enzymes in male turkeys from hatch to 8 weeks of age[J]. Poult Sci , 1995, 74 (8) : 1317-1322.
[10] 蒋正宇, 周岩民, 王恬, 等. 外源α-淀粉酶对肉鸡生产性能的影响[J]. 家畜生态学报, 2007, 28(4): 13-16.
[11] 杨培华, 李忠海, 刘永乐,等. 耐酸性α-淀粉酶的开发与应用[J]. 食品与机械, 2006, 22(5): 132-136.
[12] 刘旭东, 徐岩. 一种新的中温酸性α-淀粉酶的分离纯化及酶学性质[J]. 应用与环境生物学报, 2008, 14(2): 235-239.
[13] 邓淑丽, 韩曙光, 陈晖, 等. 应用α-淀粉酶结合能力鉴定血链球菌[J]. 浙江预防学, 2004, 16(2): 14-15.
[14] AIYER P V. Amylases and their applications[J]. African Journal of Biotechnology, 2005, 4 (13): 1525-1529.
[15] 黄思梅, 张镜. PS0312产色素青霉菌株形态及其重要生物学的研究[J]. 实验室科学, 2007(2): 75-79.
[16] 方中达. 植病研究方法[M]. 北京: 农业出版社, 1979: 83-84.
[17] 诸葛健, 王正祥. 工业微生物实验技术手册[M]. 北京: 中国轻工业出版社, 1996, 255.
[18] 韩科, 张志国, 郑毅, 等. 米曲霉(Aspergillus oryzae)FSO179产α-淀粉酶固体发酵优化的研究[J]. 生物技术, 2006, 16(3): 62-65.
[19] 刘永乐, 李忠海, 俞健, 等. 产耐酸性α-淀粉酶菌株固态发酵条件的优化[J]. 食品研究与开发, 2007, 28 (9): 91-94.
[20] 邵伟, 谈玉, 唐明, 等. 红曲霉产淀粉酶特性研究[J]. 中国酿造, 2006(7): 25-27.
[21] 张金伟, 曾润颖. 产复合酶菌株Pseudomonas sp.NJ197产酶发酵条件的研究[J]. 台湾海峡, 2005, 24(4): 520-525.
[22] 阎浩林, 苏昕, 周丽娜. 高活力碱性淀粉酶菌种的选育及培养条件研究[J]. 微生物学杂志, 1996, 16(4): 23-26.
[23] 陈远钊, 罗俊成, 胡佳, 等. 酸性α-淀粉酶菌株的诱变及酶的性质研究[J]. 中国酿造, 2007(1): 10-13.
[24] 陈波, 李大力, 杨树林. 酸性α-淀粉酶生产菌株的筛选和酶的纯化及酶的性质研究[J]. 食品科学, 2005, 26(5): 119-122.
[25] 莫新迎, 高梅莹, 韩丹, 等. 耐酸性α-淀粉酶产生菌筛选及培养基优化[J]. 中国酿造, 2010(4): 85-88.
[26] 贺胜英, 岑晓江, 闫丽娟, 等. 白曲霉产中温酸性α-淀粉酶固体发酵条件及粗酶酶学性质的研究[J]. 食品科技, 2010, 35(5): 6-10.
[27] 胡元森, 潘涛, 李翠香. 酸性α-淀粉酶的分离纯化与酶学性质研究[J]. 生物技术通报, 2010(3): 199-202.
[28] 田新玉, 周培瑾, 王大珍. 嗜盐碱性淀粉酶产生条件和性质的初步研究[J]. 微生物学报, 1994, 34(5): 355-359.
[29] 赵建, 兰小君, 苏俊, 等. 一株碱性淀粉酶产生菌Bacillus flexus XJU-3的分离鉴定及酶学特性分析[J]. 微生物学报, 2008, 48(5): 750-756.
Amylase from Penicillium sp. Strain PS031: Fermentation Conditions and Optimal Reaction Temperature and pH
ZHANG Jing1,LI Wei-dong2,XIAO Qiong-na1
(1. School of Life Sciences, Jiaying University, Meizhou 514015, China;2. Guangdong Meizhou Supervision Testing Institute of Quality and Metrology, Meizhou 514072, China)
The strain PS03 isolated from oil and preserved in our laboratory, which was a special bioactive strain belonging to the family of Penicillium sp., was solid-state cultured in a triangular flask to produce amylase in this work. The effects of medium composition and culture conditions on the production of amylase were examined. PS03 cultured in the medium consisting of 30.04% wheat bran, 3.70% soybean meal powder, 3.70% rise hull and 55.56% distilled water gave the highest amylase production. The optimal culture conditions were determined through single factor experiments to be: initial medium pH 3; the amount of the inoculated seed (containing108conidia/mL), 1.85%; culture temperature, 28 ℃; and culture time, 96 h. In addition,the crude enzyme solution obtained under the above conditions was sampled to determine optimal pH and temperature for the reaction of this enzyme. The amylase from PS03 showed high activity in a pH range between 2.0 and 10.0. The relationship between enzyme activity and pH was a double peak-shaped curve. The highest peak of enzyme activity was observed at pH 3,with 100% relative activity, and the peak of enzyme activity appearing at pH 9 was lower, indicating a relative activity of 84.98%.The optimal reaction temperature of this enzyme was 60 ℃, and the relative activity at 90 ℃ was 39.06%. It can be concluded through this study that the amylase produced by PS03 is a special acidic middle-temperature amylase having good tolerance to strong alkaline and acidic conditions as well as high temperature.
strain PS0312;Penicillium sp.;solid fermentation;amylase
Q55
A
1002-6630(2010)23-0294-06
2010-09-24
张镜(1957—),男,教授,硕士,主要从事天然产物与应用微生物研究。E-mail:zhangcqf@jyu.edu.cn
