海狗油脂肪乳对大鼠围产期毒性试验的研究
2010-10-23林飞于燕梁怿周立娜徐康森
林飞,于燕,梁怿,周立娜,徐康森
1.中国药品生物制品检定所,北京100050
2.西安交通大学医学院,西安710061
海狗油脂肪乳对大鼠围产期毒性试验的研究
林飞1,*,于燕2,梁怿1,周立娜1,徐康森1
1.中国药品生物制品检定所,北京100050
2.西安交通大学医学院,西安710061
观察了海狗油脂肪乳对大鼠妊娠晚期、分娩期、哺乳期及胚胎和胎仔出生后生长发育、学习能力以及生殖能力的影响.于大鼠妊娠D15至哺乳D21,连续皮下注射给予250、500和1000mg·kg-1剂量的海狗油脂肪乳,同时设0.9%氯化钠注射液为对照组,观察各组大鼠和胎仔的生长、发育、生殖能力等项指标.结果表明:给药后F0代母鼠体重增长明显减慢,摄食量显著减少,未见生殖、胚胎毒性反应;F1代仔鼠的出生体重和哺乳期体重增长减慢,生理达标、新生反射等发育迟缓;停药后F1代大鼠的体重增长、摄食量、脏器系数、同笼交配率、妊娠率及胚胎发育全过程未见明显生殖、发育等毒性变化.由此结论,海狗油脂肪乳可使母鼠和F1代仔鼠体重增长缓慢,生理发育迟缓,但不影响F1代仔鼠器官发育、生殖能力以及停药后体重增长和摄食量.
海狗油脂肪乳;大鼠;仔鼠;生长发育;生殖毒性
1 引言(Introduction)
海狗油是从北极海狗中提取的脂肪油,其ω-3多不饱和脂肪酸含量高达80%以上,其中二十碳五稀酸(EPA)、二十二碳五稀酸(DPA)和二十二碳六稀酸(DHA)的含量大于25%,具有降血糖、降血脂、保肝、抗前列腺增生等多种药理作用(林兰等,2002;李湛军等,2003).而目前临床应用于危重症患者、手术后或需要肠外营养剂病人的脂肪乳,主要从大豆油或鱼油中提取,是肠外营养时人体的重要能量来源,还可以提供必须脂肪酸,具有广泛地生物活性(江华等,2007).将海狗油制备成脂肪乳,改变临床用药途径后,更有利于人体的吸收和代谢;但药物直接注射进入体内,失去了胃肠道屏障作用,对人体的安全性需要高度关注.前期研究表明,海狗油脂肪乳无致突变作用(林飞等,2008)、无大鼠致畸胎作用(李华等,2008),本研究进一步探讨了其对大鼠围产期的毒性作用.
2 材料与方法(Materials and methods)
2.1 材料
2.1.1 受试药物
海狗油脂肪乳(Seal Oil Emulsion,SOE)为乳白色等渗液体,溶于水,浓度为30%,由中国生化制药协会海狗油应用专业委员会提供,批号20051110,4℃避光、密闭保存.试验前吸取30%海狗油脂肪乳60mL,加入0.9%氯化钠注射液(NS)30mL进行混悬并稀释至90mL,制成20%的浓度作为高剂量组;取20%海狗油脂肪乳30mL加NS 30mL稀释成10%的浓度作为中剂量组;取10%海狗油脂肪乳20mL加NS 20mL稀释成5%的浓度作为低剂量组,大鼠皮下注射(SC)给药容积为每100g体重0.5mL.
2.1.2 对照品
溶剂对照为0.9%氯化钠注射液(NS),每瓶500mL,批号0602115,由北京双鹤药业有限公司生产.
2.1.3 实验动物
选用中国药品生物制品检定所实验动物中心提供的SPF级SD种大白鼠雌性90只、雄性45只,体重250~280g,许可证号:SYXK(京)2006-0004号,大鼠按性别分笼,每笼5只,饲养观察1周后用于试验.
2.1.4 实验动物室
三级标准,全密闭状态,三级过滤送风,温度22℃~24℃,相对湿度40%~45%,日光灯12h照明.高压灭菌木刨花屑为垫料.塑料鼠盒体积35cm×30cm×18cm,不锈钢丝顶盖.SPF级大鼠繁殖颗粒饲料和去离子水均由中国药品生物制品检定所实验动物中心提供.
2.2 实验方法
实验方法参考文献(周海钧,2001;袁伯俊和王治乔,1997;国家食品药品监督管理局,2006).
2.2.1 实验分组
试验设有3个海狗油脂肪乳剂量组,高剂量组为1000mg·kg-1,中剂量组500mg·kg-1,低剂量组250mg·kg-1(以大鼠体重计)和等体积溶剂对照组(NS).
2.2.2 给药时间
每只妊娠鼠受孕的第15d至哺乳期第21d结束,每日SC给药1次,连续给药28d.每日根据大鼠体重增长情况增加给药体积.
2.2.3 同笼交配
将大鼠按雄:雌=2:1同笼交配,连续10d(2个性周期).每天上、下午进行阴道涂片检查,将显微镜下观察到精子的雌鼠确定为交配鼠,并作为妊娠0d.交配鼠按体重随机分到各组合笼饲养,每笼3~5只,每组交配鼠≥20只.
2.2.4 观察指标
a.一般表现:每日SC给药的同时观察每只妊娠鼠和哺乳鼠的精神、行为、活动、毛色、眼、鼻分泌物、粪便、分娩时间及哺乳状态等.
b.称重:在妊娠期第0、6、10、15、18、20d和分娩后的1、7、14和21d称取每只F0代大鼠体重.哺乳期第1、7、14和21d称取每只F1代仔鼠体重.选择F1代仔鼠雌、雄各10只在出生后第4~10周龄,每周称取一次体重.在妊娠期第0、6、10、15、18和20d称取F1代妊娠鼠体重.
c.摄食量:F0代大鼠在整个妊娠期和哺乳期每周测定一次摄食量;F1代大鼠雌、雄各10只在出生后的第4~10周龄每周测定一次摄食量.
d.计数:每窝胎仔总数、活胎数、死胎数、外观畸形胎数、出生存活率、哺乳期存活率.
e.定员:每窝尽可能保留4对体形健壮的仔鼠,多余仔鼠去除,不足8只仔鼠的补充(补充的仔鼠考虑性别,必须在哺乳母鼠的粪便中翻滚数次,母鼠口、鼻处涂抹异味剂,防止咬食非亲生乳鼠)
f.生理发育:每窝全部仔鼠在生长期观察耳廓分离、上门齿萌出、开眼、出毛、外耳道张开、睾丸下降和阴道张开等达标日龄的组织器官发育.
g.新生反射:每窝全部仔鼠在生长期观察仔鼠平面翻正、悬崖回避、负趋地性、行走和空中翻正等达标日龄的神经反射发育.
h.学习能力及神经行为:每窝6只仔鼠在出生28日龄时,进行游泳试验和暗室电击试验.
i.内脏检查:进行游泳及暗室电击试验后,每窝处死F1代仔鼠雄、雌各2只,解剖后观察内脏器官是否存在异常变化,剪取心、肝、脾、肺、肾、睾丸连附睾、子宫连卵巢和脑等脏器并称重,计算脏器系数.
j.生殖行为和胚胎毒性:每窝保留28日龄的F1代仔鼠雌、雄各1只,每组保留共20只,分笼喂养到出生第10周后,以雌:雄=1:1同笼交配1周,观察交配率和妊娠率.在妊娠第20日处死F1代母鼠,检查黄体数、着床数、活胎数、死胎数、吸收胎数、体表畸形胎数、胎仔体重和性别.
2.3 数据处理
数据用平均值±标准差(x±s)表示,采用SPSS 11.0进行方差分析和X2检验.
3 结果(Results)
3.1 F0代妊娠鼠
3.1.1 一般情况
给药期间溶剂对照组和给药各剂量组每只妊娠鼠的精神好、行为正常、活动自如、被毛润泽、眼、鼻无分泌物和血迹、无稀便等.
3.1.2 体重及摄食
海狗油脂肪乳对F0代雌性大鼠妊娠期和哺乳期体重增长和摄食量的影响如表1、表2所示.妊娠末期中、高剂量组体重增长缓慢;哺乳期大鼠体重增长缓慢更加明显,与溶剂对照组比较,统计学分析具有极显著性差异(p<0.01).妊娠末期及哺乳期给药各剂量组的大鼠摄食量显著减少,与溶剂对照组比较,统计学分析具有极显著性差异(p<0.01).
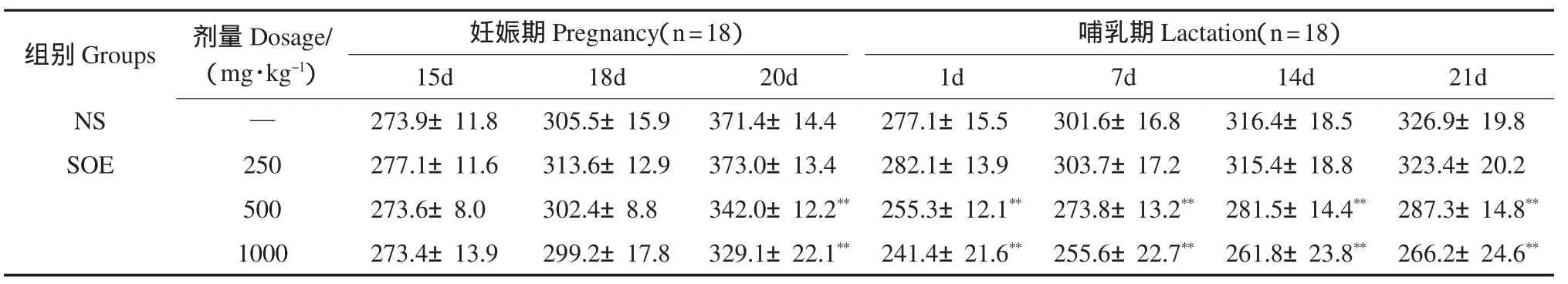
表1 海狗油脂肪乳对F0代雌性大鼠妊娠期和哺乳期体重增长的影响(x±s.g)Table 1The effects of Seal Oil Emulsion in different period on the weight gain of F0rats(x±s,g)

表2 海狗油脂肪乳对F0代雌性大鼠妊娠期和哺乳期摄食量的影响(x±s,g/100g)Table 2The effects of Seal Oil Emulsion on the appetite of F0rats(x±s,g/100g)
3.1.3 分娩与哺乳
溶剂对照组和给药各剂量组妊娠鼠未见流产,其分娩时间均在妊娠第21~22日;窝产仔鼠数在7~15只;哺乳期间未见拒绝哺乳和攻击乳鼠等现象出现.
3.2 F1代仔鼠
3.2.1 产仔数和存活率
溶剂对照组和给药各剂量组的胎仔总数、活胎数、死胎数、外观畸形胎数和出生存活率均未见异常.高剂量组的胎仔体重(5.3±0.4)g和哺乳期存活率(93.7%)出现数值降低,与溶剂对照组((5.7±0.3)g;97.9%)比较,统计学分析具有显著性差异(p<0.05).
3.2.2 仔鼠体重
海狗油脂肪乳对F1代仔鼠体重增长的影响如表3所示.给药中、高剂量组在不同的哺乳期出现体重增长缓慢,与溶剂对照组比较,统计学分析具有显著性差异或极显著性差异(p<0.05或<0.01).各组随机保留的雌、雄各10只仔鼠,在离乳后至性成熟的7周时间中,给药各剂量组的大鼠随着脱离药物的时间延长,体重增长和摄食饲料量逐渐恢复正常,与溶剂对照组比较,仅在离乳中、晚期之前统计学分析具有显著性差异或极显著性差异(p<0.05或<0.01).

表3 海狗油脂肪乳对F1代仔鼠体重增长的影响(x±s,g)Table 3The effects of Seal Oil Emulsion on the body weight gain of F1rats(x±s,g)
3.2.3 生理发育
海狗油脂肪乳对F1代大鼠生理标志达标日龄的影响如表4所示.给药中、高剂量组的门齿萌出、睾丸下降和阴道张开达标日龄明显推迟,与溶剂对照组比较,统计学分析具有显著性差异或极显著性差异(p<0.05或<0.01).

表4 海狗油脂肪乳对F1代大鼠生理标志达标日龄的影响(x±s,d)Table 4The effects of Seal Oil Emulsion on the physiological indexes of F1rats(x±s,d)
3.2.4 新生反射
海狗油脂肪乳对F1代大鼠新生反射达标日龄的影响如表5所示.给药中剂量组的平面翻正达标日龄、高剂量组的平面翻正和空中翻正达标日龄明显推迟,与溶剂对照组比较,统计学分析具有极显著性差异(p<0.01).
3.2.5 学习能力及神经行为测试
海狗油脂肪乳对F1代仔鼠学习能力的影响如表6所示.给药高剂量组的仔鼠空间定位建立时间增加不明显,仔鼠逃离水患潜伏期的时间明显延长,与溶剂对照组比较,统计学分析具有极显著性差异(p<0.01).给药高剂量组暗室电击条件反射建立时间明显延长,建立记忆次数明显增加,与溶剂对照组比较,统计学分析具有显著性差异或极显著性差异(p<0.05或<0.01).

表5 海狗油脂肪乳对F1代大鼠新生反射达标日龄的影响(x±s,d)Table 5The effects of Seal Oil Emulsion on the neonatal reflexes of F1rats(x±s,d)

表6 海狗油脂肪乳对F1代仔鼠学习能力的影响(x±s)Table 6The effects of Seal Oil Emulsion on the ability of learning of F1rats(x±s)
3.2.6 脏器检查及称重
哺乳期结束后,解剖仔鼠未发现内脏器官发育不全或畸形.给药各剂量组的心、肝、脾、肺、肾、睾丸、附睾、子宫、卵巢和脑等各脏器系数值基本一致,与溶剂对照组比较,统计学分析未见显著性差异(p>0.05).
3.2.7 妊娠鼠体重增长
妊娠期间体重增长明显,各组大鼠体重增长值基本一致,与溶剂对照组比较,统计学分析未见显著性差异(p>0.05).另外未发现大鼠在妊娠中、后期出现流产和死亡.
3.2.8 生殖行为和胚胎毒性
给药各剂量组的出生第11周龄大鼠性冲动(追逐、嘶咬、爬背和性交等)和性周期(阴道涂片镜检)基本正常,同笼交配率和妊娠率基本一致;胚胎的黄体数、着床数、活胎数、死胎数、吸收胎数、胎仔体重和性别等均无明显变化,与溶剂对照组比较,统计学分析未见显著性差异(p>0.05).
4 讨论(Discussion)
脂肪乳从上个世纪60年代开始应用于外科及危重病人的营养支持.第一代脂肪乳是以大豆油为基础原料,富含ω-6脂肪酸的亚油酸,该亚油酸过多摄入可出现某些生理失调、中枢神经系统紊乱、过敏反应和多种脏器器官的损害等(喻涛等,2007).而鱼油中存在的ω-3多不饱和脂肪酸除对人体具有更多的生物活性作用外,还有减少上述毒副反应的作用(于健春和郭卫东,2006);海狗油含有的ω-3多不饱和脂肪酸更多,药理作用更广泛,临床治疗和预防的前景更大.
围产期毒性试验是近年来我国与国际接轨,对创新药所要求的必做项目,国内文献在受试药品的剂量设计、动物数量、试验指标设定、观察内容和数据统计方法等差别较大(林飞等,2007;方铝等,2004;曹采蘋等,1997).为了规范试验方法,国家食品药品监督管理局参照《药品注册的国际技术要求(ICH)》(周海钧,2001),制订了我国的《药物生殖毒性研究技术指导原则》,该指导原则的实施将规范试验方法,促使围产期毒性试验的发展和提高.围产期毒性试验所要求的试验项目较多,虽然各实验室在每个项目中选择的试验指标有所不同,但以能够观察确定不同时期、不同生长发育阶段动物的毒性反应即可,不做具体的要求(国家食品药品监督管理局,2006).
母鼠分娩的仔鼠数一般在8~14只,个别母鼠分娩的仔鼠数少则1、2只或多则16只以上.如果窝仔鼠数差别过大,势必影响母鼠的喂养质量(孙靖,2005),乳汁不足,母鼠消瘦,胎仔生长发育缓慢等.为了减少窝仔鼠的数量差异所造成的组内数值差异过大,影响组间的统计学分析和判定,选择窝仔鼠数8只,多余仔鼠剔除,不足仔鼠补充(异窝仔鼠需在哺乳母鼠的粪便中反复滚动,哺乳母鼠的口鼻涂抹异味剂,以防攻击仔鼠),使组内数值差异缩小,组间比较更容易发现毒性反应.
海狗油脂肪乳可使给药各剂量组F0代大鼠妊娠后期及哺乳期体重增长明显降低,摄食量显著减少和胎仔体重减轻;对给药各剂量组F1代仔鼠的出生体重、哺乳期体重和离乳后体重均出现增长缓慢;对生理发育、新生反射、学习能力及神经行为等出现发育迟缓;但对给药各剂量组F0代雌性大鼠的分娩时间、窝产仔数、活胎仔数、死胎仔数、体表畸形胎仔数和胎仔出生存活率等未见毒性反应;对给药各剂量组F1代大鼠的脏器系数值和妊娠鼠体重增长等未见明显变化;对给药各剂量组F1代性成熟大鼠的同笼交配率、妊娠率及胚胎发育全过程等未见明显生殖、发育等毒性反应.
本研究提示:海狗油脂肪乳可使F0代妊娠鼠摄食量减少、体重增长缓慢,由此出现乳汁相对减少或药物通过乳汁作用于F1代仔鼠,出现仔鼠在哺乳期和离乳期的体重增长缓慢,出生后生长发育、学习能力及神经行为等发育滞后等.但对F0代雌性大鼠的分娩时间、胚胎发育和胎仔出生存活率等未见毒性反应;对F1代大鼠的内脏器官的发育、性成熟时间、同笼交配率、妊娠率、妊娠鼠体重增长及胚胎发育等未见明显生殖、发育等毒性反应.
Cao C P,Huang Z N,Yan D P,Shi M H.1997.Perinatal toxicity strudy of antibiotic 89-07[J].Chinese Journal of Antibiotics,22(5):377-381(in Chinese)
Fang L,Zhang J M,Yu H.2004.Influence of aiyincuiru liquid on the development of young puerperal mice[J].Drug Evaluation,1(4):287-289(in Chinese)
Jiang H,Jiang Z M,Cai W,Tao Y X,Wang X R.2007.Emulsion[J].Chinese Journal of Clinical Nutrition,15(1):17-19(in Chinese)
Li H,Lin F,Liang Y,Xu K S.2008.Teratogenicity of seal oil emulsion in rats[J].Carcinogenesis,Teratogenesis&Mutagenesis,20(6):477-480(in Chinese)
Li Z J,Lin F,Le J J,Yan A Z,Xu K S.2003.Inhibiting effect of seal oil ω-3 polyunsaturated fatty acids on experimental benign prostatic hyperplasia[J].Chinese Journal of Pharmaceutical Analysis,23(3):176-180(in Chinese)
Lin F,Liang Y,Song R X,Xu K S.2008.Examination of the mutagenetic effect in the fat emulsion of seal oil[J].Journal of Practical Oncology,22(4):313-316(in Chinese)
Lin F,Yu Y,Liang Y,Hu S,Sun X.2007.The toxic effects of ethaselen during perinatal period in rats[J].Carcinogenesis,Teratogenesis&Mutagenesis,19(4):320-323(in Chinese)
Lin L,Xin Y,Xu K S.2002.Development of polyumsaturated fatty acid from seal oil[J].Progress in Pharmaceutical Sciences,26(1):30-32(in Chinese)
State Food and Drug Administration.2006.Guiding Principle for Technology of Drug Reproductive Toxicity Study[S].Beijing:State Food and Drug Administration(in Chinese)
Sun J.2005.Basis of Laboratory Animal Science[M].Beijing:Science&Technology Press,52-57(in Chinese)
Yu J C,Guo W D.2006.Biological characteristics and research status on fish oil emulsion[J].Journal of Clinical Surgery,14(4):243-245(in Chinese)
Yu T L,Jun L G,Wu Z L,Wang J K.2007.Study on liver spleen and lung toxicity of the fat emulsion injection in rats[J].Pharmaceutical Journal of Chinese People’s Liberation Army,23(1):43-45(in Chinese)
Yuan B J,Wang Z Q.1997.Preclinical safety evaluation and practice of pharmaceuticals[J].Beijing:Military Medical Press,117-151(in Chinese)
Zhou H J.2001.The International Technical Requirements of Drug Registration-the Safety Part[M].Beijing:People’s Medical Publishing House,87-113(in Chinese)
中文参考文献
曹采蘋,黄正南,颜丹平,史民华.1997.抗生素89-07围产期毒性试验[J].中国抗生素杂志,22(5):377-381
方铝,张俊明,余华.2004.爱婴催乳液对围产期仔鼠生长、发育的影响[J].药品评价,1(4):287-289
国家食品药品监督管理局.2006.药物生殖毒性研究技术指导原则[S].北京:国家食品药品监督管理局
江华,蒋朱明,蔡威,陶晔璇,王秀荣.2007.脂肪乳[J].中国临床营养杂志,15(1):17-19
李华,林飞,梁怿,徐康森.2008.海狗油脂肪乳对大鼠致畸毒性研究[J].癌变·畸变·突变,20(6):477-480
李湛军,林飞,乐嘉静,阎安庄,徐康森.2003.海狗油ω-3多不饱和脂肪酸对实验性前列腺增生的抑制作用[J].药物分析杂志,23(3):176-180
林飞,梁怿,宋瑞霞,徐康森.2008.海狗油脂肪乳的致突变试验研究[J].实用肿瘤学杂志,22(4):313-316
林飞,于燕,梁怿,胡森科,孙晓英.2007.乙烷硒啉对大鼠围产期毒性的研究[J].癌变·畸变·突变,19(4):320-323
林兰,忻余,徐康森.2002.海狗油多烯脂肪酸的开发利用[J].药学进展,26(1):30-32
孙靖.2005.实验动物学基础[M].北京:北京科学技术出版社,52-57
于健春,郭卫东.2006.鱼油脂肪乳剂的生物学特性及其研究现状[J].临床外科杂志,14(4):243-245
喻涛,刘俊,李纲,吴子伦,王家葵.2007.脂肪乳注射液对大鼠肝脾肺的毒性研究[J].解放军药学学报,23(1):43-45
袁伯俊,王治乔.1997.新药临床前安全性评价与实践[M].北京:军事医科出版社,117-151
周海钧.2001.药品注册的国际技术要求(安全性部分)[M].北京:人民卫生出版社,87-113◆
The Toxic Effects of Seal Oil Emulsion on Rats during Perinatal Period
LIN Fei1,*,YU Yan2,LIANG Yi1,ZHOU Li-na1,XU Kang-sen1
1.National Institute for the Control of Pharmaceutical and Biological Products,Beijing 100050
2.Department of Public Health,College of Medicine of Xi’an Jiaotong University Xi’an 710061
In order to observe the toxic effects of Seal Oil Emulsion on the maternal rat in late trimester of pregnancy,the growth and development,and the abilities of learning and procreation of the offsprings,SD pregnant rats were given Seal Oil Emulsion orally from gestational day 15 to weaning day 21.The experimental groups
250、500 and 1000mg·kg-1of Seal Oil Emulsion.Results showed that the body weight accretion and appetite of maternal rat(F0)in experimental groups was significantly lower than that in negative control group(p<0.05).The body-weight of the offsprings(F1)at birth and accretion during lactation were significantly decreased(p<0.05).The physiological indexes and neonatal reflexes were delayed significantly(p<0.05).But there were no toxic effects on the body weight gain,appetite,visceral measurements,mating ratio,pregnancy ratio and fetal development on stopping drugadministration.It was indicated that among the range used,Seal Oil Emulsion caused obvious body weight accretion in F0and F1,and developmental delay.But there were no the toxic effects on the visceral development,reproductive ability,body weight increase,and appetite on stopping the drug.
Seal Oil Emulsion;rat;fetus;development;reproductive toxicity
20 March 2009accepted17 August 2009
1673-5897(2010)1-105-07
R965.3
A
2009-03-20录用日期:2009-08-17
林飞(1954—),研究员;*通讯作者(Corresponding author),E-mail:linfeibj@yahoo.com.cn
林飞(1954—),研究员,主要从事药品、保健食品的安全性研究.
