海水鱼类人工选育的方法和研究概况
2010-10-23区又君
吉 磊, 区又君
(1. 中国水产科学研究院 南海水产研究所, 广东 广州, 510300; 2. 上海海洋大学 水产与生命学院, 上海,201306)
海水鱼类人工选育的方法和研究概况
Methods and progress of artificial selective breeding on marine-fish
吉 磊1,2, 区又君1
(1. 中国水产科学研究院 南海水产研究所, 广东 广州, 510300; 2. 上海海洋大学 水产与生命学院, 上海,201306)
近 30多年以来, 海水鱼类养殖业迅速发展, 养殖面积和规模越来越大, 养殖的种类、数量越来越多。2008年, 中国海水养殖产量1 340.32万t, 占海水产品产量的51.59%, 其中, 鱼类产量达74.75万t,并保持着增长的态势[1]。但是, 作为世界第一水产养殖大国, 在每年输出数百万吨水产品的同时, 更应该清楚地看到中国海水养殖业存在的主要问题与矛盾。尤其是海水鱼类遗传育种工作起步较晚, 研究基础薄弱, 大多数养殖种类的繁育问题没有攻破, 现有的一些养殖品种由于缺乏科学的管理和育种, 经几代繁殖后品质逐步衰退, 这在很大程度上制约了海水鱼类养殖业的发展; 因此, 如何提高养殖的科技含量, 培育出生长快、肉质好、饵料转化率高、抗逆性强的优良品种成为了当前海水鱼类育种的主要任务。
改变育种对象遗传性质的常规方法有两个: 一个是选择, 即挑选作为亲本用的个体; 另一个是遗传操作, 即控制亲本的交配方式, 如近交和杂交[2]。但是无论用何种方法, 最终都要经过挑选亲本进行繁殖这一步骤, 可见选择是育种工作中一个极为重要的环节。选择育种的主要目的是从某一个原始材料中或某一群体中选出最优良的个体或类型, 满足特定的生产目的和要求。鱼类选择育种的方法包括自然选择和人工选择, 人工选择又包括个体选择、系谱选择、家系选择、家系内选择、混合选择和后代测定。目前水产养殖领域选择育种研究主要集中在贝类, 虾类及淡水鱼类, 而对于海水鱼类的选择育种的报道相对较少; 选育的性状大多是生长速度[3~9],饵料转化率[10~15], 抗病性能[16~21], 性成熟年龄[22~27],产卵时间[28~32]等方面, 作者以海水鱼类为例, 对 6种选育方式进行介绍, 并对海水鱼类人工选择育种过程中存在的问题提出一些建议, 为进一步研究做参考。
1 选择效应的计算
选择本身并不能产生新基因, 它可以增加鱼类某一种群体内具有育种价值的基因频率, 降低育种不需要的基因频率, 可以控制变异的发展方向, 促进变异的积累, 创造新的品质[33]。在育种过程中, 人们关注的是由选择所产生的变化, 这种变化指被选择的亲本后代与未选择的亲本之间的平均表型差异,反应在数值上即群体平均值的改变, 遗传学中称之为选择反应或遗传获得, 用 R表示; 而被选择的亲本所具有的平均优势称为选择差, 指被选择的亲本个体的平均表型值偏离选择前亲代中所有个体平均表型值的程度, 用 S表示, 是度量选择反应(R)的一个参数。根据Falconer等[33]的推导, 当选择对象的生殖力和存活力与所选择的性状表型值不相关时, 选择效应和选择差的比值则等于遗传力, 用 h2表示,从而得出选择效应公式为:2R hS= 。为了减小误差,数据处理过程中通常用标准差来度量群体或性状的变异程度, 也即用表型标准差pσ来表示选择差, 被标准化的选择差称为选择强度, 用符号 i表示,i=S/σp, 从而期望选择效应也就可以写成R=ih2σP。如 Bolivar等[34]对海水养殖罗非鱼(Oreochromis niloticus)的体质量进行家系内选择, 结果得出第一代的选择强度为 5, 遗传力为 0.14,平均标准差为7.15g, 由此推出第一个世代的选择效应为 0.7g; 经12代选择后的遗传获得比较明显。如果想得到每年的选择效应而不是每一代的, 那么就要除以世代间隔的时间, 以 L表示年计算:R / year=ih2σp/L。不同的选择方法其选择效应的表达方式也不一样, 这将在下面的几种选育方法中分别介绍。
2 人工选育的方法
2.1 个体选择
个体选择是依据个体本身的表型值进行选择。具体地说, 选留或淘汰亲鱼, 主要取决于个体生产性能或某种经济性状的优劣, 优者留种而劣者淘汰。个体选择的主要方向包括个体的外形评定、生长发育和生产性能的测定等。个体的性能资料通常能从其亲属资料中得到补充, 如作为个体系谱组成部分的双亲、全同胞或半同胞, 或它的后裔。根据个体本身性能而进行的个体间比较也常常称为性能测验,这种选种方法不仅简单易行, 并且无论正反方向选择, 都能取得明显的遗传效应, 如 Fevolden等[35]比较海水养殖虹鳟(Oncorhynchus mykiss Walbaum)选育个体在应激环境下血液中皮质醇水平和溶菌酶活力发现, 虽然两者呈显著负相关, 但亲本对子代的遗传贡献都比较大, 选择效果明显。由于只是对表型值进行选择, 所以个体选择效果的有无和大小与被选择性状的遗传力关系极为密切。只有遗传力高的性状,个体选择才能取得良好效果, 而遗传力低的性状如果进行个体表型值选择, 由于选择反应不大, 选择的效果一般不能确实肯定。一般经验认为, 个体选择对于遗传力为 0.20以上的性状是适宜的[36]。Bernard[37]对法国海(Salmotrutta fario)的生长速度的个体选择, 其遗传力为 0.25, 结果得出第一年选择组的体长平均增加 6.2%, 体质量增加 21.5%。Vandeputte等[38]对精养和混养的欧洲黑鲈(Dicentrarchus labrax)的体质量进行选择, 其遗传力分别为 0.34和 0.60, 结果体质量分别增长 23%和42%。对于个体选择的选择效应的估测, 可以利用以下公式[33]:
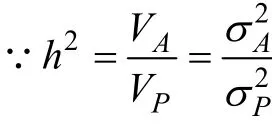
一般来说, 通过提高选择强度而获得更大遗传改进量的潜力是有一定限度的, 因为要提高选择强度, 就要加大选择压力和选择差, 这就要减少留种数量; 而留种数量太少时, 容易发生近交, 从而导致不良后果。Dupont-Nivet等[39]通过计算机模拟不同数量的交配亲本对个体选择效果的影响发现差别很大, 当亲本数量为1 000时, 遗传力只有0.1, 且近亲交配出现的概率高; 而当亲本数量增加到 5 000时,遗传力达到 0.5, 近交现象也降低了。对于表型标准差的大小, 也要具体分析, 过大的标准差可能存在着与环境离差太大的问题。通过提高遗传力而获得更大遗传改进量的潜力也有限, 因为对于一个特定性状来说, 要提高其遗传力不容易, 只有尽可能控制饲养管理条件, 减少环境影响变异, 以提高估计遗传力的可靠性。
2.2 系谱选择
系谱是记载选择对象的祖先的编号、名字、出生年月日、生产性能、生长发育表现、种用价值和鉴定成绩等方面资料的文件。系谱选育是建立在选育对象的亲本、祖代以及更遥远的祖先的性能或育种值基础上的。系谱上的各种资料, 来自日常的各种原始记录。系谱一般记载3~5代, 这已足够鉴定种鱼之用, 因为代数太远的祖先, 对种鱼的影响很小[40]。其原理是根据父母和其他祖先的表型值, 来推断其后代可能出现的品质, 以便在出生后不久, 即能基本确定后备个体的选留。审查系谱时, 可将多个系谱各方面资料, 直接进行有针对性地分析对比,即亲代与亲代比, 祖代与祖代比。具体比较内容是,各祖先个体的体质量、生产力、外形评分、后裔成绩等指标的高低, 经全面权衡后, 决定个体的选留。传统的系谱选择方法需要记载的资料太多, 数据处理繁琐, 不适合应用于鱼类这种亲本数量较多的物种的选育上。目前主要运用于鱼类系谱分析的是基于分子标记的系谱分析法。利用分子标记的特异性,不仅减少了工作量, 还大大缩短了研究的时间, 因为无需等到个体长大至可测量尺寸再取样。Sekino等[41]分别抽取了日本牙鲆(Paralichthys olivaceus) 3个家系中24 h, 1个月和4个月大的个体, 利用微卫星标记分析了其系谱结构, 并对其选育效果进行了测算, 结果发现备选亲本对子代的遗传贡献发生了高度偏移; 其中一个家系的选择效果明显, 另外两个较低。
审查系谱时应注意: 凡在系谱中, 母本的生殖力大大超过种群平均数, 父本经后裔测验证明为良,或所选后备亲鱼的同胞也都性能优越, 这样的系谱应给予较高的评价; 审查重点应放在亲代的比较上,更高代数的遗传相关对选择意义不大; 比较生产性能时应注意其年龄和代数是否相同, 若不同, 则应进行必要的校正; 注意系谱各个体的遗传稳定程度;在研究祖先性状的表现时, 注意其在表型上有无遗传缺陷, 需要结合当时的管理水平和环境条件考虑其性能; 对一些系谱不明, 来源不清的亲鱼, 即使个体本身的表型优良, 开始也应控制使用, 直到取得后裔测验证明后才可确定其使用范围。一般地讲, 系谱选择的准确性不可能很高, 很少单独用于育种,在海水鱼的育种上通常用于遗传与环境的交互效应分析以及选择性状的遗传力分析。Fishback等[42]利用分子系谱估测环境和遗传的交互效应对海鳟(Oncorhynchus mykiss)选育群体生长性状的影响, 结果表明单个性状的估测意义不大, 要想获得准确的结果必须综合多种方法分析多个性状。Dupont-Nivet等[43]利用分子标记系谱分析遗传力和遗传与环境因素对欧洲黑鲈生长的影响发现选育群体母体效应较小, 遗传力为 0.38~0.44, 遗传与环境的互作关系明显。
2.3 家系选择
根据某个或某几个性状明显优于其亲属、生产性能显著高于其亲属的混有不同类型的原始群里选出一些优良个体留种, 建立几个或若干个家系并繁殖后代, 逐代与原始群体及对照品种相比较, 选留那些符合原定选择指标的优良系统, 进而进行品系性能测定, 这叫家系选择[33]。早在上个世纪, 挪威对大西洋鲑(Salmo salar)、芬兰对虹鳟利用家系选育,分别成功地选育出优质大西洋鲑家系和虹鳟家系,它们的每代生长速度均提高10%[44]。在家系选择中,只根据家系均值, 而不考虑家系内偏差, 选留或淘汰亲本, 并不是以个体表型值的大小为依据, 而是以家系均值的大小为依据, 以家系为单位进行选择,整个家系要么被选择, 要么被淘汰。而个体表型值除了作为家系均值的组成因素外, 它本身在选择上没有特别的意义。育种者可根据实际情况, 确定家系的选留或淘汰标准, 高于标准者为优秀家系, 是选留对象; 低于标准的为普通家系或较差家系, 是淘汰的对象。陈松林等[45]在对牙鲆不同家系抗病性能测定时, 将成活率设置成 4个梯度来判断其抗病能力,结果筛选出抗病力强、较强、一般和差的家系数分别为3个, 17个, 33个和6个。
家系分为两种, 由相同的亲本产生的称为全同胞家系; 由同父异母或者同母异父产生的称半同胞家系。后裔选择和同胞选择是家系选择的两种特殊形式, 当所选性状不能在个体上直接测量时, 这两种方法具有特殊的价值, 那便是通过对子代的表型特征的观测来判断亲本的性状, 并估测其育种值。李云明等[46]对大黄鱼(Pseudosciaena crocea)4个家系第三代个体的肌肉营养成分差异分析, 结果得出其肉质遗传变异尚少, 需继续进行家系选育。家系选育的好坏关键在于正确运用好近亲交配和系的建立。近交和选择是家系选育中建系的重要手段。对任一给定的选择强度, 与个体选择比较, 家系选择会提高近交率。Neira等[47]对银大马哈鱼(Oncorhynchus kisutch)的收获体质量进行连续 4代选择后, 奇数年出生的个体平均近交率达10%。一个群体近交繁殖,如果不经选择, 后代群体中的显性基因数目和隐性基因数目的比值并不改变。累代近交繁殖, 可以使原来混杂的群体或杂种个体不断的纯合化, 使隐性基因的纯合体百分率增加, 隐性性状因而有表现机会[33]。但若能在近交繁殖的同时进行严格选择, 可以积累有利基因, 并减少隐性基因, 防止近亲繁殖带来的不良后果。生产上, 从一个混杂的群体或一个杂交体中分离出的种种不同的家系, 各系间成员彼此有明显的差异, 通过近亲繁殖可以分离出若干性状性状良好、个体整齐的家系、小家系或自交系, 每系内的个体由于有比较高度而又相同的纯合百分率,就有基本一致的表现型,性状就稳定, 该家系才是纯系, 通过繁育成为改良品种。这也就说明了在选择过程中应用近亲繁殖的必要性。
家系选择也有一定的适用范围: 所选性状的遗传力低; 个体间的差异主要由遗传因素造成; 当共同环境因子造成家系成员间很相似时, 家系选择无效, 因为此时家系间表现出的差异可能是环境因素引起的, 而选择的目的是区别遗传原因产生的差异;家系较大时, 家系选择优于个体选择。共同环境条件下, 家系平均观测值可能接近于基因型值。家系中的成员数越多, 这种估测效果越好。家系选择的选择效应可以通过以下公式来计算[48]:
其中,fR表示家系选择的效果; i表示家系间的选择强度;fσ表示家系均值标准差;2fh表示家系均值遗传力; h2表示家系遗传力;Pσ表示表型标准差; n代表家系数, r表示组内相关;Ar表示遗传相关;BMS表示组间均方; VA表示加性遗传方差, VP表示表型方差,VA(f)表示家系均值加性遗传方差, VP(f)表示家系均值表型方差。
家系选择虽有两个主要的缺点: 家系间如果太密集很容易造成近交; 家系之间只传递 50%的加性遗传方差, 也就是说只有一半的变异可用, 另一半在家系内传递。但是家系选择以其个体数多, 环境差异低, 收获遗传力大的特点, 不失为遗传力较低性状选育的有效方法。
2.4 家系内选择
家系内选择与家系选择相反, 是根据个体表型值与家系均值的离差而进行的选择, 即从每个家系中挑选个体表型值高的个体。根据家系内偏差Pw进行选择, 而完全不考虑家系均值 Pf的高低。这种方法对下一代而言, 至少保留了每个家系中的一个成员, 所以, 家系内选择对减缓种群近交问题大有益处。当家系间的差异主要由环境差异(可能因为不同的家系进行了不同的处理)引起时, 家系内选择最为有效, 这是其优越于其他方法之处。这种情况为寻求家系内遗传差异, 例如组成家系的同胞之间的差异,提供了更多机会[49]。Gall等[50]比较了6种选择方法对虹鳟母本生殖能力的选择效果, 结果发现家系内选择、混合选择及同胞选择的效果最为明显。与家系选择相比, 家系内选择的另一个最重要的优势在于其所需要的育种空间比较小, 因此很适合于在实验室进行。家系内选择的选择效应为[48]:

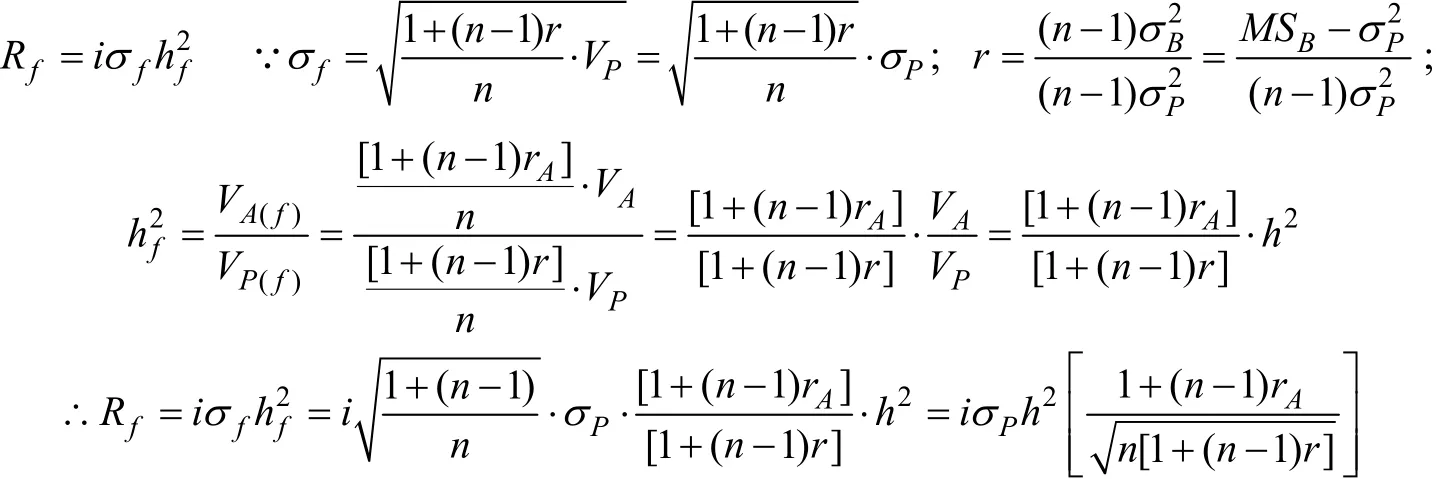
其中σP表示表型标准差, h2表示遗传力, n代表家系数, r表示组内相关, rA表示遗传相关。但是和其他选择方法相比, 家系内选择效率相对较低。Gall等[51]通过比较各种选育方式对虹鳟体重的选择效应发现, 家系内选择的效率要比综合选择的效率低 2倍。
2.5 后代测定
后代测定又称亲本选择, 是根据后代的平均表型值来评价其亲本的育种值的个体选择方法, 也就是在一致的条件下, 对种鱼的后代进行对比测验,然后按各自后代的平均成绩, 决定对亲本的选留与淘汰。后代测定法所依据的原理是: 每一后代从每一个亲本得到一半的遗传性。后裔选择的准确性高, 因为亲鱼的优良性能已由其后代所证实。因此, 它是评定选育对象种用价值最可靠的方法。但亲鱼的选定时间太长, 因为必须等到其后代达到可测量的尺寸且有了生产记录以后, 才能得到选择所依据的资料,这样就大大地延长了世代间隔, 减慢了遗传进展。而且也不能将所有后代都留到生产性能成绩表现出来的年龄, 那将导致由饲养管理而带来经济负担过重的问题。这使得对于那些只产一次卵或者在产卵过程中及过后出现高死亡率的鱼类来说, 如大西洋鲑,后代测定很难进行。
在家畜的育种中, 后裔选择适用于利用年限较长且公畜利用率较高的动物, 如奶牛的选种, 因为后裔选择需时间长, 耗费较多。而应用于鱼类育种上,为提高选择的准确性和选择反应, 应注意以下几点:用于选育的雌、雄鱼应尽可能在品种、年龄、大小、生理等方面相似, 以减小误差; 后裔与后裔之间及后裔与亲代之间的饲养管理条件应尽可能一致, 即应混养, 以减少群间效应; 如 Vandeputte等[52]在对黑鲈的品系测验中, 后裔的选择严格按照随机且等概率从混养家系中挑选, 以减小实验误差; 选择指标要全面, 不仅要重视后裔的繁殖能力表现, 同时还要注意其生长发育、体形外貌及对环境的适应性。
2.6 综合选择
综合选择就是在选择育种的过程中综合各种方法从而使用最好的方法来掌握个体的育种值、个体特征、全近交或半近交等信息。综合选择法的目的就是为了得到最大的遗传获得。其他的选育方法都是综合选择的一部分。简单的综合选择方法一般是将家系选择和个体选择综合起来, 利用家系偏差来体现个体的平均表型值。通常分为以下几个步骤:(1)建立几个家系, 进行异质型、非亲缘的亲鱼间杂交,从而鉴定出其生产性能, 如生殖能力、生长速度、肉质、抗性等; (2)在几个较好的家系中进行选择。如果家系较大可以适当增大选择压力与强度[34]; (3)对后代亲鱼进行检测。Bentsen等[53]设计综合选择法以避免高近交率,连续15代选择后得出亲本选留至少要50对, 且每代每对要挑选 30~50个后代进行严格且标准的测验, 否则近交会减少30%多的选择效果。
3 问题与展望
海水养殖业是海洋渔业的重要组成部分, 优良的养殖品种又是海水养殖业发展的原动力, 但目前世界上除挪威和中国外, 大多数国家的水产业还处于以捕捞为主, 养殖为辅的阶段[44]。其次, 由于海水鱼类育种还处于摸索阶段, 各项技术还很不成熟,对于优良性状的获得与优良品种的构建与保持仍然存在很多尚未解决的问题。对于海水鱼类的育种研究滞后于淡水鱼类及其他海洋生物的原因, 作者归纳为3个方面:
3.1 养殖品种的繁殖周期长
一些重要的经济海水鱼类养殖品种的性成熟较长, 如黄姑鱼(Nibea albiflora)3龄性成熟, 红拟石首鱼(Sciaenops ocellatus)4龄性成熟[54]; 还有部分养殖品种存在性逆转的现象, 且性逆转的时间较长, 如赤点石斑鱼(Epinephelus akaara)3年才性成熟, 6龄性逆转[55]。这样长的世代间隔时间大大增加了养殖的成本和风险, 提高了选择育种的难度。
3.2 人工育种历史较短
中国的海水鱼类养殖虽历史悠久, 但直到20世纪50年代末才开始对海水鱼类养殖品种的人工繁育进行研究[56]; 与其他养殖品种相比, 海水鱼类育种工作起步较晚, 可用于推广养殖的新品种相对较少。2008年中国通过全国水产原种和良种审定委员会审定的79个水产新品种中获准推广的海水鱼类就只有大菱鲆(Scophthatmus maximus)和漠斑牙鲆(Paralichthys lethostigma)[57]。尽管育种技术发展迅速,培育出了大黄鱼、牙鲆、大菱鲆等一些优良品种, 但育种过程中出现的疾病防治、种质衰退等问题仍需长时间、深层次的研究。
3.3 基础研究不够深入
中国是人口大国, 前期的农业科学研究大都致力于解决人民的温饱问题, 对农作物的研究较为深入; 而对水产养殖, 尤其是海水养殖的关注则相对较晚, 所进行的科学研究累积不够。虽然中国目前已取得大黄鱼等部分海水鱼类人工繁育成功, 但海水鱼种类繁多, 仍有大部分重要经济养殖品种的基础研究尚浅, 对其繁殖和发育机制还了解不深, 苗种繁育技术不成熟, 养殖用苗还依赖于捕捞海区的野生苗或从国外进口。沿海地区也有部分养殖户自己培育亲鱼鱼苗, 但这种自发性的行为技术含量低,缺乏科学的管理, 苗种生产不稳定, 无法保证鱼苗质量。
随着现代技术的发展, 鱼类育种的方法越来越多, 单纯的选择育种不足以实现育种的目的, 因为选择育种主要是利用表型差异进行优良性状的选择,也就是说对于遗传力低的性状难以获得理想的选择效果。具体分两种情况: (1)待选择群体没有遗传变异存在; (2)本身存在遗传变异, 但是群体不表现出来,也就是说没有遗传变异效应。所以制定选择计划前要对待选择物种的育种值作科学的估测[58,59], 进一步摸清选择育种的影响因素, 提高选择过程中的可控性。同时, 应在合理情况下尽量综合各种育种的方法, 将选择育种, 细胞工程育种, 基因工程育种等结合起来, 以弥补选择育种中的不足, 实现育种目标。可见, 走农业选种、育种, 提纯复壮之路, 提高选择育种的技术含量, 在选择的过程中综合各种方法使得各种优良性状能最大程度的在种鱼上体现出来,同时去除不良性状以选育出具有优良性状并能稳定遗传给后代的新品种也是未来海水鱼类育种研究的主要方向。
[1] 小远. 2008年我国水产养殖发展形势综述[J]. 渔业致富指南, 2009, 15: 4-5.
[2] 楼允东.鱼类育种学[M]. 北京: 中国农业出版社,1999. 10-11.
[3] Kathleen G N, James M M, Jeffrey J H, et al. Comparison of growth, feed intake, and nutrient efficiency in a selected strain of coho salmon (Oncorhynchus kisutch) and its source stock[J]. Aquaculture, 2008,283(1-4): 134-140.
[4] Smith I R, Sheridan A K, Nell J A. Evaluation of growing methods for use in a Sydney rock oyster Saccostrea commercialis (Iredale and Roughley) selective breeding program[J]. Aquaculture, 1995, 131(3-4):189-195.
[5] William R W, Frederic T B, Gary S B, et al. Growth parameters of wild and selected strains of Atlantic salmon, Salmo salar, on two experimental diets[J].Aquaculture, 2009, 297(1-4): 136-140.
[6] Dean R J, Ian W P, Laurie R P, et al. Selection for faster growth in the freshwater crayfish Cherax destructor[J].Aquaculture, 2005, 247(1-4): 169-176.
[7] Newkirk G F, Haley L E. Selection for growth rate in the eurpean oyster,ostrea edulis:response of second generation groups[J]. Aquaculture, 1983, 33(1-4):149-155.
[8] Crenshaw J W, Heffernan P B, Walker R L. Heritability of growth rate in the southern bay scallop[J]. Journal of Shellfish Research, 1991, 10(1): 55-63.
[9] Bernard C. Enhanced individual selection for selecting fast growing fish: the “PROSPER” method, with application on brown trout (Salmotrutta fario)[J]. Genet Sel Evol, 2004, 36: 643-661.
[10] Kari K, Theo H E M, Bjarne G, et al. Efficient design for doing genetic studies of feed efficiency in Atlantic salmon (Salmo salar)[J]. Aquaculture, 2005, 247(1-4):153-158.
[11] Boujard T, Jourdan M, Kentouri M, et al. Diel feeding activity and the effect of time-restricted self-feeding on growth and feed conversion in European sea bass[J].Aquaculture, 1996, 139(1-2): 117-127.
[12] Albert K I, Arnþór G, Snorri G, et al. Effects of reduced salinities on growth, feed conversion efficiency and blood physiology of juvenile Atlantic halibut (Hippoglossus hippoglossus L.)[J]. Aquaculture, 2008,274(2-4): 254-259.
[13] Tómas Á, Björn B, Agnar S, et al. Effects of temperature and body weight on growth rate and feed conversion ratio in turbot (Scophthalmus maximus)[J].Aquaculture, 2009, 295(3-4): 218-225.
[14] Kari K, Barbara G H, Bjarne G. Family differences in feed efficiency in Atlantic salmon (Salmo salar)[J].Aquaculture, 2004, 241(1-4): 169-177.
[15] Hebb C D, Castell J D, Anderson D M, et al. Growth and feed conversion of juvenile winter flounder (Pleuronectes americanus) in relation to different protein-to-lipid levels in isocaloric diets[J]. Aquaculture,2003, 221(1-4): 439-449.
[16] James C, Thomas G, Marcela S, et al. Breeding for disease resistance of Penaeid shrimps[J]. Aquaculture,2009, 286(1): 1-11.
[17] Britt B, Daniel B, John N, et al. Breeding for QX disease resistance negatively selects one form of the defensive enzyme, phenoloxidase, in Sydney rock oysters[J]. Fish & Shellfish Immunology, 2006, 228(4):627-636.
[18] Richard S T, James W W, Peter D K, et al. Genetic variation of resistance to amoebic gill disease in Atlantic salmon (Salmo salar) assessed in a challenge system[J]. Aquaculture, 2007, 272(S1): 94-99.
[19] Palti Y, Rexroad C E, Welch T, et al. Selective breeding and genetic mapping of disease resistance in rainbow trout[J]. Aquaculture, 2007, 272(S1): 298.
[20] Geert F W, Rene J M S, Henk K P, et al. Immunogenetics of disease resistance in fish: a comparative approach[J]. Developmental and Comparative Immunology, 1996, 20(6): 365-381.
[21] Mark H, Peer B, Niels J O, et al. Selective breeding provides an approach to increase resistance of rainbow trout (Onchorhynchus mykiss) to the diseases, enteric redmouth disease, rainbow trout fry syndrome, and viral haemorrhagic septicaemia[J]. Aquaculture, 2005,250(3-4): 621-636.
[22] Wild V, Simianer H, Gjøen H M, et al. Genetic parameters and genotype × environment interaction for early sexual maturity in Atlantic salmon (Salmo salar)[J].Aquaculture, 1994, 128(1-2): 51-65.
[23] Daniel D H, Robert H D, John W H, et al. Growth and hormonal changes associated with precocious sexual maturation in male chinook salmon (Oncorhynchus tshawytscha (Walbaum))[J]. Journal of Experimental Marine Biology and Ecology, 1997, 208(1-2):239-250.
[24] Benedikte H P. Induced sexual maturation of the europeaneel Anguilla anguilla and fertilisation of the eggs[J]. Aquaculture, 2003, 224(1-4): 323-338.
[25] Arve J B, Trygve S, Aina S, et al. Effect of stocking density, oxygen level, light regime and swimming velocity on the incidence of sexual maturation in adult Atlantic salmon(Salmo salar)[J]. Aquaculture, 1996,143(1): 43-59.
[26] Dimitri A P, Erlend M. Repeat sexual maturation of wolffish (Anarhichas lupus L.) broodstock[J]. Aquaculture, 1996, 139(3-4): 249-263.
[27] Shearer K, Parkins P, Gadberry B, et al. Effects of growth rate/body size and a low lipid diet on the incidence of early sexual maturation in juvenile male spring Chinook salmon (Oncorhynchus tshawytscha)[J].Aquaculture, 2006, 252(2-4): 545-556.
[28] Alam M A, Bhandari R K, Kobayashi Y, et al. Induction of sex change within two full moons during breeding season and spawning in grouper[J]. Aqua-culture, 2006, 255(1-4): 532-535.
[29] Cheryl D Q, Laura R M, Ian M. Strain and maturation effects on female spawning time in diallel crosses of three strains of rainbow trout (Oncorhynchus mykiss)[J].Aquaculture, 2004, 234(1-4): 99-110.
[30] Sakamoto T, Danzmann R G, Okamoto N, et al. Linkage analysis of quantitative trait loci associated with spawning time in rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1999, 173(1-4): 33-43.
[31] Herlin M, Delghandi M, Wesmajervi M, et al. Analysis of the parental contribution to a group of fry from a single day of spawning from a commercial Atlantic cod(Gadus morhua) breeding tank[J]. Aquaculture, 2008,274(2-4): 218-224.
[32] Neira R, Díaz N F, Gall G A E, et al. Genetic improvement in coho salmon (Oncorhynchus kisutch). II:Selection response for early spawning date[J]. Aquaculture, 2006, 257(1-4): 1-8.
[33] Falconer D S, Mackay T F C. Introduction to quantitativgenetics(4th)[M]. 北京: Lonman group limited, 1996,145-152.
[34] Bolivar R B, Newkirk G F. Response to within family selection for body weight in Nile tilapia (Oreochromis niloticus) using a single-trait animal model[J]. Aquaculture, 2002, 204(3-4): 371-381.
[35] Fevolden S E, Røed K H, Fjalestad K T, et al. Selection response of cortisol and lysozyme in rainbow trout and correlation to growth[J]. Aquaculture, 2002, 205(1-2):61-75.
[36] 李云峰. 家系选择在水产动物养殖中的应用[J]. 养殖技术, 2007, 5: 44-46.
[37] Bernard C. Enhanced individual selection for selecting fast growing fish: the “PROSPER” method, with application on brown trout (Salmotrutta fario)[J]. Genet Sel Evol, 2004, 36: 643-661.
[38] Vandeputte M, Dupont-Nivet M, Haffray P, et al. Response to domestication and selection for growth in the European sea bass (Dicentrarchus labrax) in separate and mixed tanks[J]. Aquaculture, 2009, 286(1-2):20-27.
[39] Dupont-Nivet M, Vandeputte M, Haffray P, et al. Effect of different mating designs on inbreeding, genetic variance and response to selection when applying individual selection in fish breeding programs[J]. Aquaculture, 2006, 252(2-4): 161-170.
[40] 吴仲庆. 水产生物遗传育种学(第三版)[M]. 厦门:厦门大学出版社, 2000. 21-82.
[41] Sekino M, Saitoh K, Yamada T, et al. Microsatellite-based pedigree tracing in a Japanese flounder Paralichthys olivaceus hatchery strain: implications for hatchery management related to stock enhancement program[J]. Aquaculture, 2003, 221(1-4): 255-263.
[42] Fishback A G, Danzmann R G, Ferguson M M, et al.Estimates of genetic parameters and genotype by environment interactions for growth traits of rainbow trout(Oncorhynchus mykiss) as inferred using molecular pedigrees[J]. Aquaculture, 2002, 206(3-4): 137-150.
[43] Dupont-Nivet M, Vandeputte M, Vergnet A,et al.Heritabilities and GxE interactions for growth in the European sea bass (Dicentrarchus labrax L.) using a marker-based pedigree[J]. Aquaculture, 2008,275(1-4): 81-87.
[44] 李鸿鸣, 孙效文. 应用大规模家系选育技术促进辽宁海水养殖业的可持续发展[J]. 沈阳农业大学学报(社会科学版), 2002, 4(1): 7-10.
[45] 陈松林, 田永胜, 徐田军, 等. 牙鲆抗病群体和家系的建立及其生长和抗病性能初步测定[J]. 水产学报,2008, 32(5): 665-673.
[46] 李云明, 郑岳夫, 管丹东, 等. 大黄鱼四家系肌肉营养成分差异及品质选育分析[J]. 水产学报, 2009,33(4): 632-638.
[47] Neira R, Díaz N F, Gall G A E, et al. Genetic improvement in coho salmon (Oncorhynchus kisutch). II:Selection response for early spawning date[J]. Aquaculture, 2006, 257(1-4): 1-8.
[48] 朱军. 遗传模型[M]. 北京: 中国农业出版社, 1996.202-212.
[49] 林祥日. 我国养殖鱼类育种技术概况[J]. 淡水渔业,2005, 35(4): 61-64.
[50] Gall G A E, Huang N. Heritability and selection schemes for rainbow trout: Female reproductive performance[J]. Aquaculture, 1988, 73(1-4): 57-66.
[51] Gall G A E, Huang N. Heritability and selection schemes for rainbow trout: body weight[J]. Aquaculture, 1988, 73(1-4): 43-56.
[52] Vandeputte M, Dupont-Nivet M, Chatain B, et al. Setting up a strain-testing design for the seabass, Dicentrarchus labrax: a simulation study[J]. Aquaculture,2001, 202(3-4): 329-342.
[53] Bentsen H B, Olesen I. Designing aquaculture mass selection programs to avoid high inbreeding rates[J].Aquaculture, 2002, 204(3-4): 349-359.
[54] 区又君. 石首鱼类的人工繁育[J]. 海洋与渔业, 2009,4: 18-19.
[55] 何永亮, 区又君. 石斑鱼人工繁育技术研究进展[J].南方水产, 2008, 3(4): 75-79.
[56] 谢启浪, 刘伟成, 单乐州. 海水鱼类人工繁育技术的研究进展[J]. 水产科学, 2009, 28(6): 361-364.
[57] 汤娇雯, 张富, 陈兆波. 中国海水养殖种类遗传育种进展与发展趋势[J]. 南方水产, 2009, 4(5): 77-84.
[58] Sonesson A K, Gjerde B, Meuwissen T H E. Truncation selection for BLUP-EBV and phenotypic values in fish breeding schemes[J]. Aquaculture, 2005, 243(1-4):61-68.
[59] Nielsen H M, Sonesson A K, Yazdi H, et al. Comparison of accuracy of genome-wide and BLUP breeding value estimates in sib based aquaculture breeding schemes[J]. Aquaculture, 2009, 289(3-4): 259-264.
S962
A
1000-3096(2010)10-0101-07
2009-10-14;
2010-06-08
国家科技支撑项目(2006BAD09A14);中央级公益性科研院所基本科研业务费专项资金项目(2008YD02)
吉磊(1985-), 男, 湖南长沙人, 硕士研究生, 从事鱼类育种研究, E-mail: jous911@126.com;区又君, 通信作者,研究员, E-mail:ouyoujun@126.com
(本文编辑: 谭雪静)
