利用光生物反应器培养雨生红球藻的研究初探
2010-10-23蔡明刚黄水英石荣贵陆晓霞
沈 渊, 蔡明刚,2, 黄水英, 石荣贵, 李 哲, 陆晓霞
(1. 厦门大学 海洋与环境学院, 福建 厦门 361005; 2. 福建省海洋化学与应用技术重点实验室, 福建 厦门361005)
利用光生物反应器培养雨生红球藻的研究初探
沈 渊1, 蔡明刚1,2, 黄水英1, 石荣贵1, 李 哲1, 陆晓霞1
(1. 厦门大学 海洋与环境学院, 福建 厦门 361005; 2. 福建省海洋化学与应用技术重点实验室, 福建 厦门361005)
用光生物反应器与光照培养箱两种培养容器培养雨生红球藻(Haematococcus pluvialis), 对雨生红球藻在两种容器培养过程中细胞生长、pH值、溶解氧(DO)及虾青素积累情况进行比较, 同时比较不同接种密度对光生物反应器培养效果的影响。实验表明, 光生物反应器中藻细胞的调整期较短, 接种1 d后即进入指数生长阶段, 在胁迫阶段则仅需4 d即达到虾青素含量的峰值; 将pH值控制在偏碱性条件下(7.75±0.10)有利于藻细胞更好生长; 营养培养阶段DO相对饱和度上升至80%, 而在胁迫阶段则迅速降低, 最低值小于6%; 较高的接种密度(2.3×104个/mL)具有较短的营养培养周期(7 d), 且因接种密度变化对胁迫周期长短无明显影响(均为4 d), 选用较高的接种密度可望降低工业生产成本。
雨生红球藻(Haematococcus pluvialis); 虾青素; 光生物反应器; 培养; 积累
虾青素(astaxanthin)是一种红色的酮式类胡萝卜素, 因其强抗氧化能力而具有抗癌、增强免疫、抗紫外线、着色等功效[1~6]。天然虾青素具有很高的经济价值和开发前景, 且需求量不断增加[2,3]。雨生红球藻(Haematococcus pluvialis)是一种单细胞绿藻, 其虾青素含量约占细胞干质量的 1.5%~3.0%, 被公认为天然虾青素的浓缩体[2]。目前, 如何利用雨生红球藻实现虾青素高产已成为国际研究的热点。然而, 雨生红球藻生长缓慢、易受污染, 且生长适宜温度较低等特点使得雨生红球藻的大规模高密度培养受到限制[7,8]。为进行藻细胞的大体积生产, 国外学者普遍采用封闭式光生物反应器[9~11]。
光生物反应器是一种微藻培养设施或装置, 目前主要分开放式光生物反应器和封闭式光生物反应器两大类。前者结构简单、投资成本低、技术要求较低, 但却存在培养条件难以控制、易受环境污染等缺点, 比较不适合雨生红球藻的大规模培养。后者能较好地控制培养环境, 保护微藻不受周围环境的污染, 实现高细胞密度培养[9,12]。近年来, 封闭式光生物反应器发展迅猛, 国外学者关于利用封闭式光生物反应器培养雨生红球藻的研究报道已有不少, 且主要集中在立柱式、平板式和管状式等3大类型, 其研究重点已从反应器的应用转移至反应器的结构改进以及培养参数(通气速率、质量传输速率研究等)的优化[9,10,13~18]。国内研究则多数集中在少数反应器的应用上[19~21], 总体而言, 国内研究广度和深度不及国外。
光强、搅拌速率、通气速率、pH、溶解氧(DO)、接种密度等均可影响雨生红球藻生长。雨生红球藻对pH的缓冲能力较弱, 培养过程中营养盐和CO2的消耗将逐渐升高藻液 pH[22,23], 从而影响藻细胞生长。培养过程中细胞密度逐渐增加, 细胞容易发生贴壁、沉降, 反应器的搅拌和充气系统可在一定程度上缓解上述现象。充气速率高低也将影响藻生长, 充气可对细胞产生悬浮作用, 并补充溶解氧, 但若体系溶氧过高, 细胞生长则会受抑制[7,24,25]。此外, 选择恰当的接种密度有利于使营养盐利用与细胞生长维持在较佳的动态平衡状态, 进而缩短培养周期并提高最终虾青素含量。
针对上述影响因素, 本文对雨生红球藻培养过程中的细胞生长情况、虾青素、总叶绿素、pH值、DO变化及不同接种密度对细胞培养的影响进行了初步研究。
1 材料和方法
1.1 实验藻种
本实验所用雨生红球藻原始藻种由中国科学院水生生物研究所藻种库提供。
1.2 实验培养条件
1.2.1 培养基
本实验采用BBM培养基。
1.2.2 利用光生物反应器培养雨生红球藻
利用20 L NHL-Ⅲ型光生物反应器(烟台高新区海洋生物工程研究所)培养雨生红球藻原始藻种。反应器由发酵罐、光照系统、灭菌系统、通气系统、控制系统5部分组成, 反应器配有pH值和搅拌速度自动控制系统, 系统面板可显示温度、pH值、搅拌速度和溶解氧。
实验前进行高压蒸汽灭菌处理, 冷却至室温后加BBM 培养基及藻液, 接种密度分别为 2.3×104个/mL和 0.84×104个/mL。营养细胞培养阶段和胁迫阶段的光强分别为1.1~1.3 klx和10~11 klx; 温度控制在23 ℃ ± 1 ℃ ; pH 值控制在 7.75±0.10; 通气速率约为2.0 L/min。每日取2 mL藻液测细胞密度。
1.2.3 利用三角烧瓶培养雨生红球藻
在光照培养箱中用 250 mL 的三角烧瓶接种处于对数生长期的原始藻种, 作为对照组, 设置3个平行。接种密度为2.3×104个/mL, 1.1~1.3 klx光强连续光照, 温度为23.0 ℃。每日取2 mL藻液测细胞密度, 同时用pH 计测定pH值。每日摇藻3次, 防止藻细胞粘壁。
1.3 测定方法
利用血球计数板进行细胞计数。按公式K=(lnNt- lnN0)/t计算生长速率K, 其中Nt,N0分别为t时刻和初始时刻的细胞数。实验结束后, 取全部藻悬浮液,离心去上清液后干燥冷却至衡质量, 计算单位体积藻粉产率。
采用高效液相色谱(HPLC)法分析测定虾青素含量。色谱柱为Hypersil ODS(5 µm, 4.6 mm×250 mm,Germany)色谱柱; 流动相为乙腈、甲醇和水(75:25:10,体积:体积:体积); 流速为1.0 mL/min; 用二极管阵列检测器(DAD)在 250~700 nm 波长范围内扫描, 在476 nm处进行检测; 进样量为10 µL。
利用752型分光光度计于664, 647, 630 nm波长处测定吸光值并求算叶绿素含量(取λ=750 nm的吸光值校正)。
2 结果与讨论
2.1 光生物反应器中雨生红球藻的营养培养
2.1.1 光生物反应器中雨生红球藻营养阶段的细胞生长
图 1为不同培养条件下, 雨生红球藻的细胞生长曲线图。由图 1可知, 光生物反应器(接种密度为2.3×104个/mL)与光照培养箱中三角烧瓶(约 100 mL)的培养效果不同: 前者中藻细胞调整期较短, 接种1 d后即进入指数生长状态, 7 d后, 藻液颜色显著加深(图2a, b), 细胞密度达3.04×105个/mL, 为初始密度(2.3×104个/mL)的 15倍, 是三角烧瓶最大藻密度(2.54×105个/mL)的1.2倍; 平均生长速率为0.37 d-1,明显高于利用太阳光进行室外大体积(10 L)培养的平均生长速率(0.10 d-1)[26]; Kaewpintong等[9]利用对鼓泡塔式光生物反应器培养雨生红球藻(NIES 144),其细胞平均生长速率为0.36 d-1, 与本实验相近。可见, 雨生红球藻在该光生物反应器中能达到快速生长的效果。
2.1.2 pH值对营养阶段细胞生长的影响
实验中, 光生物反应器中的 pH值自动控制在7.75±0.10, 三角烧瓶中pH值不控制。图3为三角烧瓶中雨生红球藻营养阶段的pH变化曲线。由图3可知, 藻液pH值随培养时间逐渐升高, 7 d后超过9.0,达 9.35, 可见雨生红球藻在培养过程中是逐渐产碱的, 该现象与其他研究报道[22,27]相符。已有研究认为,红球藻游动细胞可以耐受比较广的 pH值范围, 在pH为5.0~10.0之间可以存活并旺盛生长, 相对而言,pH值为 7~8时对细胞生长更有利一些[23], 而当 pH超过 10.0时, 将严重抑制雨生红球藻的生长[28]。本实验中光生物反应器中的 pH控制在偏碱性条件下(7.75±0.10), 与对照组相比, 藻细胞的生长得到了明显的改善(图1)。
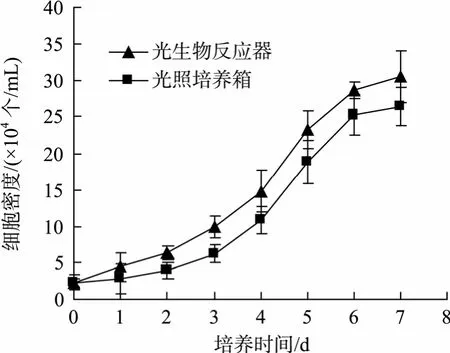
图1 不同培养条件下雨生红球藻的生长曲线Fig. 1 Grow curves of Haematococcus pluvialis cultured under different culture conditions

图2 光生物反应器中藻液颜色的变化Fig. 2 Color change of alga liquor at different times in photobioreactora. 接种后藻液的颜色; b. 培养7 d后藻液的颜色; c. 胁迫4 d后藻液的颜色(右下角为单个细胞的镜检图)a. alga liquor just after inoculation; b. alga liquor after a seven-day culture period; c. alga liquor after four-day stress period (the picture in the bottom right corner is the single cell under microscope)
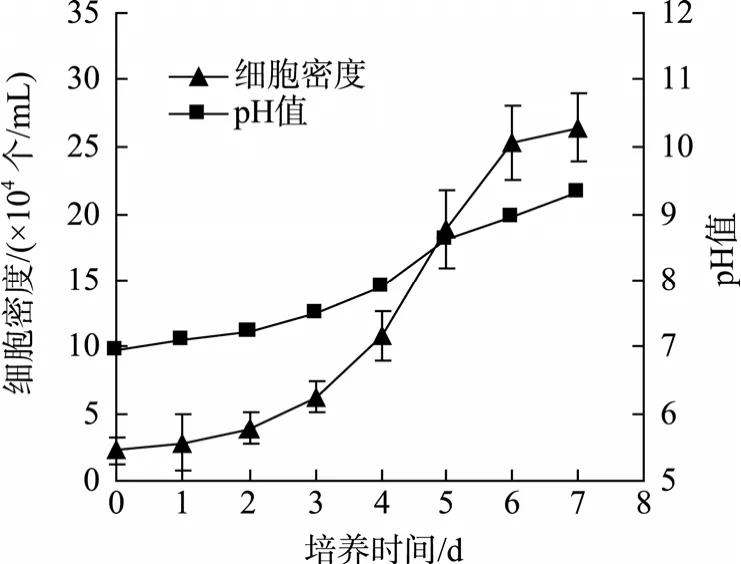
图3 三角烧瓶中pH随培养时间的变化Fig. 3 pH variation with the increase of culture time
2.1.3 光生物反应器中DO相对饱和度变化初探
图4为光生物反应器(接种密度为2.3×104个/mL)中DO相对饱和度的变化曲线。由图4可知, 培养初期 DO相对饱和度迅速上升, 第 5天达峰值(80%),营养阶段末期(第6天)DO开始降低, 胁迫开始后DO急剧下降, 至后期DO相对饱和度均小于6%。培养初期藻细胞大量分裂繁殖, 光合作用大于呼吸作用,DO迅速上升, 胁迫后一方面由于营养盐的消耗导致细胞数量降低, 另一方面藻细胞开始转变为具厚壁的静孢子[29], 光合作用受阻, 导致DO下降。
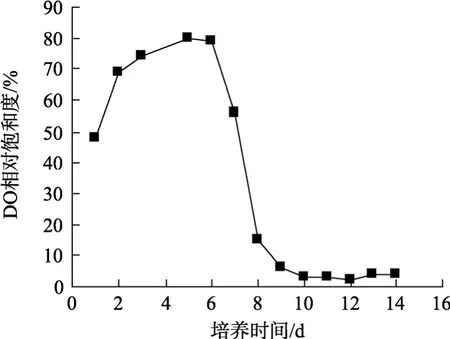
图4 光生物反应器中DO相对饱和度随时间的变化Fig. 4 DO change with the increase of culture time
2.2 光生物反应器中雨生红球藻胁迫阶段各指标的变化
2.2.1 细胞密度变化及色素的积累
胁迫阶段的细胞密度变化和色素积累情况如图5、图6所示。由图5可知, 细胞密度随胁迫时间的延长呈明显下降趋势。胁迫前4 d, 细胞密度急剧下降, 第4天降至7.45 ×104个/mL, 降幅高达75%, 此后细胞密度呈小幅降低, 最终藻细胞密度为4.95×104个/mL。同时, 胁迫期间虾青素质量浓度先增加后减小, 总叶绿素质量浓度则平稳下降(图 6)。胁迫第1天, 虾青素质量浓度便有明显积累, 此后3 d内平稳上升, 当胁迫至第4天时, 虾青素质量浓度即达峰值, 为10.08 mg/L。高光胁迫会导致藻细胞部分死亡, 并减缓剩余存活细胞的分裂速度, 同时使细胞逐渐失去鞭毛, 呈不动状态, 并在细胞内不断积累虾青素[23]。因此胁迫期间细胞密度和叶绿素质量浓度逐渐下降, 而虾青素质量浓度却增加。在胁迫后期, 细胞不断死亡, 故虾青素质量浓度有所降低(图 6)。

图5 光生物反应器中细胞密度随胁迫时间的变化Fig. 5 Changes of cell density with the increase of stress duration
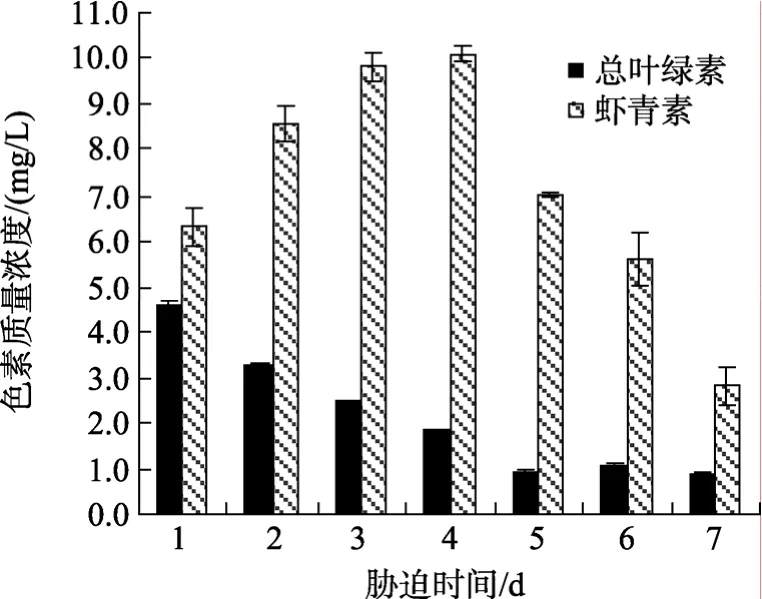
图6 虾青素和总叶绿素质量浓度的比较Fig. 6 Comparison of astaxanthin content and total content of Chlorophyll at stress stage
2.2.2 不同培养容器胁迫效果的比较
不同培养容器胁迫效果如表 1所示。与对照组(三角烧瓶)胁迫比较, 光生物反应器胁迫的综合效果不如对照组, 胁迫后细胞存活率仅为16.4%, 仅为对照组(31.5%)的 50%左右; 藻粉产率为 0.517 g/L,与对照组相当; 实验结束后(胁迫 7 d)测得虾青素产率为3.73 mg/L , 仅为对照组的42.8%。光生物反应器胁迫的综合效果较差, 这可能与光生物反应器的培养体积较大(12.5 L, 为对照组的125倍)有关。培养容器内径大, 藻液遮挡效应明显, 导致容器内部胁迫光强不足, 使得部分细胞胁迫不完全, 虾青素的积累量不高, 镜检也发现藻细胞内并未完全充满虾青素(图2c)。在后续试验中, 可以考虑通过缩短培养容器内径或适当增加光照强度, 以提高光生物反应器的虾青素产量。
然而, 光生物反应器的虾青素产量(胁迫7 d后,虾青素产量为46.63 mg)却显著高于三角烧瓶(仅为0.87 mg)。日产虾青素量前者(6.66 mg/d)为后者(6.21×10-2mg/d)的107倍。另一方面, 光生物反应器的最佳胁迫周期其实仅为4 d(图6), 而三角烧瓶却需14 d。因此, 与三角烧瓶相比, 光生物反应器更有利于雨生红球藻的短周期、大体积培养。
2.3 接种密度对光生物反应器中雨生红球藻培养的影响
2.3.1 接种密度对光生物反应器中藻细胞生长的影响
两种接种密度(2.3×104个/mL 和 0.84×104个/mL)的藻细胞生长曲线如图7所示。与后者(较低接种密度)相比, 前者藻细胞调整期较短(约1 d, 前者需3 d),因为前者在培养初期具有数量上的优势。培养7 d后,高接种密度的细胞已进入稳定期, 而低接种密度的细胞仍处于指数生长阶段, 后者培养至第12天细胞密度才达到峰值(3.50×105个/mL), 但大于前者的最终细胞密度(3.04×105个/mL)。后者营养培养所需时间近似为前者的 2倍, 这表明较高的接种密度可能可以缩短营养培养周期。
图8为不同接种密度藻细胞的每日生长速率。高接种密度的每日生长速率总体呈先上升后下降的趋势。培养第2~5天, 该值较稳定(0.41~0.46 d-1), 细胞密度相应平稳增加。此后2 d内, 细胞每日生长速率急剧下降, 第7天藻密度达峰值, 为3.04×105个/mL。胁迫1 d后(第8天), 生长速率为负值, 即细胞不再生长。低接种密度细胞的每日生长速率出现两次高潮(第4, 7天, 分别为0.48, 0.51 d-1), 均高于高接种密度的最大细胞每日生长速率(第4天, 0.46 d-1), 可见低接种密度条件下, 细胞生长后劲较足, 培养11 d后细胞最终密度可达3.53×105个/mL, 比高接种密度条件下高16%, 但达到细胞密度峰值所需时间比高接种密度条件多4 d。两种接种密度的细胞平均生长速率分别为0.37, 0.34 d-1, 两者差异较小。
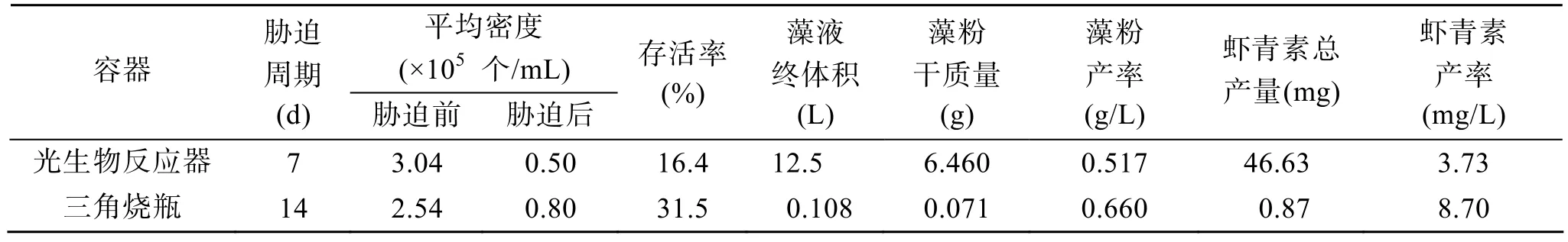
表1 胁迫阶段各指标比较Tab. 1 Comparison of each index for Haematococcus pluvialis under stress in different device
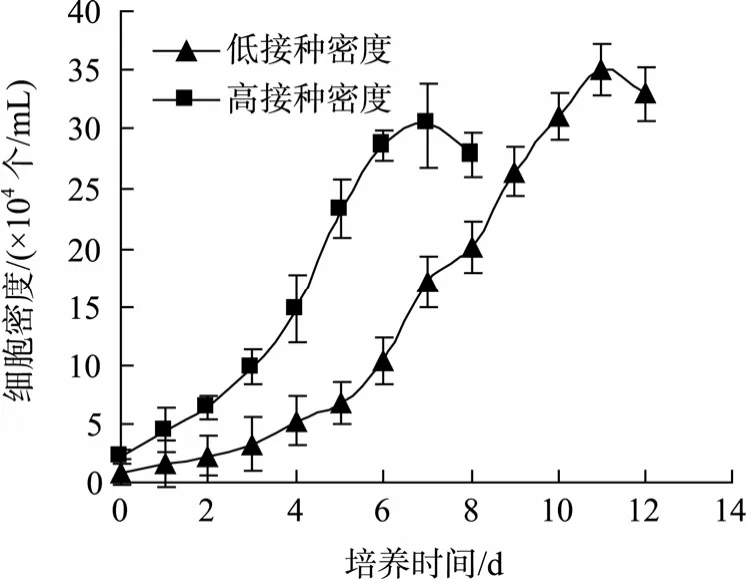
图7 光生物反应器中不同接种密度下的细胞生长曲线图Fig. 7 Growth curves of Haematococcus pluvialis with different cell inoculum densities in photobioreactor
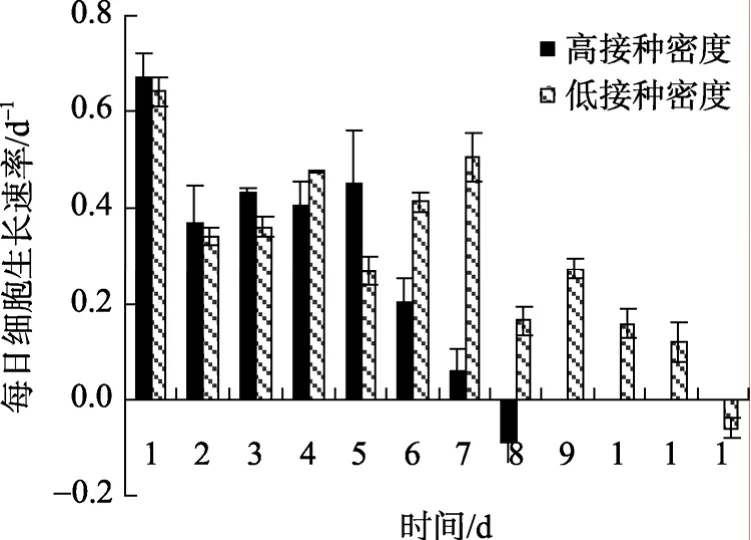
图8 光生物反应器中不同接种密度的每日细胞生长速率Fig. 8 Daily growth rates of Haematococcus pluvialis with different cell inoculum densities in photobioreactor
总而言之, 两种接种密度下细胞生长速率相当,尽管较高的接种密度具有较低的虾青素积累量, 但却有利于缩短培养周期, 工业生产中可望采用较高的接种密度以减少生产成本。
2.3.2 接种密度对光生物反应器中虾青素积累的影响
由图9可知, 胁迫开始后, 虾青素质量浓度均稳步升高, 总叶绿素质量浓度则都相应下降。胁迫过程中, 高低接种密度下虾青素的质量浓度变化趋势相近, 且均仅需 4 d即达虾青素质量浓度峰值(分别为10.08, 18.00 mg/L)。相同胁迫时间下, 低接种密度的虾青素质量浓度均高于高接种密度, 这是因为营养培养阶段中前者具有较高的最终细胞密度(3.50×105个/mL)。

图9 胁迫阶段的虾青素质量浓度变化Fig. 9 The change of astaxanthin contents during stress stage
3 结论
本实验利用 NHL-Ⅲ型光生物反应器大体积培养雨生红球藻原始藻株。结果表明:
1) 反应器中藻细胞的调整期较短, 接种 1 d后即进入指数生长阶段; 而在胁迫阶段, 仅需4 d即达虾青素的峰值; 同时, 虾青素日产量明显高于传统的三角烧瓶。说明光生物反应器能使雨生红球藻细胞获得快速生长, 同时缩短胁迫周期, 可望降低工业生产成本。
2) 藻的生长是个产碱的过程, 但碱性过高则碍于其生长, 偏碱性条件(pH: 7.75±0.10)有利于藻细胞的生长。总体而言, 营养培养阶段DO相对饱和度逐渐上升(可达 80%), 而在胁迫阶段 DO则迅速降低,最低值小于6%, 其曲线变化与生长曲线基本相符。
3) 较低的接种密度(0.84×104个/mL)需较长的营养培养周期(11 d), 而较高的接种密度(2.3×104个/mL)则仅需7天, 此外, 接种密度高低对胁迫周期长短无影响(均为 4 d)。为缩短生产周期, 建议在实际生产应用中考虑选用较高的接种密度。
[1] Kobayashi M, Okada T. Protective role of astaxanthin against uv-B irradiation in the green alga Haematococcus pluvialis[J]. Biotechnology Letters, 2000,22(3): 177-181.
[2] Lorenz R T, Cysewski G R. Commercial potential for Haematococcus microalgae as a natural source of astaxanthin[J]. Trends in Biotechnology, 2000, 18(4):160-167.
[3] 蔡明刚, 王杉霖. 利用雨生红球藻生产虾青素的研究进展[J]. 台湾海峡, 2003, 22(4): 537-544.
[4] Lyons N M, O'Brien N M. Modulatory effects of an algal extract containing astaxanthin on UVA-irradiated cells in culture [J]. Journal of Dermatological Science,2002, 30(1): 73-84.
[5] 蔡明刚, 王杉霖, 李文权, 等. 天然虾青素在水产养殖业中的应用研究进展[J]. 台湾海峡, 2003, 22(3):377-385.
[6] 张英, 蔡明刚, 齐安翔, 等. 维生素 B1, B12 在雨生红球藻不同培养阶段的作用研究[J]. 厦门大学学报(自然科学版), 2004, 43(B08): 142-146.
[7] Harker M, Tsavalos A J, Young A J. Autotrophic growth and carotenoid production of Haematococcus pluvialis in a 30 liter air-lift photobioreactor[J]. Journal of Fermentation and Bioengineering, 1996, 82(2): 113-118.
[8] Choi S-L, Suh I S, Lee C-G. Lumostatic operation of bubble column photobioreactors for Haematococcus pluvialis cultures using a specific light uptake rate as a control parameter[J]. Enzyme and Microbial Technology, 2003, 33(4): 403-409.
[9] Kaewpintong K, Shotipruk A, Powtongsook S, et al.Photoautotrophic high-density cultivation of vegetative cells of Haematococcus pluvialis in airlift bioreactor[J].Bioresource Technology, 2006, 98(2): 288-295.
[10] Ugwu C U, Aoyagi H, Uchiyama H. Photobioreactors for mass cultivation of algae[J]. Bioresource Technology, 2008, 99(10): 4021-4028.
[11] Benson B C, Gutierrez-Wing M T, Rusch K A. Optimization of the lighting system for a Hydraulically Integrated Serial Turbidostat Algal Reactor (HISTAR):Economic implications[J]. Aquacultural Engineering,2009, 40(1): 45-53.
[12] 魏东, 臧晓南. 大规模培养雨生红球藻生产天然虾青素的研究进展和产业化现状[J]. 中国海洋药物, 2001,20(5): 4-8.
[13] Lee H-S, Seo M-W, Kim Z H, et al. Determining the best specific light uptake rates for the lumostatic cultures in bubble column photobioreactors[J]. Enzyme and Microbial Technology, 2006, 39(3): 447-452.
[14] Lopez M C G-M, Sanchez E D R, Lopez J L C, et al.Comparative analysis of the outdoor culture of Haematococcus pluvialis in tubular and bubble column photobioreactors[J]. Journal of Biotechnology, 2006,123(3): 329-342.
[15] Ranjbar R, Inoue R, Shiraishi H, et al. High efficiency production of astaxanthin by autotrophic cultivation of Haematococcus pluvialis in a bubble column photobioreactor[J]. Biochemical Engineering Journal, 2008,106(2): 204-207.
[16] Ranjbar R, Inoue R, Shiraishi H, et al. High efficiency production of astaxanthin by autotrophic cultivation of Haematococcus pluvialis in a bubble column photobioreactor[J]. Biochemical Engineering Journal, 2008,39(3): 575-580.
[17] Suh I S, Joo H-N, Lee C-G. A novel double-layered photobioreactor for simultaneous Haematococcus pluvialis cell growth and astaxanthin accumulation[J].Journal of Biotechnology, 2006, 125(4): 540-546.
[18] Vega-Estrada J, Montes-Horcasitas M C, Dominguez-Bocanegra A R, et al. Haematococcus pluvialis cultivation in split-cylinder internal-loop airlift photobioreactor under aeration conditions avoiding cell damage[J].Applied Microbiology and Biotechnology, 2005,68(1): 31-35.
[19] 刘伟, 刘建国, 林伟, 等. 雨生红球藻规模化培养工艺的构建与应用[J]. 饲料工业, 2006, 27(12): 12-17.
[20] 叶勇, 应巧兰. 用气升式光生物反应器大量培养雨生红球藻 797 株的初步研究[J]. 饲料工业, 2003, 4(5):11-13.
[21] 吴霞, 康瑞娟, 丛威, 等. 转光膜在雨生红球藻养殖上的应用[J]. 过程工程学报, 2006, 6(6): 969-972.
[22] 邱保胜, 刘其芳. 雨生红球藻 (Haematococcus pluvialis—6H) 培养条件研究[J]. 华中师范大学学报(自然科学版), 1999, 33(1): 112-118.
[23] 殷明焱, 刘建国, 张京浦. 雨生红球藻和虾青素研究评述[J]. 海洋湖沼通报, 1998, 2: 53-62.
[24] Hagen C, Grünewald K, Xylander M, et al. Effect of cultivation parameters on growth and pigment biosynthesis in flagellated cells of Haematococcus pluvialis[J].Journal of Applied Phycology, 2001, 13(1): 79-87.
[25] Kobayashi M, Kakizono T, Nagai S. Enhanced carotenoid biosynthesis by oxidative stress in acetate-induced cyst cells of a green unicellular alga, Haematococcus pluvialis[J]. Applied and Environmental Microbiol-ogy, 1993, 59(3): 867-873.
[26] 李晓梦, 齐安翔, 蔡明刚, 等. 雨生红球藻室外大体积培养与虾青素积累初步研究[J]. 厦门大学学报(自然科学版), 2006, 45(B05): 245-249.
[27] 曹平华, 李晓霞, 禹学礼, 等. 雨生红球藻在不同培养基中的生长效果比较[J]. 河南农业科学, 2004, 4:65-68.
[28] Sarada R, Tripathi U, Ravishankar G A. Influence of stress on astaxanthin production in Haematococcus pluvialis grown under different culture conditions[J].Process Biochemistry, 2002, 37(6): 623-627.
[29] 庄惠如, 陈文列. 雨生红球藻 (Haematococcus pluvialis Flotow) 在胁迫条件下积累虾青素过程的超微结构研究[J]. 电子显微学报, 2000, 19(2): 137-142.
Haematococcus pluvialis culture in photobioreactor
SHEN Yuan1, CAI Ming-gang1,2, HUANG Shui-ying1, SHI Rong-gui1, LI Zhe1, LU Xiao-xia1
(1. College of Oceanography and Environmental Science, Xiamen University, Xiamen 361005, China; 2. Key Labotary of Marine Chemisty and Applying Technology of Fujian Province, Xiamen 361005, China)
Mar., 7, 2009
Haematococcus pluvialis; astaxanthin; photobioreactor; culture; accumulation
The green microalga Haematococcus pluvialis was cultured in photobioreactor and light incubator, respectively, to compare the effect on cell growth and astaxanthin accumulation. The effects of pH, dissolved oxygen(DO), and effects of different inoculating densities were also studied. The results indicated that only one day was needed for algae in photobioreactor to enter exponential growth phase and only four days were required to reach the maximum of astaxanthin content during stress stage. The culture period of algae in photobioreactor was shorter than that in light incubator. Slight alkaline condition (pH =7.75 ±0.10) was beneficial to the cell growth. DO increased up to 80% during nutrient culture stage and decreased rapidly during stress stage with a minimum of less than 6%.Since the higher cell inoculum density (2.3×104cell/mL) showed shorter nutrient culture period (7 days) and different cell inoculum densities had no effect on the length of stress period (only 4 days were needed), we suggested that higher cell inoculum density might be adopted for reducing costs and shorten cycles of algae production.
Q935
A
1000-3096(2010)10-0083-07
2009-03-07;
2010-07-06
厦门市科技项目(3052Z20031086); 新加坡厦门大学校友基金会项目(2007); 2007年度国家大学生创新性实验计划项目(2007);第十一届“挑战杯”全国大学生课外学术科技作品竞赛(2009); 厦门大学海洋学系“海洋”本科生科研奖励计划(2008)
沈渊(1986-), 男, 福建诏安人, 厦门大学在读本科生; 蔡明刚(1974-), 通信作者, 男, 福建厦门人, 副教授, 主要从事微藻天然产物化学等领域的开发与研究, E-mail: mgcai@xmu.edu.cn
(本文编辑: 刘珊珊)
