金莲花黄色素的提取及其稳定性研究
2010-10-22曾春萍王欢欢田嘉铭王书华
杨 辉,曾春萍,王欢欢,田嘉铭,王书华,安 芳
(1.河北北方学院基础医学院,河北张家口 075029;2.张家口市药品检验所,河北张家口075029;3.河北北方学院实验中心,河北张家口 075029)
金莲花T rollius chinensis Bge又称金梅草,金芙蓉,金疙瘩等,为毛茛科植物金莲花的干燥花及花蕾,金莲花中含有大量黄色素,其主要成分为叶黄素-环氧化合物 (xantho-phyll-epoxyd,C40H56O3)及金莲花黄质[1](trollixanthin,C40H56O4).关于金莲花的药理研究方面的报道很多[2,3].具有抗病毒和抗菌消炎作用,广泛用于治疗呼吸道和肠道等疾病.但对其色素的提取及稳定性的研究的报道较少.随着人们对 “绿色产品”认识的深入,用于食品及化妆品着色剂的天然植物色素,备受消费者的青睐[4].金莲花黄色素作为无毒无害的天然植物色素[5],在食品添加剂等领域具有广阔的开发利用前景.
本实验研究了金莲花黄色素的提取工艺及其稳定性,并对提取条件进行了优化实验.对其色素的稳定性做了较为深入的研究,为开发利用金莲花这一天然药用植物资源提供科学依据.
1 仪器与试剂
1.1 仪器
756MC型紫外可见分光光度计 (上海精密科学仪器有限公司;KQ-500B型超声波清洗器 (昆山市超声仪器有限公司);MP1100B型电子天平 (天津市泰斯特仪器有限公司);DZ-1BC型真空干燥箱 (天津市泰斯特仪器有限公司).
1.2 试剂
丙酮,石油醚,乙醚,乙醇,NaCl,蔗糖,Na2SO3、H2O2等,均为分析纯.不同pH值缓冲体系(pH=4.0,4.5,5.0,5.7,7.0,7.5,8.0,8.5,9.0),4%NaOH,38%HCl,实验所用水均为三重蒸馏水.
实验所用的金莲花样品采自张家口市坝上地区,由我校中医系马淑兰教授鉴定为短瓣金莲花 (Trollius chinensis Bge).
2 方法与结果
2.1 提取方法及工艺[6]
将金莲花洗涤、干燥后去柄,取适量金莲花样品放入2000 mL的锥形瓶中,加入丙酮 (以浸没样品为宜),振荡,搅拌,浸没58 h,经过滤,离心处理后,将所得滤液进行减压蒸馏,冷冻干燥后得到深黄色色素浸膏,蒸出的丙酮可循环用作提取剂,将以上过程重复两次,直至金莲花花瓣无色.
2.2 色素溶液的制备
称取干燥好的金莲花黄色素0.503 g,置于100 mL容量瓶中加入乙醇使其充分溶解,并用水定容至刻度,即得色素溶液 (含量为5.03 g◦L-1)
2.3 提取溶剂的选择
取250 mL锥形瓶5个,在各瓶中分别放入金莲花样品,再分别加入适量不同的提取剂 (水、丙酮、石油醚、乙醇、乙醚),充分振荡,室温下放置20 min后,观察各种提取液颜色的变化情况.加入丙酮的溶液颜色明显变黄,花瓣颜色较大程度褪去;加入石油醚,乙醇,乙醚的溶液呈浅黄色;而加入水的溶液颜色几乎无变化.对以上各种提取液进行超声波处理20 min,颜色无明显变化.实验结果表明,常温下用丙酮作提取剂,提取效果最佳.
2.4 色素溶液的制备
称取干燥好的金莲花黄色素0.503 g,置于100 mL容量瓶中,加入乙醇使其充分溶解,并用水定容至刻度,即得色素溶液 (含量为5.03 g◦L-1)
2.5 金莲花黄色素的主要物理化学性质
2.5.1 黄色素的外观、颜色及溶解性 黄色素在室温下为金黄色膏状,气芳香、味微苦,微溶于水,易溶于丙酮,属于脂溶性色素.
2.5.2 pH反应 取25 mL比色管9支,分别加入已配置好的黄色素溶液5.0 mL.用pH值分别为4.0,4.5,5.0,5.7,7.0,7.5,8.0,8.5,9.0的缓冲溶液稀释至刻度,摇匀,室温下放置15 min后,观察其颜色的变化.由实验结果可知,金莲花色素在pH=4.0~7.5范围内色泽变鲜艳,且颜色变化相对稳定,而在pH=8.0~9.0范围内色泽变暗.
2.5.3 NaCl和蔗糖介质对黄色素的影响 取 25 mL比色管7支,分别加入已配置好的黄色素溶液5.0 mL,再分别加入0,0.10,0.20,0.30,0.40,0.50,0.60 g NaCl固体,加水定容至25 mL,摇匀,室温下放置1 h后,观察其颜色变化并测其吸光度,用同样的方法加入不同量的蔗糖,观察其颜色变化并测定其吸光度.实验结果见表1.
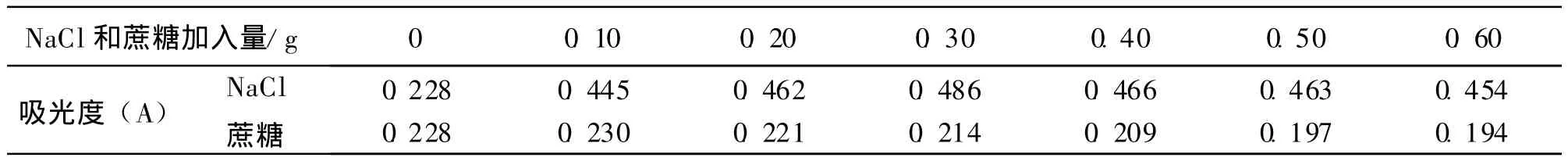
表1 NaCl和蔗糖介质对黄色素的影响
结果表明,在金莲花黄色素溶液中加入NaCl,其吸光度增大且色泽变鲜艳,但随着NaCl浓度的增大,溶液颜色无明显变化;在金莲花黄色素溶液中加入蔗糖,对黄色素影响不大.
2.5.4 还原剂Na2SO3、氧化剂H2O2对黄色素的影响 取25 mL比色管7支,分别加入已配置好的黄色素溶液5.0 mL,然后分别加入0,0.10,0.20,0.30,0.40,0.50,0.60 g Na2SO3固体,用水定容至25 mL,摇匀.室温下放置10min后,测定其吸光度,结果见表2.同样,取25 mL比色管 8支,各加入5.0 g◦L-1的黄色素溶液5.0 mL,然后分别加入3%的H2O2溶液0,0.20,0.60,1.00,1.40,1.80,2.20,2.60 mL,用水稀释至25 mL,摇匀.室温下放置10 min后,测定其吸光度,实验结果见表2.

表2 Na2SO3对黄色素的影响

表3 H2O2对黄色素的影响
结果表明,Na2SO3和H2O2对黄色素均有影响.在黄色素溶液中加入Na2SO3,随着加入量的增加,吸光度增大;在黄色素溶液中加入H2O2,吸光度增大,但随着加入量达一定程度时,吸光度降低.
2.5.5 温度对黄色素的影响 取25 mL比色管1支,管中加入已配置好的黄色素溶液5.0 mL,用水稀释至25 mL将其置于室温、30℃、40℃、60℃、80℃恒温水浴中,每隔0.5 h取样一次,测定其吸光度,实验结果见表4.

表4 温度对黄色素的影响(3h)
由表4可以看出,金莲花黄色素在低于60℃时,吸光度无变化在温度高于60℃时色素溶液已混浊,说明3h内,金莲花黄色素处于稳定状态的最佳温度应该低于60℃.
2.5.6 金属离子对黄色素的影响 取25 mL比色管7支,分别加入已配置好的黄色素溶液5.0 mL,然后在各管中分别加入含有Na+、Mg2+、Ca2+、Fe3+、Zn2+、Ni2+、Cu2+的少量固体,在室温下放置10 min后,观察各管色素溶液颜色变化情况.加入Zn2+、Ni2+、Cu2+(40 μ g◦L-1)的溶液颜色加深,加入Fe3+(80 μ g◦L-1)的溶液颜色变黑,而加入Na+、Mg2+、Ca2+(40 μ g◦L-1)的色素溶液颜色无明显变化.实验结果表明,Fe3+、Zn2+、Ni2+、Cu2+对色素的颜色均有一定的影响.
2.5.7 光照对黄色素的影响 取25 mL比色管3支,编号分别为a、b、c.然后在各管中分别加入已配置好的黄色素溶液5.0 mL,将a管避光放置,b管置于室内直射光处,c管置于室内自然光处,每隔0.5 h取样一次,观察色素溶液随时间的变化情况,测定其吸光度,实验结果见表5.
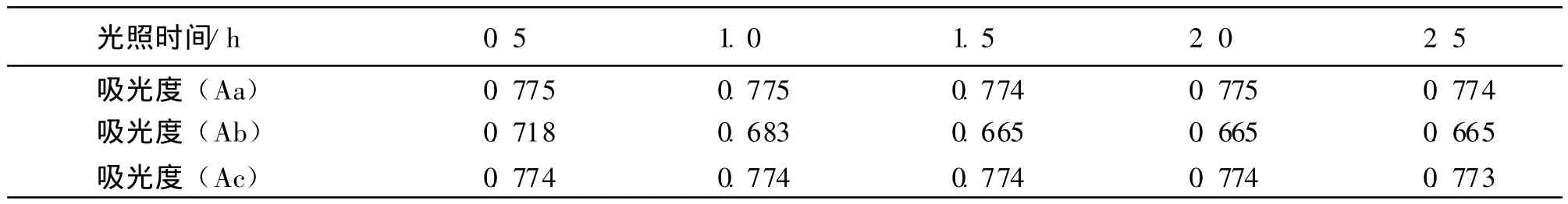
表5 光照对黄色素的影响
结果表明,b管吸光度降低,a管和c管吸光度无明显变化.这说明该色素对直射强光稳定性不好,但该色素在自然光下能否长时间稳定,有待于延长放置时间后进一步观察.
3 小 结
通过不同试剂对金莲花黄色素的提取实验,确定了常温下丙酮为该色素的最佳提取溶剂,并提出了简便易行的提取工艺.
金莲花黄色素在室温下为金黄色膏状,气芳香,味微苦,微溶于水,属脂溶性色素,在pH=4.0~7.5条件下具有较好的稳定性.NaCl、蔗糖对金莲花黄色素的影响不大,Na2SO3、H2O2会破坏色素,对黄色素有一定影响.
光照和温度对黄色素有一定影响.高温会破坏黄色素,在60℃以下色素的热稳定性较好,光照对色素具有降解作用.保存时应避免高温和强光.金属离子Fe3+、Zn2+、Ni2+、Cu2+对金莲花黄色素的色泽均有一定影响.化学环境对金莲花黄色素化学结构的影响还有待于进一步深入研究.
[1] 刘丽娟,王秀坤,徐光,等.金莲花茎叶的抑菌作用研究[J].中医药学报,1992,(03):33-34
[2] 谢宗万.全国中草药汇编(上册)(第二版)[M].北京:人民卫生出版社,1996:549-55
[3] 林晨,沈伟哉.不同溶媒中金莲花提取物的体外抑菌作用的比较 [J].暨南大学学报:医学版,2001,22(06):54-55
[4] 林秋凤,冯顺卿.金莲花抑菌抗病毒活性成分的初步研究 [J].浙江大学学报:理学版,2004,31(04):412-4151
[5] 马同森,刘绣华,赵东保,等.紫荆花红色素的提取及其稳定性研究[J].化学研究,1997,(04):36-40
[6] 乌云,赵慧.金莲花黄色素的提取及其稳定性研究[J].内蒙师范大学学报,2003,32(03):238-241
