高分子人工血管材料大鼠肌肉内的急性期反应
2010-10-16王维慈金毕欧阳晨曦李毅清徐卫林杨红军许海叶
王维慈,金毕,欧阳晨曦,李毅清,徐卫林,杨红军,许海叶
1 华中科技大学 同济医学院附属协和医院 血管外科,武汉 430022 2 武汉科技学院 新型纺织材料绿色加工及其功能化教育部重点实验室,武汉 430073 3 东华大学纺织学院,上海 201620
高分子人工血管材料大鼠肌肉内的急性期反应
王维慈1,金毕1,欧阳晨曦1,李毅清1,徐卫林2,杨红军3,许海叶2
1 华中科技大学 同济医学院附属协和医院 血管外科,武汉 430022 2 武汉科技学院 新型纺织材料绿色加工及其功能化教育部重点实验室,武汉 430073 3 东华大学纺织学院,上海 201620
本实验研究临床常用的几种人造血管生物材料在大鼠体内引起的急性期组织反应,并与自主研发的丝素蛋白改性聚氨酯(Silk fibroin-polyurethane(1:1),SF-PU(1:1))材料相比较,以期找出组织相容性最佳的材料。将涤纶(Dacron)材料、膨化聚四氟乙烯(Expanded polyterafluoroethylene,e-PTFE)材料、聚氨酯(Polyurethane,PU)材料、以及丝素蛋白改性聚氨酯复合材料(SF-PU(1:1))埋植入大鼠肌肉内,通过大鼠急性毒性实验、肌肉植入局部组织反应实验、局部组织切片染色、白细胞及血小板计数,探讨几种材料对大鼠的局部及全身影响,研究比较各组材料的组织相容性。结果表明:涤纶材料的组织相容性较差;其余各组材料的局部组织炎性反应较轻,且白细胞及血小板计数与假手术组无显著性差异。故认为涤纶作为临床上常用的人造血管材料组织相容性最差,所研发的SF-PU(1:1)材料及另两种临床上常用的e-PTFE材料和PU材料的组织相容性较好,尤以SF-PU(1:1)材料的组织相容性最好,结合SF-PU(1:1)优异的物理性能,在小口径人造血管的研制方面有很大的研究前景。
丝素蛋白,聚氨酯,涤纶,膨化聚四氟乙烯,人工血管,组织相容性
Abstract:To find out which biomaterial had the best biocompatibility, we compared the acute phase reaction of common biomaterials preparing for vascular grafts with the material of polyurethane modified by silk fibroin(SF-PU(1:1)).After transplanted the materials of dacron, polyterafluoroethylene(e-PTFE), polyurethane(PU), SF-PU(1:1)in rat muscle for one week,we studied the influence of different biomaterials on the histocompatibility by using rat acute toxicity test, test of local reaction in muscle, tissue section staining, WBC and PLT count.As a result, dacron had the worst histocompatibility.The other biomaterials had slight local inflammatory reaction.The WBC and PLT was nearly the same with the blank except dacron.e-PTFE, pure PU and SF-PU(1:1)had the better histocompatibility than traditional dacron.Especially SF-PU(1:1)had the best histocompatibility.Because of the better physical properties and histocompatibility of SF-PU(1:1), the prospect of preparing small-diameter vascular grafts with SF-PU was cheerful.
Keywords:silk fibroin, polyurethane, dacron, e-PTFE, vascular grafts, histocompatibility
目前国内外在小口径人工血管(内径≤6 mm)的开发应用上存在巨大困难,因为小口径人工血管除了要有良好的生物相容性外,还需要具备良好的顺应性及物理性能[1-2]。高分子生物材料是目前人工血管材料研究领域的热点,临床上已经采用的高分子人工血管生物材料有:涤纶(Dacron)、膨化聚四氟乙烯(Expanded polyterafluoroethylene,e-PTFE)、聚氨酯(Polyurethane,PU)等,它们用于制作大口径人工血管已取得可靠的临床效果,但是以上材料除PU外均无法用于制作小口径人工血管[3]。
在合成高分子材料中,PU具有相对良好的生物相容性和力学性能,因而一直被作为重要的血液接触材料,应用于血管移植物、介入性导管、心室辅助循环系统及人工心脏等方面。而为了进一步提高聚氨酯的生物相容性,研究人员一直通过各种物理、化学方法对聚氨酯进行改性,但是迄今还没有一种改性聚氨酯材料能达到制作小口径血管移植物的要求[4-5]。
丝素蛋白(Silk fibroin,SF)是一种含有人体必需氨基酸的天然蛋白质。除拥有优良的理化性能外,还对人体具有良好的生物相容性及对免疫系统最小的副作用,因此它被广泛应用于生物领域[6-9]。
本实验对非水溶性丝素蛋白粉体[10]改性PU材料的组织相容性进行了评价,对其用于小口径人工血管的制作有着重大意义[11]。
1 材料和方法
1.1 实验材料及其制备
丝素蛋白,购自浙江桐乡市思源纺织有限公司;丝素蛋白粉体,自制,平均粒度为3.58 μm;医用聚氨酯,白色固体颗粒状,购自DOW Chemical公司,型号为Pellethane 2363-80AE;N-N二甲基甲酰胺(DMF),分析纯,由天津博迪化工有限公司生产;实验用大白鼠,购自华中科技大学同济医学院动物培养室。
本实验研究的新型材料为一种复合高分子生物材料,是将SF粉体与PU复合而成的共混膜(SF-PU膜)。设定溶液的含固率为20%,通过控制非水溶性丝素粉体SF和PU的质量比例为1:1,将一定量的DMF和SF及PU搅拌均匀,抽真空除去气泡后制成薄膜,膜的厚度控制在500~700 µm内。经磺酸化及低温等离子技术改性,以提高材料的生物相容性。
前期实验证明,非水溶性丝素粉体与医用聚氨酯共混制膜,可使两者的优良性能结合起来,且可通过改变两者配比满足各种需求的共混膜,当二者等质量配比时,其力学性能适中,且透气性和亲水性也得到明显提高。随着非水溶性丝素粉体含量的增加,共混膜的表面形貌逐渐变疏松,出现微孔,粉体在共混膜中均匀分布,无明显团聚现象,表明两者的相容性好;另外,随SF含量的增加,共混膜的断裂伸长和拉伸模量逐渐下降,但当SF与PU配比达到 9:1时,共混膜的力学性能仍较人体自身动脉好,且共混膜吸水性和透气性明显提高;膜的水接触角逐渐下降,表明其亲水性逐步得到提高[12]。
所制共混膜在扫描电镜下观察,结果见图1。
本实验将SF-PU(1:1)共混膜与涤纶、e-PTFE、pure PU和空白对照组进行比较,对其进行组织相容性方面的分析。
实验分为5组:blank、PU、SF-PU(1:1)、涤纶、e-PTFE。

图1 PU和SF-PU的扫描电镜照片Fig.1 SEM of PU and SF-PU(1:1).(A)SEM of pure PU.(B)SEM of SF-PU(1:1).
1.2 实验方法
1.2.1 大鼠全身急性毒性试验
健康SD大鼠30只,雌雄各半,随机分为5组。手术前每个大鼠称重、记录并标记,然后将 4组材料埋入大鼠右侧腿部肌肉下,并以假手术为阴性对照组,72 h内观察动物的急性期反应及存活率,1周后观察存活率及伤口愈合情况。
1.2.2 材料植入肌肉后血常规及局部反应试验
肌肉埋植试验是应用体内植入技术来表征材料的生物相容性,是一种最常用的评价方法,参照美国材料试验协会ASTM F748-04标准中的有关内容进行[13]。
健康SD大鼠30只,雌雄各半,随机分为5组,应用促新眠麻醉动物,各组实验材料剪成 0.3 cm×0.8 cm薄片,在室温25℃条件下,经三蒸水漂洗3遍后在 2%碱性戊二醛(2%戊二醛加入碳酸氢钠,pH 7.5~8.5)中浸泡消毒4 h,再以三蒸水漂洗3遍晾干备用,各组材料颜色性状无明显改变。剪除大鼠右腿背侧手术区毛发,碘伏消毒手术区域。切开皮肤,分离皮下组织,充分暴露腿部肌肉,顺肌纤维长轴分别将4组试验材料样品植入,每组6只动物,缝合皮肤,创面普通消毒,1周后拆线。
切除植入材料部位大腿肌肉,修剪后于10%福尔马林液体中固定24 h,石蜡包埋标本,在削块机上半薄切片1 μm,将切片浸于苏木精或美兰染色液中数秒,切片于清水中漂洗干净、烘干、树脂封片。光学显微镜下观察炎性反应情况。
于1、4周抽取动物心脏血后将动物无痛处死,将血样做白细胞计数(WBC)及血小板计数(PLT)。
2 结果
2.1 大鼠全身急性毒性试验
连续观察72 h内大鼠的反应情况,5组大鼠中无1例死亡,无不良反应,体重变化不明显,符合标准。而涤纶组中2只大鼠、PU组1只大鼠,出现明显的腹部刺激、腹泻,体重下降,伤口红肿明显;涤纶组1只大鼠,出现术后精神不振、进食少,体重下降。术后1周,30只大鼠均成活。拆线后,涤纶组3只大鼠伤口红肿,其中 1只大鼠伤口有少量脓性分泌物;其余各组大鼠伤口均愈合良好,伤痕不明显。
2.2 材料植入肌肉后血常规及局部反应结果
2.2.1 材料植入肌肉后的局部反应
术后1周各组取3只大鼠切开皮肤,取出材料观察。埋植材料的4组大鼠肌肉内,材料清晰可见,肉眼观察2只涤纶组大鼠有明显组织水肿、肿胀、充血表现,1只涤纶组大鼠有肌肉部分坏死表现。
术后1周对局部肌肉组织进行HE及美兰染色,结果见图2。对照组的局部肌纤维水肿不明显,肌纤维连续性好,组织间质中仅有少量炎性细胞浸润,包埋处组织边缘有少量纤维组织增生。PU组的肌纤维无明显水肿,连续性尚可,组织间隙炎性细胞较少,PU材料在染色后大部分溶解,部分未溶解的材料在镜下观察呈不规则排列蓝染物,周边有少量纤维组织增生。SF-PU(1:1)材料在 HE染色后大部分溶解,显色不明显,其间散有形态不规则的蚕丝粉体,呈筛孔状,组织间隙可见炎性细胞浸润,而材料间可见少量炎性细胞侵入,材料周边纤维组织增生不明显,无伪膜结构。SF-PU(1:1)组美兰染色可见材料呈筛孔状的蓝色,材料与组织间结合得非常紧密,没有伪膜结构,可见少量炎性细胞侵入材料间隙、生长、存活。涤纶纤维呈透明管状物,与周围组织间存在明显的纤维组织增生形成的包膜,周围组织炎性细胞明显增多,但涤纶组织内完全无炎性细胞浸入。e-PTFE组中的肌纤维轻度水肿,e-PTFE材料呈金黄色,结构致密,几乎无细胞渗透和生长,但是在材料的周围聚集了大量坏死的组织细胞,呈伪膜状贴敷在材料周围,多为炎性细胞。
由此可见,空白组炎性反应最轻,PU、e-PTFE、SF-PU(1:1)组有轻微炎性反应,涤纶组炎性反应重;纯PU材料、e-PTFE材料及涤纶材料周围均形成明显的纤维包膜或坏死细胞构成的伪膜,组织间隙的细胞无法穿透入材料内生长、存活,而 SF-PU(1:1)材料因其独特的筛孔状结构,细胞可浸入生长,材料具有一定的穿透性,与周围组织间无明显包膜间隔,组织相容性较好。由术后 1周病理切片镜下观察,可初步分析出组织相容性最好的是 PU及SF-PU(1:1)材料,其次为 e-PTFE材料,组织相容性最差的为涤纶材料。
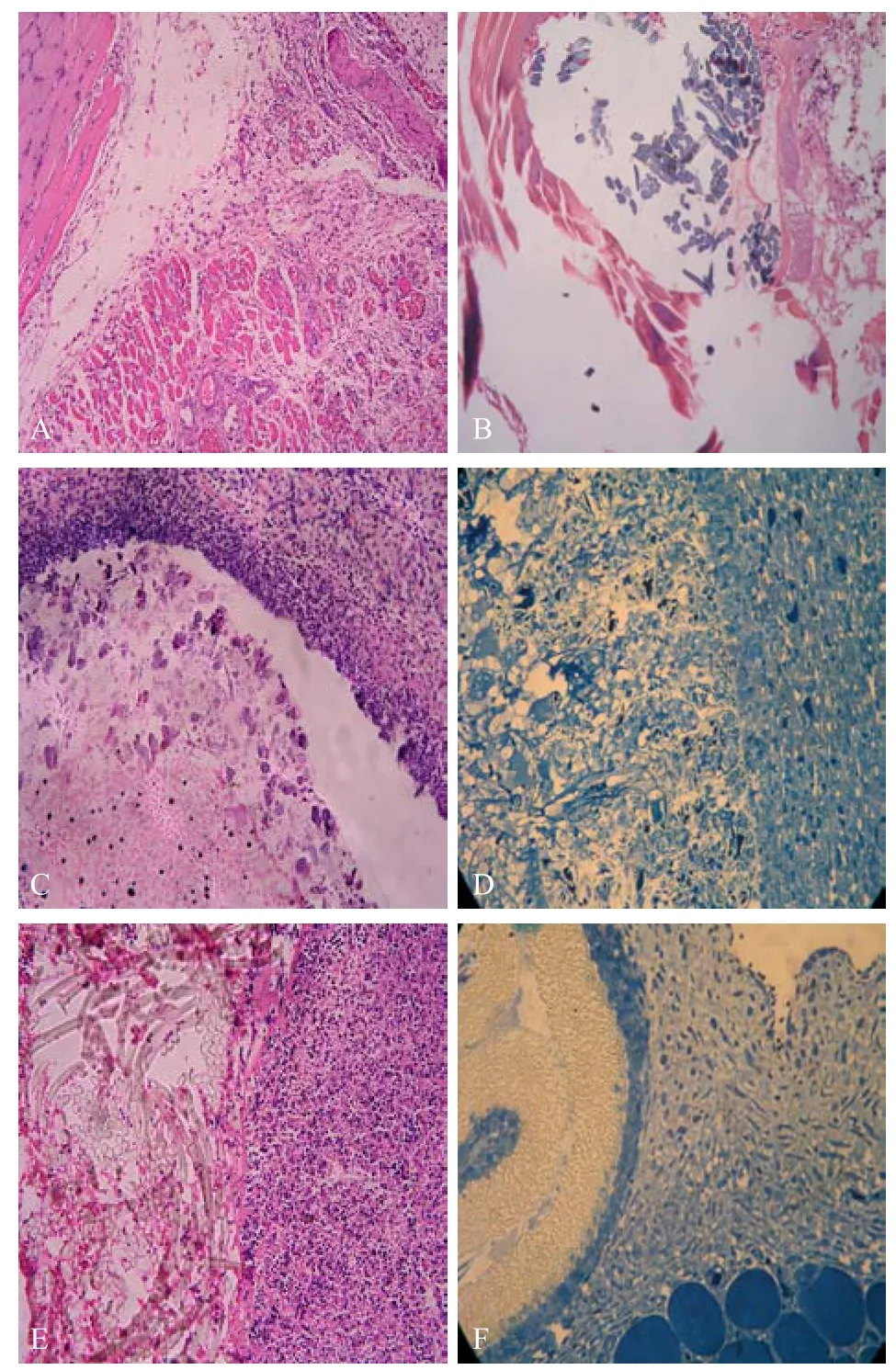
图2 术后1周埋植不同材料的大鼠肌肉组织切片(苏木精-伊红和美兰染色)Fig.2 Tissue slice of different biomaterials heeling in rat muscle one week later(HE and methylene blue staining).(A)Blank(HE, 10×10).(B)PU(HE, 10×40).(C)SF-PU(1:1)(HE,10×10).(D)SF-PU(1:1)(methylene blue, 10×40).(E)Dacron(HE, 10×10).(F)e-PTFE(methylene blue,10×40).
4周后,切开动物右大腿皮肤,取出材料及局部组织,各组材料均无明显组织水肿,空白组、PU、SF-PU(1:1)及 e-PTFE组病理切片显示:组织结构完整,无明显炎症反应,包埋处组织周围少量纤维组织包裹,涤纶组病理切片显示:组织间质仍有程度不等的炎性细胞浸润;包埋处组织周围大量纤维组织包裹。
2.2.2 术后大鼠WBC和PLT变化
本实验血常规检测发现不同材料在不同时期对大鼠红细胞(RBC)数目及血红蛋白(Hb)含量影响不明显,且在术后4周时测得的WBC和PLT结果均与空白组接近。因此重点观察术后1周各组大鼠WBC和PLT变化,并根据所得数据使用Origin 7.5软件绘制出图3、4,反映各材料组大鼠在急性期的白细胞、血小板变化。在术后 1周时测量各组大鼠血常规指标,根据数据作图。
观察手术1周后WBC变化,结果见图3。由图3可见,涤纶材料在术后1周后引起WBC明显升高,其余各材料组均接近对照组。对 WBC数据进行统计学分析,采用t检验。涤纶组与对照组WBC比较:t=−3.060,P<0.05,说明涤纶材料在大鼠肌肉内埋植急性期炎性反应与对照组之间有显著性差异,组织相容性较差;PU、SF-PU(1:1)及 e-PTFE组与对照组 WBC比较结果分别为:t=−0.588、t=−0.163、t=−0.138,P>0.05,各组与对照组之间差异均无统计学意义,说明PU、SF-PU(1:1)、e-PTFE材料在大鼠肌肉内埋植急性期炎性反应与对照组之间无显著性差异,组织相容性较好。
观察手术1周后PLT变化,结果见图4。由图4可见,各组材料PLT结果标准误小,结果较可靠,但各组PLT与对照组比较波动范围较大,说明PLT结果与材料引起的炎性反应无直接关系。对PLT数据进行统计学分析,采用t检验。涤纶、e-PTFE及PU组 PLT与对照组比较结果分别为:t=4.706、t=−6.124、t=6.135,P<0.05,各组与对照组间差异均有统计学意义,说明材料对血小板影响波动大,材料的生物相容性较差;SF-PU(1:1)组PLT结果与对照组比较:t=−0.694,P>0.05,两组之间差异无统计学意义,说明SF-PU(1:1)材料对大鼠体内血小板影响波动较小,材料的生物相容性较好。

图3 埋植不同材料1周后大鼠WBC计数Fig.3 WBC counts of rat with different biomaterials heeling in for one week.

图4 埋植不同材料1周后大鼠PLT计数Fig.4 PLT counts of rat with different biomaterials heeling in for one week.
3 讨论与展望
研究表明对于应用在生物医学工程领域的 PU材料,为了提高其生物相容性及其生物稳定性,必须对其进行改性。目前有表面活性端基(SME)改性、表面接枝聚合、表面形成互穿网络(IPN)、使用表面活性剂(SMA)以及与纳米无机材料共混等多种改性方法[14-16],本实验自主研发的磺酸化及低温等离子技术改性 SF-PU(1:1)在前期研究中已证明其具有良好的顺应性及物理性能[17-18]。现将其与已作为可靠生物材料的涤纶、e-PTFE和纯PU进行对比,检验改性SF-PU(1:1)材料的组织相容性是否能达到移植材料的标准。
较好的组织相容性,是指人工生物材料移植入体内后,在短期内不会出现明显的急性毒性反应;在长期过程中,不会引起严重的炎症反应、排斥反应等。本实验采用了经典的组织相容性评价实验对临床上已采用的涤纶、e-PTFE、PU材料以及自主研制的SF-PU(1:1)材料进行大鼠急性期实验评价。根据医疗器械生物学评价标准,采用大鼠全身急性毒性试验、肌肉植入后局部反应试验、白细胞及血小板计数评价各种材料的组织相容性。
本实验结果显示:1)传统的涤纶材料对大鼠的急性毒性较重,局部肌肉炎性细胞明显增多,材料与组织间相容性较差,全血白细胞明显升高。2)e-PTFE及PU材料对大鼠的急性毒性较轻,局部肌肉炎性反应较轻,但材料周围易形成纤维包膜或坏死物质构成的伪膜,与周围组织间相容性较差,全血白细胞数目较稳定正常。3)SF-PU(1:1)材料对大鼠的急性毒性较轻,材料与周围组织间无明显包膜或伪膜,由于其独特的筛孔状结构使材料通透性好,材料间可有细胞浸润生长,此材料作为移植物可以获得较为稳定正常的白细胞数目,局部及全身炎症轻。4)材料移植后产生的局部及全身炎性反应与全血血小板的数目变化无直接关系,但SF-PU(1:1)材料作为移植物,血小板数目最为稳定正常。故本实验发现,组织相容性最好的是SF-PU(1:1)材料,PU及e-PTFE材料次之,涤纶材料的组织相容性最差。
通过前期在力学性能方面的研究发现SF-PU复合材料可通过控制两者配比以满足不同需求;材料的断裂伸长和拉伸模量虽稍有降低,但仍能满足人体血管的弹性及拉伸性能需求;此外还有效地提高了材料的孔隙率和亲水性,这也为血管内皮细胞爬行及穿透生长提供了良好的条件。本实验进一步发现了 SF-PU(1:1)的复合材料较传统的血管移植材料组织相容性好,局部反应轻微,其机制是由于充分利用了生物蛋白(SF)粉体优良的组织相容性,在大鼠肌肉内有效地减少了排异反应,复合材料的孔隙结构也使细胞得以紧密贴附生长,降低了伪膜形成及材料游离滑脱的几率。而SF-PU(1:1)复合材料移植组全血 WBC无明显升高,主要是因为复合材料组织相容性优良,大鼠无异常的急性毒性及全身炎性反应;SF-PU(1:1)组大鼠PLT无明显波动,而其余实验组PLT极不稳定,原因可能是材料植入后对大鼠产生一定骨髓抑制作用或免疫系统功能亢进,PLT的含量是血液接触材料抗凝性的研究重点,因此本课题也有待进一步研究SF-PU复合材料直接与大鼠血液接触后的全血成分变化。
本实验表明 SF-PU(1:1)材料具有可靠的组织相容性和优异的物理性能,这种丝素蛋白改性的聚氨酯材料制作小口径人工血管仍有进一步研究的必要,现阶段的实验结果为深入研究奠定了基础,提供了新的方向。控制SF与PU的配比也许是该材料研究的关键;为了筛选最好的合成材料,可将其他生物蛋白粉体与丝素蛋白粉体进行对比实验,比较血液相容性及组织相容性;通过体内及体外实验进一步研究材料的制作工艺及预处理方法对其抗凝性能的影响;更可进一步通过粉体耦合技术有针对性地添加不同剂量的药物以满足临床使用的要求。综上所述,丝素蛋白改性聚氨酯材料具有更优良的组织相容性,在小口径人工血管的应用上有着广阔的前景。
REFERENCES
[1]Lyman DJ, Fazzio FJ, Voorhees H, et al.Compliance as a factor affecting the patency of a copolyurethane vascular graft.J Biomed Mater Res, 1978, 12: 337−345.
[2]How TV, Guidoin R, Young SK.Engineering design of vascular prosthesis.Proc Instn Mech Engra, 1992, 206(6):61−69.
[3]Wang WC, Ouyang CX, Zhou F, et al.Polymer materials as small-caliber vascular grafts.J Clin Rehab Tiss Eng Res,2008, 12(1): 125−128.王维慈, 欧阳晨曦, 周飞, 等.高分子材料小口径人造血管的相关研究.中国组织工程研究与临床康复, 2008,12(1): 125−128.
[4]Ishihara K, Tanaka S, Furukawa N, et al.Improved blood compatibility of segmented polyurethanes by polymeric additives having phospholipid polar groups.I.Molecular design of polymeric additives and their functions.J Biomed Mater Res, 1996, 32(3): 391−399.
[5]Bélanger MC, Marois Y, Roy R, et al.Selection of a polyurethane membrane for the manufacture of ventricles for a totally implantable artificial heart: blood compatibility and biocompatibility studies.Artifical Organs, 2000, 24(11):879−888.
[6]Altman GH, Diaz F, Jakuba C, et al.Silk-based biomaterials.Biomaterials, 2003, 24(3): 401−416.
[7]Zuo BQ, Dai LX, Wu ZY.Analysis of structure and properties of biodegradable regenerated silk fibroin fibers.J Mater Sci, 2006, 41(11): 3357−3361.
[8]Roh DH, Kang SY, Kim JY, et a1.Wound healing efect of silk fibroin/alginate—blended sponge in full thickness skin defect of rat.J Mater Sci Mater Med, 2006, 17(6): 547−552.
[9]Zuo BQ, Liu LG, Wu ZY.Effect on properties of regenerated silk fibroin fiber coagulated with aqueous methanol/ethanol.J Appl Polym Sci, 2007, 106(1): 53−59.
[10]Xu WL, Ke GZ, Peng XQ.Studies on the effects of the enzymatic treatment on silk fine powder.J Appl Polym Sci,2006, 101(5): 2967−2971.
[11]Grunkemeier JM, Tsai WB, Horbett TA.Co-adsorbed fibrinogen and von Willebrand factor augment platelet procoagulant activity and spreading.J Biomater Sci Polym Ed, 2001, l2(1): 1−20.
[12]Xu HY, Xu WL, Liu XY.Properties of blend films prepared by water-insoluble silk fibroin powder and medical polyurethane.Textile Res, 2008, 29(11): 16−22.许海叶, 徐卫林, 刘秀英.非水溶性丝素粉体与聚氨酯共混膜的性能研究.纺织学报, 2008, 29(11): 16−22.
[13]American Society for Testing Materials(ASTM).Standard Practice for Selecting Generic Biological Test Methods for Materials and Devices.doi: 10.1520/F0748-06.
[14]Sanchez M, Deffienux A, Bordenave L, et al.Synthesis of hemocompatible materials Part I: surface modification of polyurethanes based on poly(chloroalkylvinylether)s by RGD fragments.Clin Mater, 1994, 15(4): 253−258.
[15]Anderheiden D, Klee D, Hocker H, et al.Surface modification of a biocompatible polymer based on polyurethane for artificial blood vessels.J Mater Sci Mater Med, 1992, 3(1): 1−4.
[16]Goodman SL, Sims PA, Albrecht RM.Three-dimentional extracellular matrix tetured biomaterials.Biomaterials,1996, 17(21): 2087.
[17] Liu HT, Xu WL, Zou HT, et al.Feasibility of wet spinning of silk-inspired polyurethane elastic biofiber.Mat Lett, 2008, 62(12/13): 1949−1952.
[18]Xu WL, Zhou F, Ouyang CX, et al.Mechanical properties of small-diameter polyurethane vascular grafts reinforced by weft-knitted tubular fabric.J Biomed Mater Res A,2009, 9(1): 71−75.derepression of embryonic traits.Planta, 2004, 219(3):489−499.
[25]Ogas J, Kaufmann S, Henderson J, et al.PICKLE is a CHD3 chromatin-remodeling factor that regulates the transition from embryonic to vegetative development in Arabidopsis.Proc Natl Acad Sci USA, 1999, 96(24):13839−13844.
[26]Rider SD Jr, Henderson JT, Jerome RE, et al.Coordinate repression of regulators of embryonic identity by PICKLE during germination in Arabidopsis.Plant J, 2003, 35(1):33−43.
[27]Suzuki M, Wang HH, McCarty DR.Repression of the LEAFY COTYLEDON 1/B3 regulatory network in plant embryo development by VP1/ABSCISIC ACID INSENSITIVE 3-LIKE B3 genes.Plant Physiol, 2007, 143(2): 902−911.
[28]Schmidt ED, Guzzo F, Toonen MA, et al.A leucine-rich repeat containing receptor-like kinase marks somatic plant cells competent to form embryos.Development, 1997,124(10): 2049−2062.
[29]Heck GR, Perry SE, Nichols KW, et al.AGL15, a MADS domain protein expressed in developing embryos.Plant Cell, 1995, 7(8): 1271−1282.
[30]Boutilier K, Offringa R, Sharma VK, et al.Ectopic expression of BABY BOOM triggers a conversion from vegetative to embryonic growth.Plant Cell, 2002, 14(8):1737−1749.
[31]Mantiri FR, Kurdyukov S, Lohar DP, et al.The transcription factor MtSERF1 of the ERF subfamily identified by transcriptional profiling is required for somatic embryogenesis induced by auxin plus cytokinin in Medicago truncatula.Plant Physiol, 2008, 146(4):11622−11636.
Acute phase reaction of different macromolecule vascular grafts heeling in rat muscle
Weici Wang1, Bi Jin1, Chenxi Ouyang1, Yiqing Li1, Weilin Xu2, Hongjun Yang3, and Haiye Xu2
1 Department of Vascular Surgery, Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430022, China 2 Key Laboratory of Green Processing and Functional Textiles of New Textile Materials, Ministry of Education, Wuhan University of Science and Engineering, Wuhan 430073, China 3 College of Textile, Donghua University, Shanghai 201620, China
Received:May 21, 2009;Accepted:October 20, 2009
Supported by:National Basic Research Program of China(973 Program)(No.2009CB526402), National Natural Science Foundation of China(No.50873079).
Corresponding author:Bi Jin.Tel: +86-27-85726202; Fax: +86-27-85726375; E-mail: jinbi@yahoo.cn国家重点基础研究发展计划(973计划)(No.2009CB526402),国家自然科学基金(No.50873079)资助。
