牛瘤胃分离菌株静息细胞培养体系生物转化黄豆苷原
2010-10-16张琪王秀伶王世英郝庆红郭云霞王树香
张琪,王秀伶,王世英,郝庆红,郭云霞,王树香
河北农业大学生命科学学院,保定 071001
牛瘤胃分离菌株静息细胞培养体系生物转化黄豆苷原
张琪,王秀伶,王世英,郝庆红,郭云霞,王树香
河北农业大学生命科学学院,保定 071001
从牛瘤胃胃液中分离了一株在厌氧条件下能利用其生长细胞将大豆异黄酮黄豆苷原高效还原为二氢黄豆苷原的革兰氏阳性细菌菌株 Niu-O16。研究了菌株 Niu-O16静息细胞体系转化黄豆苷原的最佳转化条件,通过单因素试验确定菌株Niu-O16静息细胞转化黄豆苷原的最佳条件是:初始pH 6.0∼8.0,静息细胞浓度32∼64 mg/mL(湿重),加入底物浓度 0.8∼1.2 mmol/L。通过正交试验确定了静息细胞浓度、加入底物浓度及转化时间的最佳组合为:静息细胞浓度32 mg/mL、加入底物浓度0.8 mmol/L、转化时间24 h;最佳转化条件下底物转化率最高为63.9%。该结果为厌氧菌的静息细胞转化及工业应用提供了参考。
牛瘤胃细菌,静息细胞体系,黄豆苷原,二氢黄豆苷原,生物转化
Abstract:In previous study we isolated a gram-positive bacterial strain, designated Niu-O16, from bovine rumen gastric juice.The growing cells of bacterial strain Niu-O16 is capable of biotransforming isoflavone daidzein into dihydrodaidzein efficiently under anaerobic conditions.In this study we investigated the optimal bioconversion conditions for the resting cells of bacterial strain Niu-O16 to convert daidzein into dihydrodaidzein.Single factor test showed that the optimal conditions for the initial pH of phosphate buffer, the concentration of the resting cell and the concentration of the substrate daidzein were 6.0–8.0, 32–64 mg/mL(wet weight)and 0.8–1.2 mmol/L, respectively.Orthogonal experiments were used to determine the optimal combination of the resting cell concentration, substrate concentration and biotransformation time.The results showed that the optimal combination included resting cell concentration 32 mg/mL, substrate concentration 0.8 mmol/L and the biotransformation time 24 h.Furthermore,the biotransformation kinetics under optimal conditions were studied, under which conditions the highest bioconversion rate was 63.9% in the resting cell system.The results might provide information for resting cell biotransforming of anaerobes as well as its industrial application.
Keywords:bovine rumen bacteria, resting cell system, daidzein, dihydrodaidzein, biotransformation
大豆异黄酮(Soy isoflavones)是大豆在其生长 过程中形成的一类次级代谢产物,主要分布于大豆种子的子叶和胚轴中,其中含量最高的是黄豆苷(Daidzin)和染料木苷(Genistin)。体内及体外试验均表明,摄入动物体内的大豆异黄酮糖苷,在肠道和肝组织中的β-葡萄糖苷酶作用下首先脱去糖苷,被水解为黄豆苷原(Daidzein)和染料木黄酮(Genistein)。其后,在胃肠道微生物菌群作用下又进一步被降解为各种不同的大豆异黄酮代谢产物。其中黄豆苷原可被降解为二氢黄豆苷原(Dihydrodaidzein,简称DHD)、四氢黄豆苷原(Tetrahydrodaidzein,简称 THD)、去氧甲基安哥拉紫檀素(O-Desmethylangolensin,简称O-Dma)和雌马酚(Equol)[1-4]等不同代谢产物。
大量流行病学研究证实,大豆异黄酮能明显降低与性激素相关疾病如乳腺癌、前列腺癌、子宫内膜癌等的发病率,预防骨质疏松,有效缓解妇女更年期综合症;此外,大豆异黄酮还能降低心脑血管发病率及抗氧化、抗溶血、抗真菌等生物学功能[5-8]。最新研究表明大豆异黄酮代谢产物具有比大豆异黄酮更高更广的生物学活性。近年来有关大豆异黄酮黄豆苷原代谢产物 DHD生物学功能方面也屡见报道。DHD是保持血管活性的成分之一,由于它与17β-雌二醇的结构相似,从而能有效地抑制血管收缩,防止内皮组织受伤害。Chin-Dusting等[9]、Jiang等[10]分别分析比较了黄豆苷原及化学合成的黄豆苷原不同代谢产物对心脑血管的保护作用,研究结果均表明 DHD对心脑血管的保护作用远高于其亲本化合物黄豆苷原。此外,DHD是合成高活性植物雌激素雌马酚的第一个重要中间产物,目前能将DHD特定转化为雌马酚的稀有微生物菌株 Eggerthella Julong732(AY310748)已经从人体肠道微生物菌群中分离出来[11],因此,DHD可作为雌马酚微生物生物合成的直接原料。
尽管目前 DHD可利用化学氢转移法进行人工合成,但生成的大量副产物给分离纯化造成困难,加之所用化学催化剂昂贵,目前化学合成的DHD国际市场售价较高(美国 Lclabs)。微生物生物转化是利用微生物产生的酶作用于化合物的特定部位,使它转化为结构相似但具有更大经济价值的新化合物的过程。微生物转化既可用生长细胞完成又可用静息细胞来完成。静息细胞是有生命、很少或不分裂、保持许多酶活性的细胞。静息细胞转化法是在菌体培养到一定时间,用过滤或离心方法进行分离,收集菌体,将其悬浮于缓冲液或不完全培养基中,加入底物,在一定温度、pH和振荡条件下进行的转化方法[12-14]。与生长细胞相比,静息细胞转化法可自由改变转化体系中底物和菌体比例,提高转化效率。另外,静息细胞转化中产物的杂质较少。本实验室曾报道过一株筛自牛瘤胃胃液的能将黄豆苷原还原为 DHD 的革兰氏阳性细菌菌株 Niu-O16(AY263505),并对其生长细胞转化条件进行了优化研究[15]。
本研究首次尝试利用牛瘤胃分离菌株 Niu-O16静息细胞体系生物转化黄豆苷原,对静息细胞转化条件进行了优化,建立了适于牛瘤胃分离菌株Niu-O16转化的最佳静息细胞转化体系。
1 材料与方法
1.1 实验材料与设备
菌种:Niu-O16(本实验室保藏)。培养基:种子培养基和发酵培养基均为脑心浸液(Brain heart infusion,简称BHI),购自美国Bacto公司。底物:黄豆苷原(Daidzein),购自美国Indofine公司。菌株培养装置:Concept 400 厌氧工作站(英国Ruskinn),工作站内气体种类及配比为 5% CO2、10% H2和85% N2。检测装置:HPLC 系统(美国 Waters),1525型双泵,2487UV检测器,Kromasil C18分析色谱柱(5 μm,250 mm × 4.6 mm)。离心装置:Eppendorf 5417R低温高速离心机(德国)。蒸干装置:DK-VC010-IR 真空离心浓缩仪(韩国DAIKI)。
1.2 实验方法
1.2.1 种子培养
从−80℃冰箱中取出菌株冻存液,接种于1 mL的种子培养基中,接种量为10%;37℃恒温培养箱培养24 h后再次转接于1 mL种子培养基中,接种量为5%,37℃恒温培养18~20 h,此时得到的菌悬液可作为种子。
1.2.2 菌体制备、收集及培养
参考 Masata M等[16]的方法加以改良。将种子以5%的接种量接种于盛有1 mL BHI的发酵培养基中,37℃下厌氧培养 18~20 h;在厌氧工作站内将培养液转入已灭菌的1.5 mL离心管中,将离心管取出厌氧工作站,4℃、12 000 r/min离心5 min,放回厌氧工作站后弃上清,收集菌体;加入0.05 moL/L pH 6.0的磷酸缓冲液,定容至1 mL,制成不同浓度的静息细胞转化体系,在厌氧工作站内静置培养。
1.2.3 静息细胞培养基成分的筛选
向静息细胞转化体系中添加适量的糖、氮源、氨基酸、尿素及金属离子等成分可控制菌体维持最低限度生命活动及合成某一特定代谢产物[17-19]。日本学者 Nagasawa等发现在荧光假单胞菌静息细胞培养过程中加入烟酸可诱导羟基化酶的形成[20]。因此参考相关信息,向静息细胞培养体系中添加葡萄糖、L-半胱氨酸、尿素和硫酸铵等成分,研究其对牛瘤胃菌株Niu-O16转化的影响。
1.2.4 不同静息细胞浓度转化体系的建立
将牛瘤胃分离菌株按 5%接种量接种于 1 mL BHI培养基中,在厌氧工作站内培养18~20 h后离心收集菌体于1.5 mL离心管中,管内菌体平均湿重为8 mg,向该离心管内加入1 mL pH 6.0的磷酸缓冲液定为 1倍(1×)静息细胞浓度转化体系;将两个离心管内菌体合并后加入1.0 mL pH 6.0的磷酸缓冲液定为 2倍(2×)静息细胞浓度转化体系,依次建立 4 倍(4×)、6倍(6×)和 8 倍(8×)的不同静息细胞浓度转化体系。
1.2.5 高效液相检测
转化结束后,取 100 µL静息细胞培养液置于1.5 mL离心管中,加入1.0 mL乙酸乙酯萃取1次,取上清在真空离心浓缩仪中蒸干,100%甲醇溶解后用HPLC检测底物黄豆苷原被转化情况。检测波长为270 nm,流动相为乙腈和水,具体方法见Wang等[15]的报道。
2 结果与讨论
2.1 静息细胞培养体系的建立
菌株Niu-O16在BHI培养基中培养后离心获静息细胞,按8 mg/mL的比例悬浮于灭菌试管中,悬浮液为0.05 mol/L、pH 7.0的磷酸缓冲液,加入底物黄豆苷原 0.1 mmol/L,在厌氧工作站内 37℃反应48 h后萃取,并用HPLC检测底物被转化情况。向磷酸缓冲液(8#)中添加了一定浓度的葡萄糖、L-半胱氨酸、尿素和硫酸铵,组成不同静息细胞培养体系,其转化效率见表1。

表1 静息细胞培养基组分及相关转化结果Table 1 Nutrient components of resting cell system and the correlated biotransformation
从表 1可以看出,向磷酸缓冲液静息细胞培养体系中添加不同营养成分对菌体的生长和转化均无明显影响,因此本研究直接选用磷酸缓冲液作为菌株Niu-O16的静息细胞培养体系,并在此基础上对其他转化条件进行优化研究。
2.2 静息细胞转化条件的优化
2.2.1 不同初始pH值对静息细胞转化的影响
不同 pH值会改变酶活性及与之相关基团的解离状态[21]。处于培养基中的生长细胞在一定范围内可通过其生长过程中的代谢物改变培养基初始pH;静息细胞则不同,在静息细胞培养体系中,菌体本身不能进行正常的生长繁殖,只能被动处于初始培养体系的pH下,如果初始pH对转化酶系活性影响较大,则该初始pH将直接影响静息细胞对底物的转化效率。本研究表明,静息细胞培养体系的初始pH过高或过低均不利于 Niu-O16菌体对底物黄豆苷原的转化。初始pH为4.5时,转化体系中只生成极少量DHD;当初始pH接近中性,即初始pH在6.0~8.0之间时底物转化率最高(图1),这与菌体 Niu-O16生长细胞在不同初始pH下的BHI培养基中转化结果基本一致[15]。

图1 不同静息细胞转化体系初始 pH对牛瘤胃菌株Niu-O16转化黄豆苷原的影响Fig.1 Effect of initial pH conditions on the biotransformation of daidzein in bovine rumen bacterial strain Niu-O16.Resting cell concentration: 1×, substrate concentration: 0.1 mmol/L.
2.2.2 静息细胞浓度对转化的影响
菌体对底物的转化率不仅与单个菌体细胞产生的转化酶活力大小有关,而且与单位体积内的菌体数量即菌体浓度有关。与生长细胞相比,静息细胞转化法可通过提高转化体系内的细胞浓度来提高底物转化率。参考菌株Niu-O16生长细胞能转化黄豆苷原的最大底物浓度[15],向不同浓度静息细胞培养体系中分别加入 1.2 mmol/L的底物黄豆苷原,在37℃厌氧工作站内培养 48 h,乙酸乙酯萃取后加入100%甲醇进行HPLC检测。
研究结果表明,转化体系中的不同静息细胞浓度对底物转化有明显影响。当细胞浓度为1×∼4×时,生成的DHD的量随细胞浓度增加而增加。然而,当静息细胞浓度超过4×时,静息细胞转化体系中底物黄豆苷原的剩余量及产物 DHD的生成量均有所降低,尤其当静息细胞浓度增大到8×时,这种剩余底物量及生成的 DHD的量其下降趋势变得更为明显(图2)。造成这一现象的原因可能是:牛瘤胃分离菌株产生的能将黄豆苷原还原为 DHD的还原酶是胞内酶,加入到转化体系中的底物首先要进入到细菌静息细胞体内,在菌体内被转化为DHD后再被排出到静息细胞培养液中,转化反应处于一种动态平衡中。当转化体系中的静息细胞浓度过高时,残存在静息细胞中的底物及产物不能被乙酸乙酯有效萃取出来,致使未被转化的底物黄豆苷原浓度与生成的产物 DHD之和明显小于反应前加入的底物黄豆苷原总量。
2.2.3 不同底物浓度对转化的影响
分别向4×静息细胞浓度的转化体系中加入0.4、0.8、1.2、1.6 mmol/L的底物黄豆苷原,在厌氧工作站内37℃反应48 h,乙酸乙酯萃取后用HPLC检测。研究结果表明,当底物浓度为0.4~0.8 mmol/L时,生成的产物 DHD随加入底物黄豆苷原的增加而增加,底物浓度为0.8 mmol/L时,菌体对底物的转化率达到最高(57.9%);当底物浓度增至1.2 mmol/L时,生成的DHD量与加入0.8 mmol/L底物时相比并无明显增加;当加入的底物浓度增大到1.6 mmol/L时,大部分底物不能被转化(图3)。
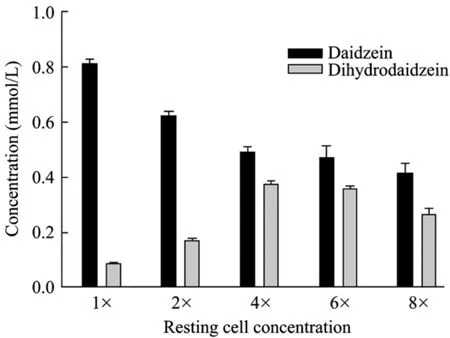
图2 不同静息细胞浓度对牛瘤胃菌株Niu-O16转化黄豆苷原的影响Fig.2 Effect of different resting cell concentrations on the biotransformation of daidzein in bovine rumen bacterial strain Niu-O16.

图3 不同底物浓度对牛瘤胃菌株Niu-O16静息细胞转化黄豆苷原的影响Fig.3 Effect of different substrate concentrations on the biotransformation of daidzein in bovine rumen bacterial strain Niu-O16.
由于静息细胞转化法可自由改变体系中底物和菌体的浓度,其转化效率理论上会明显高于生长细胞转化法。Yi等[22]利用新月弯孢霉研究甾体转化时也发现,静息细胞转化法显著高于发酵液中生长细胞转化法。然而,本研究中 4倍细胞浓度的静息细胞转化能力却与 1倍生长细胞相近。以往利用菌株Niu-O16的生长细胞进行转化时,加入到BHI培养基中的底物黄豆苷原浓度在0.4~0.8 mmol/L时,菌株 Niu-O16的生长细胞几乎能全部将其转化为DHD;当底物浓度在 1.0~1.2 mmol/L时,Niu-O16生长细胞亦能将加入的大部分底物黄豆苷原转化为DHD[15]。本研究中,当加入到Niu-O16静息细胞转化体系中的底物浓度超过0.8 mmol/L时,底物的转化率呈明显下降趋势,这可能是由于底物黄豆苷原对菌体具有毒性。以往测定菌株 Niu-O16生长曲线时曾发现,接菌后同时加入0.1 mmol/L的底物黄豆苷原导致延滞期延长6 h[15]。本研究中,0.8 mmol/L的底物黄豆苷原对Niu-O16静息细胞造成的毒性可能远高其生长细胞,进而影响Niu-O16静息细胞大量分泌能将底物黄豆苷原转化为二氢黄豆苷原的还原酶及辅酶,最终导致静息细胞还原能力的下降。此外,牛瘤胃分离菌株Niu-O16为严格厌氧菌株,无论静息细胞还是生长细胞都必须在厌氧条件下才能有效完成转化过程。然而,静息细胞离心过程需在厌氧工作站外完成。尽管离心时间仅有5 min,但这很可能足以使大部分Niu-O16菌株发生“氧中毒”,当离心完成放回厌氧工作站后,仍不能正常发挥其转化能力,最终导致4倍用量细胞的实际转化能力反而不如 1倍的生长体系的细胞,这很可能是导致转化效率下降的主要原因。
2.2.4 正交试验设计
影响转化的因素很多,其中包括静息细胞转化体系初始pH、静息细胞浓度、加入底物浓度以及转化时间等。通过单因素试验已确定菌株Niu-O16高效转化的最适pH值范围,且在此最适pH范围内,静息细胞浓度及底物浓度等因素对转化的影响不受pH变化的干扰。因此,选定静息细胞浓度(mg/mL)、底物浓度(mmol/L)和不同转化时间(h)3种因素,采用正交表L9(33)[23]对这3个因素进行综合考察,研究其对生物合成DHD的影响。正交试验设计如表2所示,正交试验结果见表3。
由表3可以看出,静息细胞浓度对DHD生物合成影响最大,其次为转化时间和所加底物浓度,主次因素为RB>RA>RC,理论最优组合为A2B2C2。然而,组合A2B2C2并未出现在表3的9个试验组中,9个试验组中的最佳组合为A2B2C3(5#)。组合A2B2C2与组合A2B2C3的唯一差异在于所加底物浓度的不同。在组合A2B2C2中,加入底物黄豆苷原浓度为0.8 mmol/L,而组合A2B2C3中加入底物浓度为1.2 mmol/L。根据单因素试验结果,底物浓度为 1.2 mmol/L时,产物DHD的生成量与底物浓度为 0.8 mmol/L时基本相同,但从转化率上看,加入底物浓度为0.8 mmol/L时的转化率明显更高些。因此,通过本研究选定的最佳组合为A2B2C2。正交试验结果的方差分析见表4。

表2 正交试验因素水平表Table 2 Factors and levels of orthogonal experiment

表3 静息细胞初始转化条件正交试验结果Table 3 Results of orthogonal experiment on the resting cell incipient transformation condition
F0.05(2,10)= 4.10,F0.01(2,10)= 7.56,而 FA、FB均大于7.56,表明A、B两因素对生物合成DHD均有显著性影响。其中静息细胞浓度对底物黄豆苷原转化的影响最为显著,在实验过程应严格控制静息细胞浓度。
2.3 最佳转化条件下的转化动态
将牛瘤胃菌株 Niu-O16制备成静息细胞,按32 mg/mL悬浮于灭菌试管中,加入0.8 mmol/L底物,每隔0 h、6 h、12 h、24 h、48 h和72 h分别取样检测,测定底物黄豆苷原在菌株Niu-O16静息细胞转化体系中的转化动态,实验结果见图4。

表4 正交试验结果的方差分析Table 4 Variance analysis of orthogonal experiment
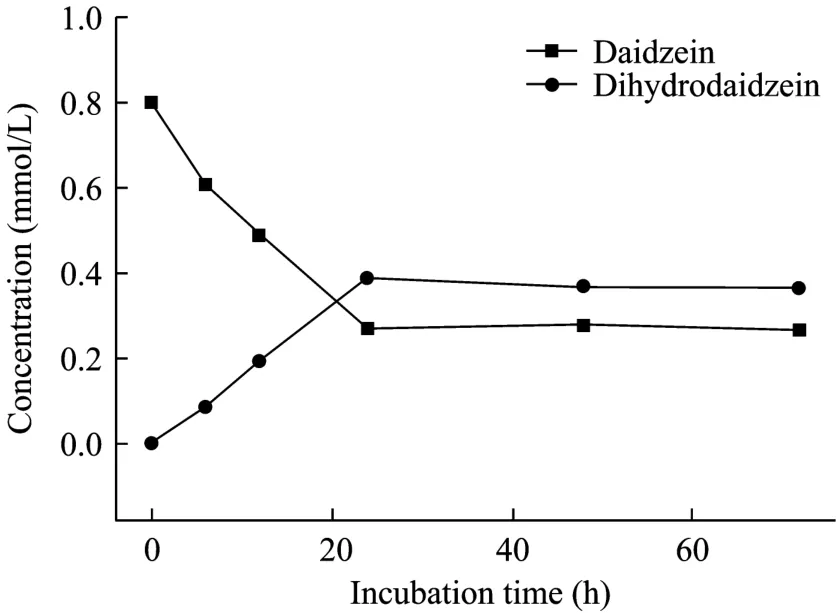
图4 牛瘤胃菌Niu-O16最佳静息细胞转化体系对底物黄豆苷原的转化动态Fig.4 Biotransformation kinetics of daidzein by bovine rumen bacterial strain Niu-O16 under optical resting cell biotransformation system.
由图4可以看出,将底物加入到Niu-O16静息细胞转化体系后的24 h内,底物黄豆苷原浓度呈直线下降,产物DHD呈直线上升;此后,随转化时间延长,底物和产浓度变化不明显。通过比较牛瘤胃菌株Niu-O16的生长细胞[15]和静息细胞转化动态,发现在静息细胞转化体系中,底物黄豆苷原被转化为DHD的速度有所加快。
3 结论
菌株Niu-O16(AY263505)是从牛瘤胃胃液分离的能将黄豆苷原高效还原为二氢黄豆苷原的严格厌氧细菌菌株,本实验首次对菌株Niu-O16静息细胞转化黄豆苷原进行了研究。结果表明,在厌氧和适宜的pH条件下,细菌菌株Niu-O16静息细胞能将底物黄豆苷原有效还原为二氢黄豆苷原;分别通过单因素和正交试验研究了初始pH条件、静息细胞浓度、加入底物浓度及转化时间对转化效率的影响。正交试验结果表明,转化体系中的静息细胞浓度和转化时间对转化效率均有显著影响,其中静息细胞浓度对菌株Niu-O16转化黄豆苷原的影响尤为显著。在厌氧条件下,32 mg/mL静息细胞浓度制备成静息细胞转化体系,加入0.8 mmol/L底物黄豆苷原,反应24 h时转化效率最高,摩尔转化率为63.9%。
REFERENCES
[1]Joannou GE, Kelly GE, Reeder AY, et al.A urinary profile study of dietary phytoestrogens.The identification and mode of metabolism of new isoflavonoids.J Steroid Biochem, 1995, 54(3/4): 167–184.
[2]Rowland I, Wiseman H, Sanders T, et al.Metabolism of oestrogens and phytoes-trogens: role of the gut microflora.Biochem Soc T, 1999, 27(2): 304–308.
[3]Bowey E, Adlercreutz H, Rowland I.Metabolism of isoflavones and lignans by the gut microflora: a study in germ-free and human flora associated rats.Food Chem Toxicol, 2003, 41(5): 631–636.
[4]Anastasia M, Thomas C, Michael G, et al.Conversion of daidzein and genistein by an anaerobic bacterium newly isolated from the mouse intestine.Appl Environ Microbiol,2008, 74(15): 4847–4852.
[5]Harborne JB, Williams CA.Advances in flavonoid research since 1992.Phytochemistry, 2000, 55(6): 481–504.
[6]Magee PJ, Rowland IR.Phyto-oestrogens, their mechanism of action: current evidence for a role in breast and prostate cancer.Brit J Nutr, 2004, 91(4): 513–531.
[7]Beck V, Rohr U, Jungbauer A.Phytoestrogens derived from red clover: an alternative to estrogen replacement therapy? J Steroid Biochem, 2005, 94(5): 499–518.
[8]Nestel P, Fujii A, Zhang L.An isoflavone metabolite reduces arterial stiffness and blood pressure in overweight men and postmenopausal women.Atherosclerosis, 2007,192(1): 184–189.
[9]Chin-Dusting JP, Fisher LJ, Lewis TV, et al.The vascular activity of some isoflavone metabolites: implications for a cardioprotective role.Brit J Pharmacol, 2001, 133(4):595–605.
[10]Jiang F, Jones GT, Husband AJ, et al.Cardiovascular protective effects of synthetic isoflavones derivatives in apolipoprotein E-deficient mice.J Vasc Res, 2003, 40(3):276–284.
[11]Wang XL, Hur HG, Kim SI et al.Enantioselective synthesis of S-equol from dihydrodaidzein by a newly isolated anaerobic human intestinal bacterium.Appl Environ Microbiol, 2005, 71(1): 214–219.
[12]Gang J, Du LX, Lu FP, et al.Biosynthesis of tissue-type plasminogen activator using resting cell culture.J East Chin Univ Sci Technol(Nat Sci Edi), 2005, 31(4):245–249.冮洁, 杜连祥, 路福平.用静息细胞培养法研究影响组织型纤溶酶原激活剂生物合成的因素.华东理工大学学报(自然科学版), 2005, 31(4): 245–249.
[13]Li QS, Li XB, Li YR, et al.Biosynthesis of L-glutamate oxidase by Streptomyces sp.N15 in resting cell culture system.J East Chin Univ Sci Technol(Nat Sci Edi), 1994,20(4): 168–172.李青山, 李晓波, 李友荣, 用静息细胞培养法研究 L-谷氨酸氧化酶的生物合成.华东理工大学学报(自然科学版), 1994, 20(4): 168–172.
[14]Chu ZY.Biosynthetic Pharmaceutical.Beijing: Chemistry Industrial Press, 2000: 259–262.褚志义.生物合成药物学.北京: 化学工业出版社,2000: 259–262.
[15]Wang XL, Shin KH, Hur HG, et al.Enhanced biosynthesis of dihydrodaidzein and dihydrogenistein by a newly isolated bovine rumen anaerobic bacterium.J Biotechnol,2005, 115(3): 261–269.
[16]Masata M, Akinori M, Hiroyuki T, et al.Relationship between the antifreeze activities and the chemical structures of oligo-and poly(glutamic acids).J Agric Food Chem, 1998, 46(3): 891–895
[17]Chen J, Chu J, Zhang SL, et al.Screening resting cell system for study gentamicin biosynthesis.J East Chin Univ Sci Technol(Nat Sci Edi), 2001, 27(2): 135–137.谌颉, 储炬, 张嗣良, 等.静息培养基的筛选及在此体系中庆大霉素的合成.华东理工大学学报(自然科学版),2001, 27(2): 135–137.
[18]Zhang DL, Chu J, Li YR.Influence of nitrogen sources on synthesis and secretion of gentamicin.J East Chin Univ Sci Technol(Nat Sci Edi), 2002, 28(2): 360–363.张达力, 储炬, 李友荣.氮源对庆大霉素合成与分泌的影响.华东理工大学学报(自然科学版), 2002, 28(2):360–363.
[19]Yang L, Xian M, Zhong J.Study on synthesis of sisomicin using resting cell system.Chin J Antibiot, 2001, 26(1):29–31.杨丽, 咸漠, 钟杰.静息细胞法研究影响西索米星生物合成因素.中国抗生素杂志, 2001, 26(1): 29–31.
[20]Nagasawa T, Hurh B, Yamane T.Production of 6-hydroxynicotinic acid by resting cells Pseudomonas fluorescens.Biosci Biotech Bioch, 1994, 58(4): 665–668.
[21]Chen SG, Zhou RQ.Enzymology.Shanghai: Fudan University Press, 2001: 192–194.陈时根, 周润琦.酶学.上海: 复旦大学出版社, 2001:192–194.
[22]Yi KX, Yang YL, Yang SK, et al.Bioconversion of compound S into hydrocortisone using a novel process of twi-run sequence bioconversion by the mycelium of Curvularia lunata AS 3.4381.Chin J Biopr Eng, 2005,3(4): 40–44.易奎星, 杨亚力, 杨顺楷, 等.静息细胞连续两批次生物催化生产氢化可的松.生物加工过程, 2005, 3(4):40–44.
[23]Chen YB.Mathematical Statistic Elementary Introduction.Beijing: Agriculture Press, 1983: 223–225.陈永秉.数理统计浅说.北京: 农业出版社, 1983:223–225.
Biotransformation of daidzein by resting cell system of bacterial strain isolated from bovine rumen gastric juice
Qi Zhang, Xiuling Wang., Shiying Wang, Qinghong Hao, Yunxia Guo, and Shuxiang Wang
College of Life Sciences, Agricultural University of Hebei, Baoding 071001, China
Received:May 16, 2009;Accepted:November 19, 2009
Supported by:National Natural Science Foundation of China(Nos.30570035, 30770047).
Corresponding author:Xiuling Wang.Tel: +86-312-7528257; E-mail: wxling2000@hebau.edu.cn国家自然科学基金(Nos.30570035, 30770047)资助。
