淡紫拟青霉胞外多糖的分离、纯化及结构分析
2010-10-16史怀刘波苏明星黄素芳朱育菁
史怀,刘波,苏明星,黄素芳,朱育菁
福建省农业科学院农业生物资源研究所,福州 350003
淡紫拟青霉胞外多糖的分离、纯化及结构分析
史怀,刘波,苏明星,黄素芳,朱育菁
福建省农业科学院农业生物资源研究所,福州 350003
淡紫拟青霉 NH-PL-03菌株的胞外多糖粗提物对枯萎病病原菌-尖孢镰刀菌具有较好的抑制效果,文中对淡紫拟青霉胞外多糖进行了分离纯化和结构分析,以期为其构效关系研究奠定基础。采用乙醇沉淀法从淡紫拟青霉发酵液中提取粗多糖,经Sevage法脱蛋白后,过Superdex-G75凝胶层析柱分离得到胞外多糖EP-1。紫外分光法和Sephacryl S-200 HR凝胶层析柱检测EP-1为均一多糖,Sephacryl S-200柱层析测得EP-1的分子量为35.2 kDa,完全酸水解后纸层析检测EP-1的单糖组成中仅有葡萄糖,红外光谱、高碘酸氧化和Smith降解结果表明EP-1的化学结构是以β-(1,3)糖苷键连接而成的无分枝的葡聚糖。刚果红络合试验表明EP-1在稀的碱溶液中以3股螺旋构象存在。
淡紫拟青霉,多糖,结构分析
Abstract:The paper dealt with the characterization of polysaccharide ofPaecilomyces lilacinusNH-PL-03 strain.First, we extracted and purified exude polysaccharide from the fungal fermentation broth by ethanol depositing method.Second, the proteins were removed by the Sevage method from the crude polysaccharide.Third, the purified polysaccharide(EP-1)was obtained after Superdex G-75 column separation.The results of UV-spectrometer and Sephacryl S-200 HR chromatography experiments showed that the EP-1 was a homogeneous pure polysaccharide with molecular weight of 35.2 kDa.Tested by paper chromatography analysis using the complete hydrolysis by sulfuric acid, we found that the EP-1 comprise single component as glucose.The chemical structure of EP-1 was confirmed as a kind of linear glucan linked by β-(1,3)linkage.The Congo red reaction performed that EP-1 probable presented a triple-helica conformation in the dilute alkali.
Keywords:Paecilomyces lilacinus, polysaccharide, structure analysis
淡紫拟青霉Paecilomyces lilacinus(Thom)Samson属半知菌纲、丝孢菌目、拟青霉属,对多种植物寄生线虫有着良好的防治效果[1-2]、此外还具有杀虫[3]、促长[4]、拮抗[5]、降解[6]等多种功效,是极具推广潜力的生防菌与功能菌。淡紫拟青霉生物学功能与其次生代谢物关系密切,该菌不但能分泌对线虫具有毒杀作用的毒素[7-8],还能分泌吲哚乙酸[9]、以及蛋白酶、淀粉酶、右旋糖苷酶等多种酶类[10-11]。国内对淡紫拟青霉在植物线虫及病害生物防治上的应用进行了广泛的研究,但对菌株所产生的各种次生代谢物的提取及结构、功能等深层次的研究十分薄弱。本实验室在先期工作中筛选到一株对尖孢镰刀菌具有拮抗抑制作用的淡紫拟青霉菌株NH-PL-03,对抗性物质进行了初步的筛选分析,结果表明其抑菌活性来自胞外多糖的粗提物[12]。
微生物多糖是目前生物发酵工程和生物医药领域的一大研究热点。多糖及其复合物在生命活动中有着极其重要的生物功能,但由于多糖本身的结构复杂,很多特殊的生物活性都与其复杂的空间结构关系密切,因此对多糖结构的研究是开发利用糖类物质的关键。
拟青霉属真菌的多糖国内外研究报道多为医药方面,如古尼拟青霉、细脚拟青霉、蝉拟青霉等菌株的胞外多糖经研究发现具有免疫调节、抗肿瘤、抗肝炎病毒等作用[13-15]。但关于淡紫拟青霉多糖的活性及结构方面的研究尚未见他人报道。
本研究对淡紫拟青霉胞外多糖进行提取、分离、纯化后,对多糖的结构进行了分析,为明确其构效关系、推断抑菌机理,以及更好地开发利用淡紫拟青霉提供参考。
1 材料与方法
1.1 材料
菌种:淡紫拟青霉NH-PL-03菌株。
发酵培养基:查氏培养基(蔗糖 3%,NaNO30.3%,KCl 0.05%,MgSO40.05%,KH2PO40.1%,FeSO40.001%,pH自然)。
试剂:葡萄糖、果糖、木糖、甘露糖、鼠李糖、半乳糖标准品均为Sigma公司产品;层析分离材料Superdex G-75、Sephacryl S-200 HR葡聚糖凝胶均为Pharmacia公司产品;其余试剂为国产分析纯。
1.2 方法
1.2.1 多糖的提取、分离和纯化
淡紫拟青霉摇床培养7 d后收集发酵液,8 000 r/min离心15 min,取上清液。上清液加入3倍体积的95%乙醇沉淀过夜,2 000 r/min离心30 min,收集沉淀,依次用丙酮、乙醚洗涤数次后真空干燥即得多糖粗提物。Sevage法[16]初步纯化去除多糖粗提物中的游离蛋白质后,多糖溶液经逆向流水透析48 h,蒸馏水透析24 h后,用3倍体积95%乙醇醇析过夜,2 000 r/min离心30 min,收集沉淀,无水乙醇冲洗后真空干燥即得淡紫拟青霉胞外粗多糖。
Superdex G-75装柱(1.6 cm×60 cm),粗多糖上柱后以0.2 mol/L的NaCl溶液洗脱,流速24 mL/h,酚-硫酸法检测,收集最大洗脱峰,真空冷冻干燥得到多糖EP-1。
1.2.2 多糖的纯度鉴定
紫外光谱分析:多糖样品EP-1溶解于0.2 mol/L的NaOH,200~400 nm区间扫描。
Sephacryl S-200 HR 凝胶层析:Sephacryl S-200 HR装柱(1.6 cm×80 cm),样品上柱后以0.2 mol/L的NaCl溶液洗脱,流速12 mL/h,酚-硫酸法检测多糖峰位。
1.2.3 分子量测定[17]
采用Sephacryl S-200 HR层析柱(操作条件同上),取T系列标准葡聚糖上柱,0.2 mol/L NaCl溶液洗脱,各测得洗脱体积Ve,用蓝色葡聚糖 T2000上柱,测得洗脱体积V0。根据Ve/V0与分子量对数值logM·W测出标准曲线。相同浓度待测样品于同样条件上柱,据其Ve/V0值从标准曲线上查算分子量。
1.2.4 多糖组成分析
EP-1多糖样品 5 mg加入 2 mol/L的 H2SO44.5 mL,封管,100℃水解8 h,BaCO3中和,离心取上清,浓缩后作纸层析。以葡萄糖、果糖、木糖、甘露糖、鼠李糖、半乳糖标准品为对照,乙酸乙酯∶吡啶∶水=10∶4∶3(V/V)为展开剂,苯胺-邻苯二甲酸显色,105℃烘干5 min。
1.2.5 多糖结构分析
红外光谱分析:取EP-1多糖样品2 mg与100 mg干燥的 KBr粉末于玛瑙研钵中在红外灯下磨匀压片,红外光谱仪于4 000~400 cm−1波长区间内扫描。
高碘酸氧化及甲酸测定[18]:EP-1样品50 mg,加去离子水 50 mL,磁力充分搅拌,使样品的悬浮液均匀,然后加入30 mmol/L NaIO425 mL,定容,使NaIO4终浓度为15 mmol/L。置于暗处反应,每隔6 h取样0.1 mL,蒸馏水稀释250倍,分光光度计测定223 nm处光密度值至恒定为止(蒸馏水为空白对照)。加一滴乙二醇终止反应,高碘酸氧化完成。查标准曲线,计算高碘酸消耗量。取上述氧化液2 mL,加1滴溴甲酚紫为指示剂,0.0045225 mol/L NaOH滴定,计算甲酸生成量。
Smith降解:乙二醇处理后的溶液透析48 h,浓缩,加入NaBH4还原过夜。50% HAc中和至pH为6~7,去离子水透析48 h。透析液加入等体积的1 mol/L H2SO4,25℃水解40 h,BaCO3中和至pH为6,过滤后透析48 h,袋外部分干燥做G.C.分析,袋内加乙醇醇析,离心,上清及沉淀部分干燥后分别进行G.C.分析。G.C.条件:HP-5石英毛细管柱(30 m×0.32 mm×0.25 μm),恒流模式,流量 1 mL/min,程序升温为:以3℃/min从120℃升到210℃,保持4 min。进样口采用不分流模式,温度250℃,载气为氮气,检测器温度300℃,氮、氢、空气的流速分别为25、30、400 mL/min。进样量 1 μL。
刚果红结合实验分析[18]:5 mg EP-1样品,加入2 mL去离子水和2 mL 80 μmol/L刚果红试剂,逐渐加4 mol/L NaOH溶液,使溶液的碱浓度由0 mol/L增加到0.4 mol/L,然后紫外扫描,测不同碱浓度条件下的最大光吸收波长。
1.2.6 淡紫拟青霉胞外多糖的生物活性测定
EP-1溶解于0.2 mol/L的NaOH中,将PDA固体培养基熔化后冷却至 45℃左右,迅速添加 EP-1溶液并充分摇匀,使其终浓度为200 μg/mL,制成平板。以同浓度的NaOH溶液为空白对照。用 6 mm打孔器从长势旺盛的尖孢镰刀菌平板上打取菌饼,并各移 1块菌饼倒扣在上述制备的平板中央,25℃恒温培养箱培养6 d后取出观察。
2 结果与分析
2.1 多糖的提取、分离和纯化
发酵上清液中加入95%乙醇后立即产生暗绿色胶团状凝集物,其内裹有大量气泡浮于溶液表面,离心后得到果冻状凝胶,该提取物具有多糖常见的各种颜色反应,可溶于碱液,在水及酸中基本不溶。多糖粗提物经Sevage法脱蛋白并透析后,冷冻干燥获得的粗多糖样品呈淡黄色粉末状。粗多糖经Superdex G-75柱层析纯化得到3个洗脱峰(图1),收集最大洗脱峰并真空冷冻干燥后得到白色粉末,将其命名为EP-1。
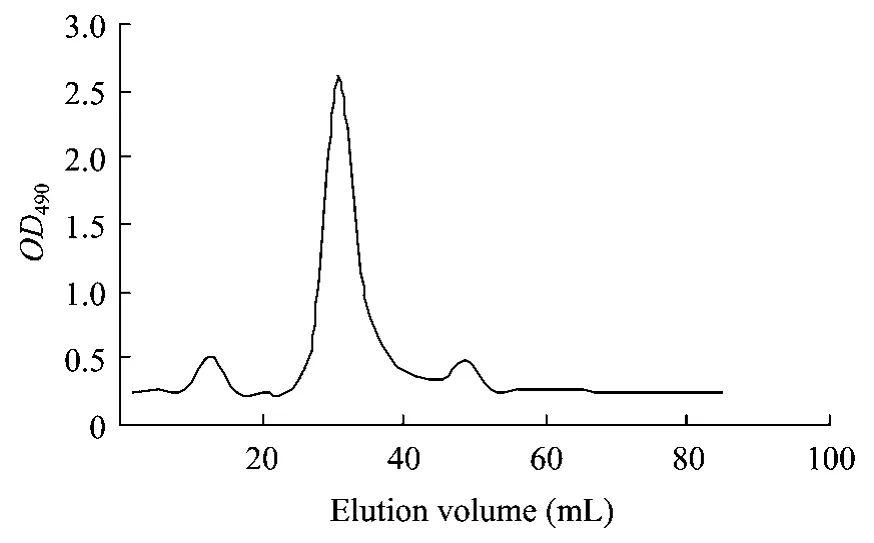
图1 胞外粗多糖的Superdex G-75柱层析图谱Fig.1 Chromatogram of the crude exo-polysacharides on Superdex G-75 column.
在实验过程中观察到淡紫拟青霉胞外多糖EP-1具有凝胶多糖的特性,即多糖的碱溶液在透析和中和过程中均可以形成微凝胶状,不易搅碎、破坏凝胶状态,用碱溶解后可以恢复溶液状;加热过程中可以形成有一定强度的凝胶,高温(>80℃)下形成的凝胶不可逆。
2.2 多糖的纯度鉴定
2.2.1 紫外光谱分析
EP-1溶液在紫外光波长260 nm与280 nm处均无显著吸收峰,说明样品中已基本去除蛋白质、多肽、核酸类等杂质(图2)。

图2 EP-1样品的紫外光谱Fig.2 Ultraviolet spectrum of EP-1.
2.2.2 凝胶柱层析
多糖的洗脱收集液用酚-硫酸法检测,得到的洗脱峰为单一的对称峰(图3),表明EP-1多糖为均一多糖。

图3 EP-1样品的Sephacryl S-200 HR柱层析图谱Fig.3 Chromatogram of the sample EP-1 on Sephacryl S-200 HR column.
2.3 多糖的分子量测定
根据T-系列标准葡聚糖制作的标准曲线,求得EP-1的分子量为35.2 kDa(图4)。
2.4 多糖的组成分析
EP-1水解产物与标准单糖的纸层析图谱表明:EP-1的单糖组成只有葡萄糖,不含果糖、木糖、甘露糖、鼠李糖、半乳糖,可见EP-1是一种单一单糖组分的葡聚糖(图5)。

图4 多糖分子量标准曲线Fig.4 Standard curve of polysaccharides molecular weight.

图5 EP-1水解产物的纸层析图谱Fig.5 Paper chromatogram of EP-1.A: rhamnose; B:galactose; C: mannose; D: glucose; E: hydrolysate of EP-1.
2.5 多糖的结构分析
2.5.1 红外光谱结果分析
EP-1样品的红外光谱显示了多糖的特征吸收峰:3 405 cm−1处的吸收峰为-OH的伸缩振动吸收峰,2 925 cm−1处的吸收峰为C-H的伸缩振动吸收峰,1 373 cm−1处的吸收峰为C-H变角振动吸收峰,1 315 cm−1处的吸收峰为 C-H弯曲振动吸收峰,1 162 cm−1处的吸收峰为环上的C-O吸收峰,889 cm−1处的特征吸收峰表示了 EP-1为 β-D-吡喃型糖苷键构型;800~870 cm−1处无吸收峰,表明无甘露聚糖存在;1 650~1 550 cm−1之间无吸收峰,表明无明显氨基存在(图6)。
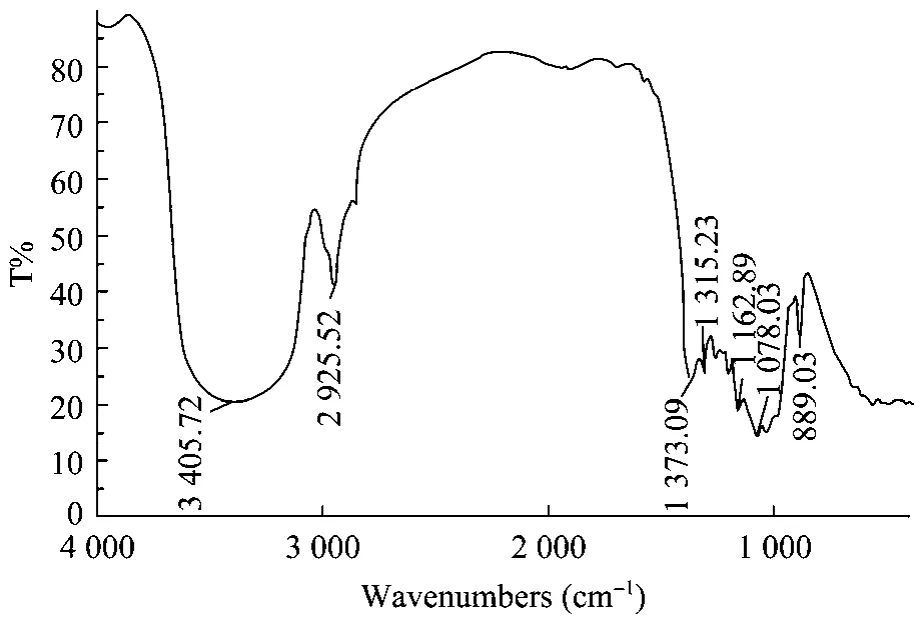
图6 EP-1的红外光谱Fig.6 Infrared spectrum of EP-1.
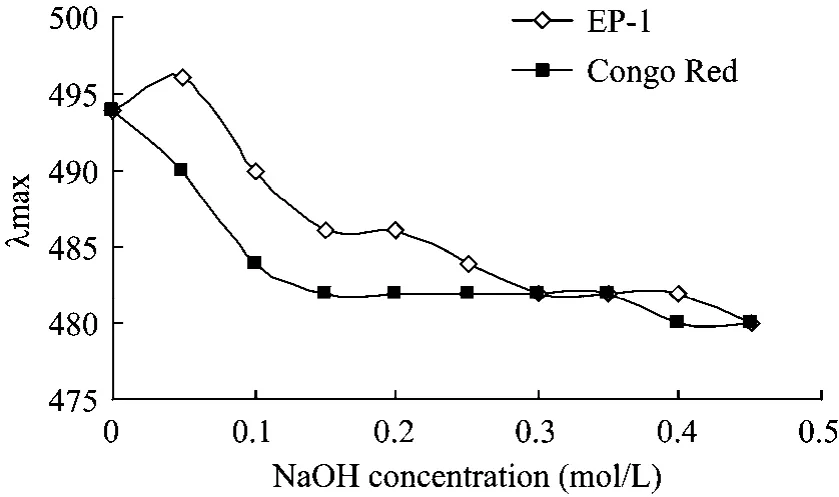
图7 不同浓度NaOH溶液中EP-1样品与刚果红络合物最大吸光值的变化Fig.7 Change in the absorption maximum of the Congo Red-sample complex at various concentrations of NaOH.
2.5.2 高碘酸氧化及甲酸测定
用NaIO4对IP-1及EP-1样品进行选择性定性氧化实验,间隔时间取样,发现其紫外吸收数值始终保持恒定不变,并且用NaOH溶液滴定没有发现甲酸生成。以上结果表明EP-1样品是以不消耗NaIO4的葡萄糖残基以1→3糖苷键方式连接而成的直链葡聚糖。
2.5.3 Smith降解
经透析后袋内物质醇析仍然有大量沉淀产生,而袋外部分用 G.C.分析未检测出任何物质。Smith降解的结果同样验证了 EP-1由高碘酸氧化不能打断的1→3糖苷键方式连接而成。
2.5.4 刚果红结合实验分析
NaOH浓度较小时,溶液的紫外吸收移向长波,表明EP-1样品能与刚果红形成络合物,样品呈有规则的螺旋构象;NaOH浓度增大到一定程度,最大吸收波长下降,多糖的螺旋结构解体,变成无规则的线团形式(图7)。即 EP-1在弱碱性范围内可形成有序的3股螺旋结构,在强碱性条件下,分子间的氢键被破坏,3股螺旋结构解体为单股,不能与刚果红形成络合物。通常的凝胶多糖分子量在40~77 kDa之间,容易形成3股螺旋结构。
2.5.5 多糖结构还原
EP-1样品完全酸水解后的纸层析和高碘酸氧化实验、Smith降解实验均确定多糖 EP-1是以 1→3葡萄糖苷键连接的单糖组分单一的无分支结构的多聚葡萄糖;Sephacryl S-200 HR凝胶层析求得EP-1样品的平均分子量为35.2 kDa;红外光谱分析证明,EP-1样品的红外光谱显示了多糖的特征吸收峰,890 cm−1处的特征峰表示了该多糖的糖苷键为 β-吡喃型糖苷键构型。与刚果红试剂形成的络合物其紫外吸收波长随NaOH浓度变化而变化的构象检测表明EP-1样品在稀碱溶液中(浓度<0.3 mol/L)可能存在3股螺旋构象。
综上所述,可知淡紫拟青霉胞外多糖EP-1的结构式可以图8表示,其中n代表聚合度,约为195。

图8 EP-1的结构式Fig.8 Structural formula of EP-1.
2.6 多糖的生物活性测定
对照组尖孢镰刀菌菌落呈白色絮状,菌丝致密饱满,几乎布满整个平板(图9A)。镜检观察可见菌丝细胞质均匀、直长、少分支、节间较长、有卵形分生孢子产生。
培养基中添加EP-1多糖处理的尖孢镰刀菌,其生长受到抑制,菌丝稀疏,气生菌丝围绕中央的菌饼呈簇状分布,在菌丝团的间隙间可见坏死的菌丝紧贴在培养基表面,呈黑色(图9B)。镜检可见受抑制的菌丝生长异常,多处局部膨大,坏死的菌丝细胞质严重浓缩,部分菌丝消解,胞内物质溢出,未观察到孢子产生。粗多糖对尖孢镰刀菌的抑制能力更强,可使尖孢镰刀菌菌丝大面积坏死,在菌落上形成黑斑(图9C)。

图9 淡紫拟青霉多糖对尖孢镰刀菌的抑制活性Fig.9 Inhibition activity ofPaecilomyces lilacinuspolysaccharide toF.oxysporum.(A)The control group.(B)Adding EP-1 to the medium.(C)Adding crude exopolysacharides to the medium.
与未纯化的粗多糖相比,EP-1对镰刀菌菌落生长的抑制能力略低,推测Superdex G-75层析分离时获得的另外 2个低含量的组分也对镰刀菌具有一定的抑制能力。
3 讨论
到目前为止,从真菌中分离得到的多糖有几十种,可分为聚糖、杂多糖、蛋白糖和肽糖,糖的种类与真菌种属间无明显的相关性。近年研究报道的真菌多糖以葡聚糖居多。Mondal等[19]从食用蘑菇Termitomyces eurhizus的子实体中得到2个多糖PS-I和 PS-II,均为 α-葡聚糖,其中 PS-I结构主链由α-(1,6)-D-葡萄糖和 α-(1,3)-D-葡萄糖按 2.5:1的比例组成,无分枝;PS-II则为 α-(1,6)-D-葡聚糖。陆榕等[20-21]提取出细脚拟青霉Paecilomyces tenuipes粗多糖,纯化后经研究确定了细脚拟青霉多糖 I为α-(1,6)连结的无分枝的葡聚糖,相对分子量为2.05×104,细脚拟青霉多糖 II 则以 β-(1,6)-D-葡聚糖为主链,β-(1,6)-D-甘露糖和 β-(2,6)-D-半乳糖组成侧链。
淡紫拟青霉胞外多糖 EP-1的结构为以 β-(1,3)糖苷键连接而成的无分枝的葡聚糖。此前报道的此类结构的多糖被称为凝胶多糖(又名Curdlan多糖、热凝多糖),目前发现的凝胶多糖为粪产碱杆菌Alcaligenes faecalisvar.myxogenes或土壤杆菌Agrobacteriumspecies所产生[22],由于其独特的结构和理化性质,具有多种生理活性与应用价值。作为食品添加剂,可用于改善加工食品的粘弹性、稳定性、保湿性、抗冷冻性及增稠性等,并可制成可食的生物可降解膜[23];作为免疫调节剂,具有抗肿瘤[24]、降血脂、降胆固醇[25]的作用;此外,经硫酸化修饰的凝胶多糖可用于抗人类HIV病毒[26]。真菌特别是淡紫拟青霉产生此类结构的多糖以及该多糖对尖孢镰刀菌的抑菌活性尚未见报道。
多糖是极其复杂的多聚体,具有微观不均匀一性等特点,即使不同来源的相同多糖其构象、理化性质乃至生物活性及其作用机理也可能不同。如不同来源的β-(1,3)-D-葡聚糖,化学组成虽然相同,但分子大小和空间构象相差很大。黑木耳 β-(1,3)-D-葡聚糖为单股螺旋,香菇β-(1,3)-D-葡聚糖为三股螺旋,虎奶菇β-(1,3)-D-葡聚糖为柔顺链,而它们的生物活性相差很大[27]。本研究结果表明淡紫拟青霉胞外多糖EP-1在稀碱溶液中以三股螺旋的构象存在,该多糖对尖孢镰刀菌具有较高的抑菌活性。这种由淡紫拟青霉所产生的凝胶多糖的发现,表明淡紫拟青霉不仅在植物病害的生物防治领域具有推广价值,同时在食品工业、医药工业等领域也展现出一定的开发利用前景。
现有的结果表明,高级结构对多糖的影响非常大,X-衍射结果显示三股螺旋结构是真菌多糖最具活性的空间构象[28]。如天然香菇多糖的高级结构与其抗肿瘤活性密切相关,当在香菇多糖溶液中加入脲、胍等变性剂,改变其三股螺旋立体构型,其抗肿瘤免疫活性消失[29-30];向水不溶性的裂摺菌多糖种添加尿素或NaOH,则可诱导产生三股螺旋构象,从而表现出抗肿瘤活性[31]。但并不是所有多糖其螺旋结构与活性存在必然关系,如有研究表明灰树花多糖[32]以及从Glomerella cingulata的培养液中分离出的 β-(1,3)-D-葡聚糖(Glomerellan)[33],其抗肿瘤活性均与有序结构无关。淡紫拟青霉胞外多糖EP-1对生存能力很强的枯萎病原尖孢镰刀菌具有很好的抑制作用,但该多糖的抑菌能力是否与其螺旋结构之间存在关联还有待于进一步的研究。
REFERENCES
[1]Zaki FA.Biological control ofMeloidogyne javanicain tomato byPaecilomyces lilacinusand castor.Indian J Nematol, 1998, 28(2): 132−139.
[2]Xiao S, Zhang SS, Liu GK.Control effect ofPaecilomyces lilacinusonMeloidogynespp..J Fujian A & F Univ:Nat Sci Ed, 2006, 35(5): 463−465.肖顺, 张绍升, 刘国坤.淡紫拟青霉对根结线虫的防治作用.福建农林大学学报:自然科学版, 2006, 35(5):463−465.
[3]Debnath S.Occurrence of native entomogenous fungusPaecilomyces lilacinus(Thom)Samson on eggs and larvae of bunch caterpillar(Andraca bipunctata).Two and a Bud,1998, 45: 24−25.
[4]Lin MS, Shen JD, Wen L,et al.Bioassay of physiological activities of metabolic product ofPaecilomyces lilacinus.Acta Agri Jiangsu, 1999, 14(6): 71−74.林茂松, 沈纪东, 文玲, 等.淡紫拟青霉代谢产物生理活性物质分析和生物测定.江苏农业学报, 1999, 14(6):71−74.
[5]Li F, Shi H, Liu B,et al.Antagonistic effect of biocontrol fungus,Paecilomyces lilacinusstrain NH-PL-03 and its mechanism againstFusarium oxysporum.Acta Phytophyl Sin, 2005, 32(4): 373−378.李芳, 史怀, 刘波, 等.淡紫拟青霉对尖孢镰刀菌的拮抗作用与机制分析.植物保护学报, 2005, 32(4):373−378.
[6]Li F, Huang SF, Liu B.Degradation of phoxim byPaecilomyces lilaciuns.Chin J Appl Environ Biol, 2006,12(1): 104−107.李芳, 黄素芳, 刘波.淡紫拟青霉对辛硫磷的降解效应.应用与环境生物学报, 2006, 12(1): 104−107.
[7]Segers R, Butt TM, Kerry BR,et al.The role of the proteinase VCP1 produced by the nematophagousVerticillium chlamydosporiumin the infection process of nematode eggs.Mycol Res, 1996, 100(4): 421−428.
[8]Costa MJN, Campos VP, Pfenning LH,et al.Fungus filtrates toxicity toMeloidogyne incognita.Fitopatologia Brasileira, 2001, 26(4): 749−755.
[9]Voinove-Raikova Z, Bakalivanov D, Chanova D.Betaindoleacetic acid in some soil microorganisms.Pochvozn Agrokhim, 1969, 4: 85−90.
[10]Gunasekera TS, Gillings MR, Briscoe DA,et al.Phenotypic and genetic characterization ofPaecilomyces lilacinusstrains with biocontrol activity against root-knot nematodes.Can J Microbiol, 2000, 46(9): 775−783.
[11]Cheng XL, Sun JW, Yang J,et al.Conditions for dextranase formation byPaecilomyces lilacinus.Acta Microbiol Sin, 1992, 32(5): 334−339.程秀兰,孙晋武, 杨敬, 等.淡紫拟青霉右旋糖酐酶的形成条件.微生物学报, 1992, 32(5): 334-339.
[12]Shi H, Zhu YJ, Li F,et al.Ploysaccharides ofPaecilomyces lilacinusstrain NH-PL-03 and its inhibitory effects onFusarium oxysporum.China Plant Propt, 2006,26(9): 5−8.史怀, 朱育菁, 李芳, 等.淡紫拟青霉NH-PL-03菌株的多糖及其对尖孢镰刀菌的抑制作用.中国植保导刊,2006, 26(9): 5−8.
[13]Jin LQ, Lü JX, Yang JZ.Paecilomyces cicadidaetotal polysaccharides regulates immune function in immunosuppressed rats.Chin J Pathophysiol, 2006, 22(5):881−884.金丽琴, 吕建新, 杨介钻.蝉拟青霉总多糖对免疫抑制大鼠组织器官免疫功能调节的实验研究.中国病理生理杂志, 2006, 22(5): 881−884.
[14]Mei DQ, Wen TC, Liang ZQ.Effects of polysaccharides from mycelia ofPaecilomyces gunnii(MPPG)on the immunosuppressive factors deriving from tumor cells.J Guizhou Univ:Nat Sci Ed, 2006, 23(2): 191−195.梅德强, 文庭池, 梁宗琦.古尼拟青霉菌丝体多糖(MPPG)对肿瘤细胞产生免疫抑制因子的影响.贵州大学学报: 自然科学版, 2006, 23(2): 191−195.
[15]Li BJ, Jin LQ, Zuo JC.Experimental study on the anti-HBV effect of polysaccharides fromPaecilomyces tenuipes.J Chin Med Matr, 2007, 30(2): 200−202.李宝剑, 金丽琴, 左江成.细脚拟青霉多糖抗乙型肝炎病毒的体外实验研究.中药材, 2007, 30(2): 200−202.
[16]Qi HL, Wei SY, Wang JL.Removal of proteins from polysaccharides by Sevage method.Tianjin Chem Ind,2000, 12(3): 20−21.齐慧玲, 魏绍云, 王继伦.Sevage法去除多糖中蛋白的研究.天津化工, 2000, 12(3): 20−21.
[17]Zhang WJ.Research Technology of Glycoconjugates Biochemistry.Hangzhou: Zhejiang University Press, 1999.张惟杰.糖复合物生化研究技术.杭州: 浙江大学出版社, 1999.
[18]Zhou L, Guo SY, Cai MY,et al.Research on the viscosity and conformation character ofSchizophyllan.Food Ferm Ind, 2005, 31(11): 1−5.周林, 郭祀远, 蔡妙颜, 等.裂褶菌胞外多糖的粘度性质及其构象研究.食品与发酵工业, 2005, 31(11): 1−5.
[19]Mondal S, Chakraborty I, Pramanik M,et al.Structural studies of water-soluble polysaccharides of an edible mushroom,Termitomyces eurhizus.A reinvestigation.Carbohydr Res, 2004, 339(1): 1135−1140.
[20]Lu R, Sun LS, Wang ZF,et al.Studies on chemical structure of polysaccharide I obtained fromPaecilomyces tenuipes.Chin Trad Herbal Drugs, 2001, 32(10):865−867.陆榕, 孙立崧, 王仲孚, 等.细脚拟青霉多糖I的化学结构.中草药, 2001, 32(10): 865−867.
[21]Lu R, Miyakoshi T, Tian G.Structural studies ofPaecilomyces tenuipesSamson polysaccharide-part-2.Carbohydrate Polymers, 2007, 67(3): 343−346.
[22]Ai ZL, Huang ZM.Curdlan and it’s application in food industry.Food Sci Technol, 1998, 24(4): 25−27.艾志录, 黄忠民.凝结多糖及其在食品工业中的运用.食品科技, 1998, 24(4): 25−27.
[23]Jezequel V.Curdlan: a new functional beta-glucan.Cereal Foods Word, 1998, 43(5): 361−364.
[24]Kudoh Y, Shimizu J, Ishiyama A,et al.Secretion and excretion of immunoglobulin A to cecum and feces differ with type of digestible saccharine.J Nutr Sci Vitaminol,1999, 45(2): 173−181.
[25]Takeda HN, Neoh LP, Akimoto H,et al. Role of curdlan sulfate in binding of HIV-1 gp120 to CD4 molecules and the production of pg120-mediated TNF-alpha.Microbiol Immunol, 1997, 41(9): 741−745.
[26]Sun YS, Wang L, Zhan XB,et al.Influence of nitrogen source NH4Cl Concentration on Curdlan Production inAlcaligenes faecalis.Chin J Biotech, 2005, 21(2):328−331.孙永生, 王磊, 詹晓北, 等.氮源 NH4Cl浓度对粪产碱杆菌发酵生产热凝胶的影响.生物工程学报, 2005,21(2): 328−331.
[27]Wang DM, Li L, Guo SY,et al.Relationship between structure and activity of active polysaccharides.Mod Chem Ind, 2002, 22(8): 18−22.王当梅, 李琳, 郭祀远, 等.活性多糖构效关系研究综述.现代化工, 2002, 22(8): 18−22.
[28]Xiao JH.Current status and ponderation on preparations and chemical structures of polysaccharide in fungi ofCordyceps(Fr.)Link.Chin Trad Herbal Drugs, 2008,39(3): 454−460.肖建辉.虫草属真菌多糖制备及化学结构的研究现状与思考.中草药, 2008, 39(3): 454−460.
[29]Matsuoka H, Seo Y, Wakasugi H,et al.Lentinan potentiates immunity and prolongs the survival time of some patients.Anticancer Res, 1997, 17(4A): 2751−2755.
[30]Zhang PY, Zhang LN, Cheng SY.Effect of urea and sodium hydroxide on the molecular weight and conformation of β-(1,3)-D-glucan fromLetinus edodes in aqueous solution.Carbohydr Res, 2000, 327(2): 431−438.
[31]Young SH, Jacobs RR.Sodium hydroxide-induced conformational change in schizophyllan detected by the fluorescence dye, aniline blue.Carbohydr Res, 1998,310(1): 91−99.
[32]Bian B, Ye BP, Xi T,et al.Advance in the study on polysaccharides fromGrifolafrondosa.Pharm Biotechnol, 2004, 11(1): 60−63.边彬, 叶波平, 奚涛, 等.灰树花多糖的研究进展.药物生物技术, 2004, 11(1): 60−63.
[33]John A Bohn, James N BeMiller.(1→3)-β-D-glucans as biological response modifiers: a review of structurefunctional activity relationships.Carbohydr Polym, 1995,28(1): 3−14.
Isolation, purification and structure analysis of polysaccharides from Peacilomyces lilacinus
Huai Shi, Bo Liu, Mingxing Su, Sufang Huang, and Yujing Zhu
Agricultural Bioresources Research Institute, Fujian Academy of Agricultural Sciences, Fuzhou 350003, China
Received:February 4, 2010;Accepted:May 6, 2010
Supported by:National High Technology Research and Development Program of China(863 Program)(No.2006AA10A211), Natural Science Foundation of Fujian Province of China(No.2008J0320).
Corresponding author:Bo Liu.Tel: +86-591-87884601; E-mail: fzliubo@163.com国家高技术研究发展计划(863计划)(No.2006AA10A211),福建省自然科学基金项目(No.2008J0320)资助。
