不同培养条件对牛膝发根诱导的研究
2010-10-16毕博徐大卫闻玉丽刘亚磊杨世海林悦
毕博,徐大卫,闻玉丽,刘亚磊,杨世海*,林悦
(1.吉林农业科技学院教务处,吉林 吉林 132109;2.中国药材公司,北京 100195;3.吉林农业大学中药材学院,吉林 长春 130118;4.河北医科大学基础课教学部,河北 石家庄 050091)
不同培养条件对牛膝发根诱导的研究
毕博1,徐大卫2,闻玉丽3,刘亚磊4,杨世海3*,林悦4
(1.吉林农业科技学院教务处,吉林 吉林 132109;2.中国药材公司,北京 100195;3.吉林农业大学中药材学院,吉林 长春 130118;4.河北医科大学基础课教学部,河北 石家庄 050091)
目的:利用发根农杆菌A4,R1,1601,1025诱导牛膝,得到发根。方法:采用共培养法诱导牛膝发根,研究不同菌种类型、不同外植体、不同浸染时间、乙酰丁香酮浓度等条件对转化率的影响。结果:利用发根农杆菌1025浸染牛膝的叶片为转化材料,当感染8min,转化率最高。在培养基中添加50μmol·L-1乙酰丁香酮可以提高牛膝发根的转化效率。结论:用共培养法诱导出牛膝发根,并确定了最佳诱导条件,以提高牛膝外植体的诱导率。
牛膝;发根农杆菌;发根;诱导率
牛膝Achyranthes bidentataBl.是苋科牛膝属植物,主产河南省焦作市沁阳、武陟、温县一带[1]。其根具有逐瘀通经,补肝肾,强筋骨,利尿通淋,引血下行的功能[2]。药理研究表明,怀牛膝所含的多糖、皂元齐墩果酸、蜕皮激素等有效成分具有消炎、利尿、强心、抑制S180瘤株生长及抗生育作用[3,4]。中药牛膝属多年生草本植物,生长缓慢,不能满足市场需求,而发根农杆菌在植物遗传改造上有明显的增强次生代谢的作用,近年来,应用Ri质粒转化药用植物的研究越来越受到重视[5,6]。本试验采用发根农杆菌诱导牛膝外植体,成功得到了牛膝发根,为建立牛膝工业化生产的新途径提供了一个参考方法。
1 材料与方法
1.1 植物材料
牛膝AchyranthesbidentataBl.种子,采自吉林农业大学药植园,经吉林农业大学中药材学院杨世海教授鉴定。
1.2 牛膝无菌苗的获得
挑选成熟饱满的牛膝种子,用无菌水清洗3次,然后用75%乙醇消毒30s后,用无菌水清洗3次;用0.1%HgCl浸泡10min之后,用无菌水清洗3次,再用无菌滤纸将种子表面的水分吸干,将种子接种到MS培养基中。于温度25℃,光强2 000lx、光照12h·d-1条件下萌发,见图1。
图1 牛膝无菌苗
1.3 发根农杆菌的活化
无菌条件下,接种针挑取保存菌液,于YEB固体平板上划线培养,28℃放置于暗培养条件下培养,直到长出单菌落。挑取一个单菌落接种于20mL附加有Kan(50mg·L-1)的液体YEB培养基,28℃,摇床摇速180r·min-1条件下培养24h复苏。此时YEB液体培养基由接种前的透明的红棕色变成浑浊的淡黄色,证明细菌已正常长出。长出的菌液还要进行再次活化,活化时取1mL复苏菌液加入50mL的YEB液体培养基中,28℃,180r·min-1培养12h,活化菌液达到生长对数期,此时菌液即可作为感染用。
1.4 牛膝发根的诱导
在无菌条件下将牛膝无菌苗的幼嫩叶片剪成1cm2大小的片段,茎段长约1cm,每个样品的MS固体培养基上接种10片,每个样品重复3次,黑暗中25℃下预培养2d。在超净工作台上将预培养2d后的叶片转移至已灭菌的锥形瓶,再将活化好的感染菌液倒入其中,感染时间8min。感染过程中需不断轻轻摇晃锥形瓶,然后用无菌滤纸吸干叶片表面菌液,接种到含AS的MS固体平板培养基中,于25℃黑暗条件下共培养2d,再将感染材料用无菌水清洗3次,用无菌滤纸吸干叶片表面的水,转接到含有Cef(500mg·L-1)的MS固体平板培养基上,于25℃黑暗条件下培养,每7d转接1次,30d后统计诱导出的发根数,并计算平均诱导率。
2 结果与分析
2.1 不同发根农杆菌对牛膝发根诱导率的影响
由于不同发根农杆菌菌株对牛膝茎叶诱导率的影响程度不同,采用共培养法来比较牛膝茎叶对四种发根农杆菌A4,R1,1601,1025的敏感程度,诱导率统计结果见表1。
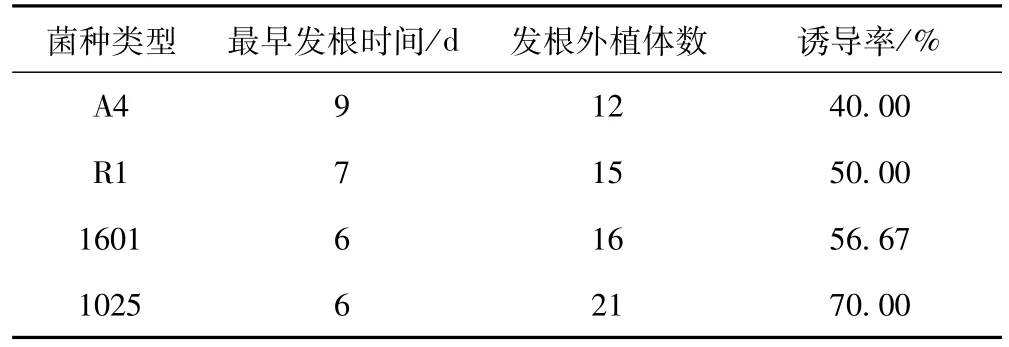
表1 不同发根农杆菌对发根诱导率的影响
表1数据显示,4种发根农杆菌A4,R1,1601,1025对牛膝外植体都有一定的诱导作用,其中经过A4浸染的牛膝外植体诱导率最低,只有40%,其次为R1,1601,诱导率最高的是1025,达到了70%。由此可知,牛膝对发根农杆菌1025最为敏感,1025为最适菌株。不同菌株类型对发根诱导率影响效果见图2。
图2 4种不同菌株类型对发根诱导率的影响
2.2 不同外植体对牛膝发根诱导率的影响
利用发根农杆菌1025,采用共培养法对牛膝外植体进行感染发现,选用的外植体不同,发根的诱导率也不同,结果见表2。

表2 不同外植体对发根诱导率的影响
由表2数据可以看出,牛膝叶片的诱导率比较高,达到76.67%,而茎段的诱导率相对较低,但是差别不是很明显。因此,实验中选用牛膝叶片作为外植体。
2.3 不同浓度乙酰丁香酮对诱导发根的影响
植物受伤后产生的酚类物质能激活Vir基因,促使质粒向植物细胞转移,在转化系统中加入某种酚类物质可以促进基因转化。目前广泛使用的是乙酰丁香酮(AS)和羟基乙酰丁香酮(OH-AS),已取得了良好效果。由于不同浓度AS对牛膝发根的诱导程度不同,在MS培养基中分别加入0,25,50,75,100mg·L-1的AS培养,诱导率都有所提高,结果见表3。
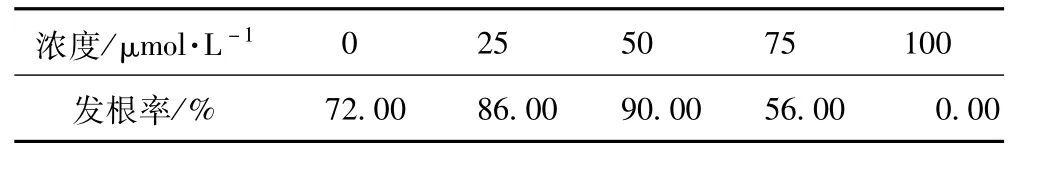
表3 乙酰丁香酮对发根的影响
由表3可知,在本实验中,加入AS后发根诱导率有所提高,效果比较明显,但是在加入100μmol·L-1时,外植体大部分死亡,反而使其诱导率大大下降。50μmol·L-1的AS最适合牛膝发根的诱导,诱导率可达到90%。AS对发根诱导率的影响效果见图3。

图3 AS对发根诱导率的影响
2.4 不同浸染时间对发根诱导率的影响
浸染时间对于诱导率的高低也有直接的影响。适宜的浸染时间有助于农杆菌对植物细胞的附着和转化。如果浸染时间太短,农杆菌来不及侵入细胞内部;浸染时间太长,农杆菌容易对外植体细胞造成侵害,导致外植体的存活率下降,结果见表4。

表4 不同浸染时间对发根诱导率的影响
从表4中可以看出,浸染时间在6~8min诱导效果相对较好,8min之后平均诱导率开始急剧下降,并且菌大量生长,外植体软腐,部分死亡。
3 结论
利用发根农杆菌1025浸染牛膝的叶片为转化材料,当感染8min,转化率最高。在培养基中添加50μmol·L-1AS可以提高牛膝发根的转化效率。
试验利用4种农杆菌对牛膝外植体进行感染,诱导出了发根,但其诱导率有所不同,可能因为4种农杆菌的生长周期不同导致其诱导能力不同。发根农杆菌的诱导能力表现在发状根数目和发状根出现所需时间两个方面,另外还受宿主植物的种、品种、生理状态、环境条件、宿主范围等因素的影响。
在用不同浓度AS对牛膝进行发状根培养时,浓度过低除菌不彻底,造成霉菌产生,而浓度过高导致牛膝外植体中毒死亡,适宜的浓度可使牛膝发状根生长快速。
综合上述各因素的影响,我们得出了诱导牛膝发根的最佳条件:用牛膝叶片作为外植体,发根农杆菌1025浸染8min,培养基中添加50μmol·L-1AS。该实验为下一步获得大量牛膝发根和提高其多糖、三萜皂苷类物质含量的筛选工作奠定了基础。确立牛膝发根的离体培养条件和对发根中多糖、皂苷类物质的提取是我们下一步工作亟待解决的问题。
[1]高晓山.“四大怀药”考按[J].河南中医,1994,14(3):42.
[2]国家药典委员会.中国药典(一部)[S].北京:中国医药科技出版社,2010:68.
[3]中国医学科学院药物研究所.中草药有效成分的研究(第一分册)[M].北京:人民卫生出版社,1972:398.
[4]湖南医药工业研究所.齐墩果酸治疗急性黄疸肝炎疗效和实验动物的组织学初步观察[J].中草药通讯,1977,(4):32.
[5]刘伟华,徐香玲,姜静,等.植物基因工程中Ri质粒的研究与应用[J].植物研究,1995,15(3)386-390.
[6]蔡国琴,李国珍,叶和春,等.Ri质粒转化的青蒿发根培养及青蒿素的生物合成[J].生物工程学报,1995,11(4):315-320.
Effect of Different Conditions of Culture on Inducement of Hairy Roots ofAchyranthes BidentataBl.
Bi Bo1,Xu Dawei2,Wen Yuli3,Liu Yalei4,Yang Shihai3,Lin Yue4
(1.Academic Office,Jilin Agricultural Science and Technology College,Jilin Jilin132109,China;2.China National Corp.of Traditional&Herbal Medicine,Beijing100195,China;3.College of Medicinal Materials,Jilin Agricultural University,Changchun Jilin130118,China;4.Education Department of basic courses,Hebei Medical University,Shijiazhuang Hebei050091,China)
Objective:To induce hairy roots ofAchyranthes bidentataBl.byAgrobacterium rhizogenesA4,R1,1601,1025.Methods:Hairy roots were induced by co-culture.Effects of different types of bacteria,different explants,different infection time and different concentrations of acetosyringone on the transformation frequency were studied.ResultsThe highest induction frequency was obtained from leaves withAgrobacterium rhizogenes1025 infection which were infected 8min.The transformation frequency could be raised by culture medium with 50μmol·L-1acetosyringone.ConclusionHairy roots were induced by co-culture and the optimum induced condition was determined to improve the induction rate of explants.
Achyranthes bidentataBl.;Agrobacterium rhizogenes;Hairy roots;Induction rate
*杨世海,E-mail:jlyangs@163..com
2009-11-04)
