钯催化下1,3-二甲酰基薁类衍生物的合成
2010-10-12邢锦娟,王道林,林立男等
钯催化下1,3-二甲酰基薁类衍生物的合成
在钯催化作用下,以一氧化碳和氢气为甲酰化试剂,以苯做反应溶剂,在6×106Pa、120℃下,反应底物、有机碱和催化剂的物质的量比为1∶2∶0.02,合成了1,3-二甲酰基薁,产品收率为77%。在此反应条件基础上,通过改变取代基,进行酰基化反应合成了1,3-二甲酰基-5-甲基薁,1,3-二甲酰基-6-叔丁基薁,1,3-二甲酰基-2,4,6-3甲基薁3种薁类衍生物,收率分别为68%、60%、65%。实验反应收率良好、操作简单、条件温和。4种新型化合物的产品结构通过红外光谱仪、核磁共振光谱仪以及元素分析仪进行了表征。
薁; 1,3-二甲酰基薁; 一氧化碳-氢气; 钯催化; 合成
薁作为非苯芳烃的典型代表[1],由于其独特的[4+6]π电子结构而在化学、物理以及生物活性等方面表现出良好的特性[2]。在薁类化学的研究中,国内研究较少,目前主要集中在日本等一些国家[3-4],作为新型着色剂、新材料以及抗炎剂、抗血脂剂及抗胃肠溃疡剂等。
鉴于此类化合物具有广泛用途,本课题组对杂环修饰的薁类衍生物的合成进行了较为深入的探讨[5-7],发现一些活性官能基团,如乙酰基、卤乙酰基、甲酰基等的引入,在杂环修饰的薁类衍生物的合成及其相关性能研究方面提供了好的途径。
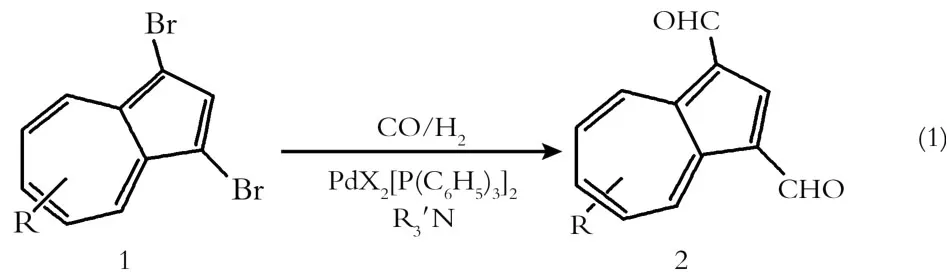
在薁类化学中,薁的1-位和3-位容易发生亲电取代反应,通过经典的V ilsmeier酰基化反应,在薁的1-位或3-位引入甲酰基通常是比较容易实现[8],但同时在1-位和3-位引入甲酰基却较难进行。在芳烃的酰基化反应中,通过钯催化对卤代芳烃进行的酰基化反应过程是一个有效方法[9]。本工作对此过程加以应用,在中等压力(6×106Pa)下成功实现了1,3-二甲酰基薁类衍生物的合成。
1,3-二甲酰基薁类衍生物的合成路线如(1)式所示:
1 实验部分
1.1 仪器与试剂
WRS-1B数字熔点仪(熔点未校正),上海物理光学仪器厂;Bruker DPX-400 M Hz核磁共振仪(四甲基硅烷为内标),德国布鲁克公司;BIO-RAD FTS-40型傅立叶变换红外分光光度计(KBr压片),美国伯乐公司;Vario EL元素分析仪,德国elementar公司;1,3-二溴代薁类衍生物按照文献[8]方法制备,所用试剂均为分析纯试剂。
1.2 1,3-二甲酰基薁类衍生物的合成
将1,3-二溴代薁,三正丁基胺,苯加入到250 m L的压力反应釜中,密闭后,搅拌下用氩气置换3次,通入一氧化碳至3 039.75 kPa,防空后再通入一氧化碳至3×106Pa,接着通入氢气至6×106Pa,加热升温至120℃,反应24 h。冷却,加入水(100 m L),分出有机相,分别用质量分数10%的盐酸和饱和食盐水洗涤,无水硫酸钠干燥,蒸出溶剂,得到残余物通过硅胶柱分离(硅胶:160~200目;苯-乙酸乙酯(体积比95∶5)为洗脱剂),得到相应的1,3-二甲酰基薁类衍生物(2a~2d),其中2a~2d分别代表1,3-二甲酰基薁、1,3-二甲酰基-5-甲基薁、1,3-二甲酰基-6-叔丁基薁、1,3-二甲酰基-2,4,6-三甲基薁。
2a~2d的合成路线如式(2),(3)所示:

1.2.1 衍生物2a的合成 以1,3-二溴代薁(1a)的酰基化反应作为模板反应(反应式(2)),在钯催化剂作用下,考察了一氧化碳和氢气、有机碱、溶剂、压力、温度和反应时间对反应收率的影响,结果如表1所示。反应中催化剂对反应的影响较为突出,三苯基膦二溴化钯[(PPh3)2PdBr2]表现出较强活性,三苯基膦二氯化[(PPh3)2PdCl2]活性较低,而氯化钯(PdCl2)没有表现出相应活性。此外,温度和压力对反应无明显影响,基于安全上的考虑,该反应较佳的条件为:以苯做反应溶剂,在6×106Pa、120℃下,反应底物、有机碱和催化剂的物质的量比为1∶2∶0.02,得到产物1,3-二甲酰基薁(2a)(红色针状),m.p.112~114℃;1H-NMR(400 M Hz,CDCl3),δ:7.71~7.84(m,2H),8.12(t,1H,J=9.6,9.6 Hz),8.48(s,1H),9.58(d,2H,J=10.0 Hz),10.18(s,2H,2xCHO);IR(KBr):ν在1 646 cm-1(CHO)。元素分析(质量分数,下同),C12H8O2计算值:C,78.25%,H,4.38%;测得值:C,78.34%,H,4.44%。

表1 1,3-二甲酰基薁的合成条件与结果Table 1 Conditionsand results synthesis of 1,3-diformylazulene

续表1
1.2.2 衍生物2b~2d的合成 在上述反应条件下,取代的1,3-二溴代薁(1b~1d)经酰基化得到1,3-二甲酰基薁(2b~2d)(反应式(3))。反应活性受取代基性质影响较小。结果见表2。

表2 化合物2的反应时间和收率Table 2 Reaction timesand yields of the products 2
1,3-二甲酰基-5-甲基薁(2b)(红色针状):m.p.137~138℃;1H-NM R(400 M Hz,CDCl3),δ:2.84(s,3H,CH3),7.71(m,1H,),8.12(d,1H,J=9.6 Hz),8.52(s,1H),9.51(d,1H,J=10.0 Hz),9.75(s,1H),10.18(s,1H,CHO),10.21(s,1H,CHO);IR(KBr),ν:1 643 cm-1(CHO)。元素分析,C13H10O2计算值:C,78.77%,H,5.09%;测得值:C,78.81%,H,5.13%。
1,3-二甲酰基-6-叔丁基薁(2c)(红色针状):m.p.127~128℃;1H-NMR(400 M Hz,CDCl3),δ:1.54(s,9H,3xCH3),8.11(d,2H,J=9.6 Hz),8.50(s,1 H),9.73(d,2 H,J=9.6 Hz),9.75(s,1H),10.20(s,2H,2xCHO);IR(KBr),ν:1 6 4 0(CHO)cm-1。元素分析,C16H16O2计算值:C,79.97%,H,6.71%;测得值:C,80.15%,H,6.79%。
1,3-二甲酰基-2,4,6-三甲基薁(2d)(红色针状):m.p.164~166℃;1H-NM R(400 M Hz,CDCl3),δ:2.70(s,3H,CH3),3.10(s,3 H,2 xCH3),7.48(s,2 H),8.6 2(s,1 H),10.31(s,2H,2xCHO);IR(KBr),ν:1 640 cm-1(CHO)。元素分析,C15H14O2计算值:C,79.62%,H,6.24%;测得值:C,79.74%,H,6.38%。
综上所述,在钯催化作用下,以一氧化碳和氢气为甲酰化试剂,对1,3-二溴代薁进行酰基化反应,成功地制备了1,3-二甲酰基薁,1,3-二甲酰基-5-甲基薁,1,3-二甲酰基-6-叔丁基薁,1,3-二甲酰基-2,4,6-三甲基薁4种新型的薁类衍生物。
在本次实验中,制备1,3-二甲酰基薁的最佳条件为:以苯做反应溶剂,在6×106Pa、120℃下,反应底物、有机碱和催化剂的物质的量比为1∶2∶0.02,产品收率为77%;在此反应条件基础上,通过改变取代基,进行酰基化反应,成功合成了1,3-二甲酰基-5-甲基薁,1,3-二甲酰基-6-叔丁基薁,1,3-二甲酰基-2,4,6-3甲基薁3种薁类衍生物,收率分别为68%、60%、65%。4种新型化合物的产品结构通过熔点测定仪、红外光谱仪、核磁共振光谱仪以及元素分析仪进行了证实。该研究为进一步研究具有新型结构的薁类功能性化合物提供了物质基础。
[1]Nozoe T,Takase K,Matsumura H.Dai Yuki Kagaku[M].Tokyo:A sakura Shoten,1960,13,12-34.
[2]Fisher G.Advances in heterocyclic chemistry[M].New Yo rk:Academic p ress,1996,66,285-312.
[3]Tomiyama T,Tomiyama A,Yokota M,et al.Carbonyloxy-sustituted azulene squaric acid dyes,US:5843999[P].1998-12-1.
[4]Yaragisawa T,Wakabayashi S,Tomiyama T,et al.Synthesis and antioxidant activity of 3-substituted guaiazulene derivatives[J].Chem.pharm bull,1998,36:641-647.
[5]Wang D L,Imafuku K.New synthetic app roach to azuleno[1,2-c]pyrroles and conversion to benz[a]azulenes[J].Heterocycles,2001,54:647-665.
[6]Wang D L,Imafuku K.Synthesis of 1-(4-thiazoly)azulenes:reactions of bromoacetyl substituted azulenes with thio amides,thio ureas,and thio semicarmicar bazones[J].J.heterocycl chem.,2004,41:723-729.
[7]Wang D L,Den J J,XU J,et al.Synthesisof methyl 1-(3-dimethylamino-2-p ropenoyl)azulene-3-carboxylate and reactions with hydroxylamine and hydrazines[J].Heterocycles,2007,71:2237-2242.
[8]Wibaut J P,Hey JW.Recueip des travaux chiaiques des pays-bas[J].Recl.trav.chim.,1953,72:513.
[9]Schoenberg A,Heck R F.Palladium-catalyzed aryl,heterocyclic,and vinylic halides[J].J.Amer.chem.soc.,1974,96(25):7761-7764.
(Ed.:YYL,Z)
Palladium-Catalyzed Efficient Synthesis of 1,3-Diformylazulene Derivatives
XING Jin-juan,WANGDao-lin,L IN Li-nan,Q IAN Jian-hua,L IU Lin
(Liaoning Key Laboratory of Synthesis and Application of Functional Compound,Bohai University,Jinzhou Liaoning121003,P.R.China)
1,3-diformylazulene was synthesized by 1,3-dibromoazulenes,organic base and catalyst under 6×106Pa at 120℃with carbon monoxide-hydrogen for the formylation reagent,while palladium(Ⅱ)was as the catalyst,benzene as solvent.The yield was 77%under the condition the molar ratio of 1,3-dibromoazulenes,o rganic base and catalyst was 1∶2∶0.02.Based on the reaction,by changing the substituent,1,3-dimethylacyl-5-methylazulene,1,3-dimethylacyl-6-tertbutyl-azulene,1,3-diformy-2,4,6-trimethyl-azulene were synthesized by acylation reactions,the yields were 68%,60%,65%.This method provides several advantages such as good yields,simple work-up procedures and mild conditions.A ll the products are confirmed by1H-NMR,IR spectra and elemental analysis.
Azulene;1,3-diformylazulene;Carbon monoxide-hydrogen;Palladium catalyst;Synthesis Corresponding author.Tel.:+86-416-3400328;fax:+86-416-3400328;e-mail:xingjinjuan@sohu.com
O625.15
A
10.3696/j.issn.1006-396X.2010.02.018
2009-12-15
邢锦娟(1980-),女,山西原平市。
辽宁省教育厅创新团队资助项目(2008T001);辽宁省优秀人才支持计划资助项目(2009R02)。
1006-396X(2010)02-0064-03
Received15December2009;revised12March2010;accepted30March2010
