超富集植物遏蓝菜对重金属吸收、运输和累积的机制
2010-10-11刘戈宇柴团耀孙涛
刘戈宇,柴团耀,孙涛
中国科学院研究生院生命科学学院,北京 100049
综 述
超富集植物遏蓝菜对重金属吸收、运输和累积的机制
刘戈宇,柴团耀,孙涛
中国科学院研究生院生命科学学院,北京 100049
遏蓝菜Thlaspi caerulescens可以在其地上部累积大量重金属如锌、镉等,是公认的超富集植物。由于该植物生物量小,不宜直接用于重金属污染的土壤植物修复,而被广泛作为一种模式植物来进行重金属富集机制研究。遏蓝菜对重金属离子的累积大致经过螯合剂解毒、地上部长距离运输以及在液泡中的储存等生理过程。已经发现的植物体内的金属螯合剂——有机酸、氨基酸、植物络合素(PCs)、金属硫蛋白(MT) 和尼克烟酰胺NA等,区室化以及长距离运输相关的转运蛋白——ZIP (ZRT/IRT like protein)、CDF (Cation diffusion facilitator)、Nramp (Natural resistance and macrophage protein) 和HMA (Heavy metal ATPase) 等家族,以上各种基因、多肽与蛋白等共同参与了植物对金属累积与耐受过程并发挥各自重要的作用。以下主要介绍了遏蓝菜重金属超富集相关的基因、多肽和蛋白,以及它们在重金属螯合作用和运输过程中的功能。
遏蓝菜,重金属,富集,螯合,转运
Abstract:Thlaspi caerulescens, the famous model plant of heavy-metal hyperaccumulator, can uptake and accumulate large amount of heavy metals in its above-ground part of the plants. However, the very low biomass inThlaspi caerulescensmakes this plant unfit for direct application in phytoremediation. In recent years, there are many reports about the physiological and molecular characterization ofThlaspi caerulescensunder heavy metals stresses, including absorption, transport and intracellular detoxification processes (e.g., chelation and compartmentation). Research teams have conducted many studies of chelators in plants, such as organ acid, amino acid, phytochelatins, metallothioneins and nicotianamine, and so on. Several transport protein families, such as Zinc Regulated Protein, Cation Diffusion Facilitator, Natural Resistance and Macrophage Protein and Heavy Metal ATPase, play important role in short/long distance transport in the plant. In this review, we summarize the current knowledge of the physiological and molecular mechanisms of heavy metals accumulation inThlaspi caerulescens, with particular emphasis on the roles of transporters and chelatins in modulating plant heave-metal-stress responses.
Keywords:Thlaspi caerulescens, heavy metal, accumulation, chelation, transportation
近年来,随着工业化进程的不断加剧,日益严重的重金属污染已经成为全球性的环境问题[1-2]。重金属能够通过食物、水以及空气等途径进入人体并在体内累积,对人类健康造成巨大的威胁。虽然一些重金属如 Cu、Zn、Fe等是维持动、植物正常生理机能的重要元素,但是这些金属元素的过量存在也会对组织器官造成毒害。在矿区附近,有些如菥蓂属、鼠耳芥属以及芸薹属等植物可以在含有高浓度Cd、Hg、Pb等重金属的土壤中正常生长[3]。经过分析研究,发现这些植物与同种其他非重金属污染土壤中生长的植物相比,具有很强的重金属耐性和超富集能力[4]。
遏蓝菜Thlaspi caerulescens为菥蓂属,是公认的一种重金属超富集植物。近年来基于它所具有的特殊重金属耐性以及超富集机制,对其重金属吸收累积机制方面进行广泛研究。关于遏蓝菜的重金属富集相关的最早报道源于 1865年,Sachs等发现遏蓝菜T. caerulescens能够在富含Zn的土壤中生长,而且体内的Zn元素含量占植株总干重的17%[5]。而重金属“超富集植物”(Hyperaccumulator) 定义则是最早由Brooks等于1977年提出,以Ni超富集植物为例,植物体内Ni累积量大于1 000 mg/kg DW(Dry weight) 就称为超富集植物[6]。人们通过对此类植物进一步的研究和分析,逐渐完善了这一定义——植物叶片或地上部分 (干重) 中所含重金属含量高于根部或地下部分,且分别含Cd达到100 mg/kg DW,Co、Cu、Ni、Pb达到1 000 mg/kg DW,Mn、Zn达到10 000 mg/kg DW以上的植物称为超富集植物。遏蓝菜是一种可富集多种重金属的超富集植物,分别可累积30 000 mg/kg DW Zn[7],14 000 mg/kg DW Cd[8],4 700 mg/kg DW Ni[9],因此被人们应用于重金属污染土壤的植物修复中;但因其生物量小,在土壤重金属植物修复产业化应用中具有一定缺陷,人们逐渐将它更多地作为一种模式植物,针对其特殊的重金属耐性、超富集机理进行广泛深入地研究。迄今为止,遏蓝菜重金属超富集功能机制的研究主要在于,克隆和发现一些在植株体内参与重金属转运和解毒相关一些基因和蛋白,通过的体内和体外实验来进一步了解和发现这些蛋白和基因在重金属富集以及运输过程中的作用。如Vert等发现TcIRT家族基因在植物Fe2+、Zn2+转运过程中发挥一定作用[10]。Hassinen转基因拟南芥过量表达TcMT2、TcMT3基因后发现,这两个基因的过量表达不会对植株Zn元素的富集产生直接影响[11]。Wei和Oomen等同时发现NRAMP转运蛋白在遏蓝菜对Ni2+、Fe2+金属转运过程中发挥重要作用[12-13]。除此之外,TcHMA、TcYSL等转运相关蛋白编码基因的发现以及功能鉴定进一步拓宽了人们对遏蓝菜重金属超富集与耐受机制的认识。本文主要综述遏蓝菜金属螯合物和转运蛋白的功能及其在重金属耐性/超富集中的作用机制研究进展。
1 重金属离子螯合物
植物对重金属的耐受与累积主要包括以下几个生理学过程:首先,将根际周围金属离子活化,促进根部的吸收,金属离子进入根部细胞后由各种螯合物进行螯合解毒,同时在根部细胞中进行区室化;其次,大部分的重金属螯合复合物在木质部装载后通过转运蛋白运输至地上组织,最终在叶部细胞液泡中进行区室化存储。在此过程中,金属螯合物发挥了非常重要的作用:首先通过螯合作用对进入体内的重金属进行解毒,并随后以金属-螯合物复合体形式将重金属离子通过转运蛋白等途径从根部长距离运输至地上部分,随后将金属存储于叶片中。至今已知的植物体内的金属螯合剂包括有机酸、氨基酸、金属硫蛋白(Metallothionein)、尼克烟酰胺(Nicotianamine) 和植物络合素(Phytochelatins) 等。
1.1 金属硫蛋白 (MT)
金属硫蛋白(Metallothionein,MT) 是一种金属结合蛋白,最初在动物体内发现,通过研究发现它在植物重金属螯合解毒方面也发挥重要作用。最初遏蓝菜体内关于重金属螯合物相关分子生物学的研究便是起于对MT基因家族的研究。MT家族基因数量较多,约占植物总转录本的 3%[14],在遏蓝菜的700多个EST序列中,分别有MT基因家族同源基因Ⅰ型10个,Ⅱ型2个。TcMT3是遏蓝菜中最早被发现的 MT家族基因。虽然它是一个组成型表达基因,但在受到Cd胁迫诱导后能在根部特异增量表达,因此推测它可能也具有根部重金属特异诱导表达的特性。通过酵母功能互补试验发现,TcMT3转化子对各种重金属处理的反应有明显差异,对Cu和Cd处理的耐性增加,且前者优于后者,而对Zn的耐性却没有明显增强。以Cu敏感型酵母为转化受体,比较AtMT3与TcMT3基因的功能差异,发现TcMT3转化子对Cu的耐性好于AtMT3[15]。Roosens等对TcMT1和TcMT2也进行了比较研究,序列比对结果显示TcMT1与拟南芥AtMT1相比缺少了N-端的部分序列,同时与同家族其他MT1基因相比则缺失了多个保守的半胱氨酸残基;另外,重金属耐性试验结果表明,由于半胱氨酸残基的缺失造成了MT蛋白与Cd2+结合能力的下降,细胞内游离Cd2+浓度的增加造成细胞内的毒性增大,从而产生细胞的耐性降低的现象。在与AtMT1、AtMT2进行功能比较研究时发现,遏蓝菜MT基因的转录活性优于拟南芥AtMT1、AtMT2;但4个MT基因酵母转化子的Cu、Cd、Zn耐性均显著提高,其中AtMT2对Cd、Zn的耐性分别优于TcMT2和AtMT1转化子[16]。Hassinen等发现在拟南芥中过量表达TcMT2、TcMT3基因对转基因植物Cu、Cd、Zn的耐性以及 Zn、Cd的富集能力均无明显作用;因此推测MT蛋白过量表达后可能会影响植物在正常生理条件下对大量金属元素的正常利用而造成特殊的现象:在对照情况下,与野生型比较,转基因植株的根生长量降低;而在高浓度重金属处理下,其根生长量却没有发生降低。但是研究发现,在高浓度 Zn、Cd存在条件下,提高MT基因的表达能够维持植物体内Cu2+的稳态[11]。
1.2 尼克烟酰胺 (NA)
尼克烟酰胺(Nicotianamine,NA) 作为非蛋白型氨基酸,最初发现时认为可能与植物体内微量营养元素、重金属元素的运动相关[17]。NA合成酶 (NAS)最早在酵母中被发现,是NA合成途径中的关键酶。TcNAS1基因以单拷贝形式存在于遏蓝菜基因组中。经过 Ni处理 6 h后,只在遏蓝菜地上部分检测到TcNAS1表达,有趣的是根部却存在高浓度的NA,而在茎的木质部伤流中发现了NA-Ni的复合物;同时,TcNAS1转基因植株 Ni耐性以及地上部分 Ni富集量均明显提高。通过以上结果可以作出以下推测,植株在受到Ni处理后,首先TcNAS1在地上部分被诱导表达,并合成大量NA,然后NA被运输至根部与 Ni螯合,随后以 NA-Ni复合物形式通过转运蛋白在木质部导管等运输管道中向上运输至地上部分并储存,而NA和NA-Ni在体内的长距离运输过程中可能有一种特殊的转运蛋白参与[18]。
1.3 植物络合素 (PCs)
植物络合素 (Phytochelatins,PCs) 是由 PC合酶合成的一种能与多种金属元素如 Cd、Zn、Cu、Pb或者金属性元素 As结合的多肽,多个研究成果证明它在多种重金属超富集植物的重金属耐受和富集过程中发挥重要作用。起初研究人员认为,PCs在遏蓝菜重金属累积中的作用应与其他重金属富集植物类似;但是随后研究发现可能存在一定差异。有研究发现,在Cd处理条件下,两种不同金属累积能力遏蓝菜,根部以及叶片中的PCs含量无显著差异[19]。这一结果表明,遏蓝菜体内的 PC含量不受重金属诱导变化。已有研究证明PC合成途径中的关键酶γ-EC抑制后,可抑制PC的生物合成。为了探究PCs在遏蓝菜中的作用,Pence等将遏蓝菜Prayon(非超富集) 与 Gange (超富集) 中的γ-EC合成酶进行抑制,对两种生态型在重金属胁迫下的特征进行分析发现,Prayon 的Cd敏感性增加,而Gange对Cd的耐性未发生变化。从此结果可以得出,PC可能在 Prayon受到 Cd胁迫初期发挥解毒作用,而Gange生态型可能是因为具有特殊的重金属富集以及耐受机制而表现出在PC含量很低的情况下对Cd仍有较强的耐受能力;也有人提出Gange也可能存在一种不同于PC的低分子量硫醇作为Cd的螯合剂在耐受过程中发挥作用[20]。
2 重金属转运蛋白
转运蛋白不仅在重金属体内运输过程中发挥重要的作用,而且可转运微量元素和重金属同时也参与植物体内金属稳态的调控。已知金属离子转运蛋白家族有ZNT/ZTP (Znic transproter)、MTP (Metal regulated protein)、HMA (P-type ATPases)、YSL (Yellow strip like),Nramp (Natural resistance and macrophageprotein) 和IRT (Iorn regulated transporter) 等,少数基因已经在拟南芥中进行了功能鉴定。
2.1 ZNT/ ZTP (Zn transporter) 家族
TcZNT1是一个ZIP转运蛋白家族基因,最初由Pence等在遏蓝菜体内发现;该基因定位在质膜上,所表达蛋白能够介导细胞对 Zn、Cd的吸收。通过序列比对分析发现,TcZNT1与酵母ZRT1和拟南芥AtZIP4基因具有很高的同源性;有趣的是,虽然TcZNT1基因与AtZIP4基因在核苷酸和氨基酸序列的同源性很高,分别为90%和81%,但是发现2个基因的功能有明显差异[20]。Grotz等对TcZNT1进行的酵母功能互补实验分析,发现TcZNT1是一种Zn高亲和型、Cd低亲和型吸收转运蛋白;TcZNT1在缺陷型酵母 (zrt1/zrt2mutant) 中表达,转基因酵母在低浓度Zn条件下不能够生长,说明该基因所编码蛋白是吸收型Zn转运蛋白,而AtZIP4基因表达后虽然也不能互补zrt1/zrt2的缺陷特性,但是它具有互补ctr1Cu缺陷型酵母的功能[21]。细胞定位表达分析结果同样也证明这两个基因在功能上有差异。AtZIP4基因定位在转基因拟南芥中柱中,推测该基因的功能主要是在根部对从土壤中吸收的金属离子进行运输[22]。Kupper等利用定量原位杂交技术,发现TcZNT1基因在叶片的叶肉细胞、维管束鞘和保卫细胞中表达,而不在叶片的表皮细胞,进一步说明了在遏蓝菜体内TcZNT1只在维持植物对Zn的正常营养过程中发挥作用,可能并不参与金属富集运输过程[23]。
2.2 MTP (Metal regulated protein) 家族
MTP是从Ni超富集植物Thlaspi goesenginse中克隆的一个CDF家族阳离子转运蛋白编码基因。该基因与拟南芥的ZAT1基因同源,是遏蓝菜中克隆获得的第2类转运蛋白基因。MTP1与ZTP1在氨基酸序列上的相似性很高;但是,TgMTP1定位在质膜上,而TcZTP1定位于液泡;TgMTP1功能与AtZAT1相同主要是将各部位多余的 Zn运至液泡[24-26]。Persans等发现,TcMTP1基因在遏蓝菜基因组中以单拷贝形式存在,却以TgMTP1t1和TgMTP1t2两个转录本高效表达发挥作用。TgMTP1t1与Cd、Co、Zn的耐受相关,而TgMTP1t2只与 Ni耐受有关[27]。
2.3 HMA (P-type ATPases) 家族
HMA是一种 P-型ATP酶转运蛋白家族基因。主要是重金属离子进行长距离运输前,在木质部装载时发挥作用,依靠 P-型 ATP酶的活性与金属离子大量结合装载,然后向地上部分进行运输,该类家族可以通过水解 ATP使物质通过细胞膜运输。至今在遏蓝菜中已经发现多个该家族成员。TcHMA4基因是通过酵母功能互补技术从遏蓝菜文库中筛选出来[28-29],它属于 P-型 ATPase超级家族中的P1B亚家族。两个研究小组分别对TcHMA基因全长以及C端部分序列进行酵母功能分析,发现在重金属胁迫下该基因全长序列与C端部分序列的功能差异不明显,氨基酸序列分析显示C端含有组氨酸以及半胱氨酸序列,而这些序列主要负责结合Cd2+,因此C端序列在该蛋白与Cd2+结合过程中发挥主要作用;同时TcHMA4基因仅对 Cd累积以及运输方面发挥作用,对于其他金属如Zn、Co、Pb、Ni则不具有以上功能。在具有不同金属富集能力的3种遏蓝菜生态型中均能检测到TcHMA4基因表达,虽然 3种生态型在重金属耐性以及富集能力上差异较大,但TcHMA4基因在3种生态型中表达量没有明显差异,并且该基因均在各自植物体内重金属运输富集过程中发挥重要作用[28]。Papoyan等发现,TcHMA4能够降低转基因植物对Cu、Pb、Zn的累积;TcHMA4基因在受到重金属胁迫后主要在根部被诱导表达,因此推测TcHMA4可能主要通过调节金属和其他微量元素从根部木质部薄壁细胞外排至木质部导管来发挥重金属超富集作用,而不直接参与重金属耐受过程[29]。
2.4 YSL (Yellow strip like) 家族
YSL(Yellow strip like) 转运蛋白家族基因,最早发现于玉米根部,前期研究认为YSL是植物体内的一种 Fe2+运输载体;随着家族其他成员被陆续发现,以及部分功能研究结果出现后,人们逐渐认为该基因家族可能与 NA-金属复合物的运输相关[30]。目前发现遏蓝菜中有已发现3个YSL转运蛋白家族成员,根据与拟南芥YSL基因的序列同源性比较,分别命名为TcYSL3、TcYSL5和TcYSL7[31]。这3个基因在遏蓝菜体内的表达量均高于同源基因在拟南芥中表达水平;其中,TcYSL3和TcYSL7通常是主要在根部中柱中表达,可能与木质部运输相关;而酵母功能分析结果发现 TcYSL3具有将 Ni-NA和Fe-NA复合物运输进入酵母的能力,基于以上的研究结果,由此作者认为TcYSL3可能参与了遏蓝菜的Ni转运的长距离运输[31]。
2.5 NRAMP (Natural resistance associated macrophage protein) 家族
NRAMP (Natural resistance associated macrophage protein),由于此家族第一个成员发现时造成巨噬细胞特异蛋白变异,从而增加了对细胞内的细菌病原菌的敏感性而得名[32]。经过后续的研究,人们发现该家族基因在生物体内的金属离子的转运发挥作用。近几年,NRAMP作为一种Fe相关转运蛋白被广泛研究。本实验室前期从遏蓝菜cDNA文库中获得一个NRAMP家族基因[33],Wei等通过序列分析发现该基因包含11个跨膜域,并含有保守序列 (GQSSTITGTYAGQFIMGGFLN),通过与其他物种该家族基因的进化分析比较发现,该基因与拟南芥AtNRAMP3进化距离最近,因此将该基因命名为TcNRAMP3。酵母功能互补实验发现TcNRAMP3转化子在10 μmol/L Cd处理条件下生长受抑制,而在800 μmol/L Cd条件下则正常生长,并且好于对照。而重金属累积能力分析发现,对照空载体所累积的Ni含量是TcNRAMP3转化子的8.5倍,在Cd处理下的TcNRAMP3/4转化子生长受到抑制。以上的结果初步表明TcNRAMP3/4可将Cd2+转运至酵母细胞内,对Ni则相反,TcNRAMP3能将Ni外排至酵母细胞外而提高转化子耐性 (图1A)。转基因烟草亚细胞定位分析发现TcNRAMP3/4基因均定位在质膜上(图 1B),烟草根伸长分析结果显示,TcNRAMP3过表达的转基因烟草在Cd、Ni处理下,均与对照无显著差异。推测可能是由于植物体内其他二价阳离子参与了竞争,导致TcNRAMP3不能对Ni进行有效运输[12]。Oomen等对TcNRAMP3和TcNRAMP4基因进行了研究,通过表达分析、激光共聚焦照相和酵母及拟南芥转化功能分析发现,TcNRAMP3和TcNRAMP4的表达量高于拟南芥中同源基因表达水平,转基因酵母功能与拟南芥同源基因酵母转化子的功能相似。NRAMP3能转运 Fe、Mn、Cd,不能转运Zn,NRAMP4则能运输4种金属。另外,荧光共聚焦分析发现这两个基因均定位在液泡膜上;TcNRAMP3和TcNRAMP4基因在拟南芥Atnramp3和Atnramp4基因突变体中过表达后,TcNRAMP3/4基因的表达能互补对AtNRAMP3/4基因缺陷造成对Zn、Cd处理的超敏反应这一功能缺陷,使转基因表型植株与野生型相当。以上研究结果表明,TcNRAMP3/4与拟南芥中的同源基因可能只是在表达水平或者表达模式上有一定的差异,而在蛋白功能上没有区别[13]。
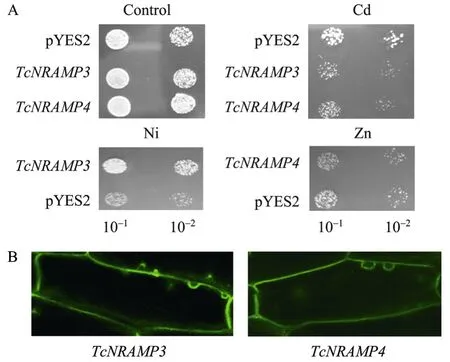
图1 TcNRAMP3/4酵母功能分析 (A) 和转基因烟草根部TcNRAMP3/4亚细胞定位分析 (B)[12]Fig.1 Fuctional analysis of TcNRAMP3/4 in yeast under Cd Zn Ni (A) and subcellular localization of TcNRAMP3/4 in root of transgenic tobacco (B).
2.6 IRT (Iorn regulated transporter) 家族
IRT是一种 Fe2+转运蛋白,同时也是一种 Cd2+转运蛋白[34]。IRT过表达后能够造成植物的缺铁反应[35]。Lombi发现 Gange和 Prayon生态型在缺铁条件下都能增加对Cd的累积,且前者对Cd的累积能力远大于后者,而造成这一现象的原因正是TcIRT1基因[36];两种生态型 Gange和 Prayon都含有IRT1基因,但后者所含IRT1基因与前者相比在基因组序列中缺失了部分序列。但是这两种IRT1基因对于Cd的运输能力都不及AtIRT1基因。Plaza 等通过对两种遏蓝菜生态型根部 Cd吸收进行比较分析后认为,TcIRT不是一种存在于根部的高亲和能力的Cd转运蛋白[37]。
3 展望
遏蓝菜有多种生态型分布在世界各地,生态型之间的重金属富集与耐受能力有很大差异,对遏蓝菜不同生态型的重金属耐性以及运输比较研究也对了解金属在植物体内运输模式有很大帮助。前期的相关研究已经建立了以遏蓝菜为对象的多种研究、转化体系,如农杆菌转化体系[38]、悬浮细胞体系[39]等。这些成果不仅为进一步研究遏蓝菜植株体内重金属相关基因的功能提供了技术支持,也为改善遏蓝菜植株的修复特性手段提供了新的支撑点。
遏蓝菜是一种不可多得的重金属超富集研究的模式植物,对它的研究不仅有助于了解植物重金属超累积机理,同时帮助了解金属微量元素的稳态在植物金属毒害或者营养中的功能。前期的研究结果已经揭示了遏蓝菜重金属超富集部分机制,如人们认为遏蓝菜进行富集主要通过刺激酸化根际的金属离子通过根部细胞质膜进入植物体,利用根部细胞的液泡对金属进行区室化,并且增加金属在木质部的装载并向上运输至地上部分,从而刺激金属进入叶片细胞质膜最终在液泡中进行区室化 (图 2)。
重金属在植物体内的螯合和转运的特点是超富集植物区别于其他普通植物的主要原因。多种螯合剂如植物络合素、尼克烟酰胺和金属硫蛋白,已经证明在遏蓝菜体内与重金属螯合并协助重金属在植物体内运输过程中发挥重要作用,同时研究者认为在遏蓝菜体内可能存在着一种未被检测的低分子量物质,参与了重金属的螯合并作为载体参与从地下向地上部分的长距离运输。
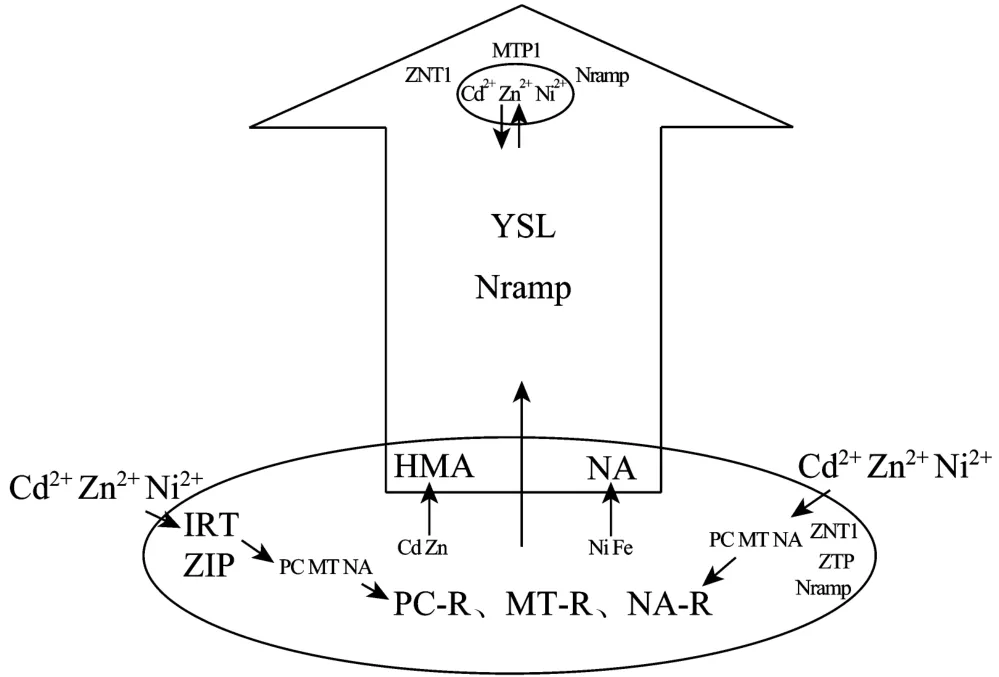
图2 遏蓝菜重金属富集与耐受分子机制Fig.2 Mechanism of heavy metal accumulation and tolerance ofThlaspi caerulescens.
多种金属转运蛋白参与了金属进入细胞或者液泡膜的过程,有些则可携带金属通过木质部组织转运至叶片。虽然已有研究结果能够在一定程度上阐明遏蓝菜重金属富集的机理,但是作为重金属吸收螯合以及转运这一整套生理机制,需要整体的协同考虑。所以,遏蓝菜作为重金属超富集模式植物,还需要在前面的各项研究工作基础上深入研究。作为相关研究工作者可以从以下两点入手:首先,区分遏蓝菜体内的金属螯合与其他植物的差异,探索遏蓝菜是否有自己独特的金属螯合机制;另外,重金属在植物体内的转移、运输是植物耐受和超富集的关键,遏蓝菜体内的转运蛋白与所富集金属运输之间默契的协同作用也值得今后更深入研究。
REFERENCES
[1] Ghosh M, Singh SP. A comparative study of cadmium phytoextraction by accumulator and weed species.Environ Pollut, 2005, 133(2): 365−371.
[2] Tandy S, Schulin R, Nowack B. The influence of EDDS on the uptake of heavy metals in hydroponically grown sunflowers.Chemosphere, 2006, 62(9): 1454−1463.
[3] Baker AJM, Brooks RR. Terrestrial higher plants which hyperaccumulate metallic elements – a review of their distribution, ecology and phytochemistry.Biorecovery,1989, 1(2): 81−126.
[4] Bert V, Meerts P, Saumitou-Laprade P,et al. Genetic basis of Cd tolerance and hyperaccumulation inArabidopsis halleri.Plant Soil, 2003, 249(1): 9−18.
[5] Sachs J. Handbuch der Experimental-Physiologie der Pflanzen. Leipzig, Germany: Wilhelm Engelmann Verlag,1865: 153−154.
[6] Brooks RR, Lee J, Reeves RD,et al. Detection of nickeliferous rocks by analysis of herbarium specimens of indicator plants.J Geochem Explor, 1977, 7(1): 49−57.
[7] Brown SL, Chaney RL, Angle JS,et al. Zinc and cadmium uptake by hyperaccumulatorThlaspi caerulescensgrown in nutrient solution.Soil Sci Soc AMJ, 1995, 59(1):125−133.
[8] Lombi E, Zhao FJ, Dunham SJ,et al. Cadmium accumulation in populations ofThlaspi caerulescensandThlaspi goesingense.New Phytol, 2000, 145(1): 11−20.
[9] Schat H, Llugany M, Bernhard R. Metal-specific patterns of tolerance, uptake, and transport of heavy metals in hyperaccumulating and non- hyperaccumulating metallophytes//Terry N, Banuelos G, eds. Phytoremediation of Contaminated Soils and Water. Boca Raton, FL, USA:CRC Press LLC, 2000, 1(1): 171−188.
[10] Vert G, Grotz N, Dedaldechamp F,et al. IRT1, andArabidopsistransporter essential for iron uptake from the soil and for plant growth.Plant Cell, 2002, 14(6):1223−1233.
[11] Hassinen VH, Tuomainen M. Metallothioneins 2 and 3 contribute to the metal-adapted phenotype but are not directly linked to Zn accumulation in the metal hyperaccumulator,Thlaspi caerulescens.J Exp Bot, 2009,60(1): 187−196.
[12] Wei W, Chai TY. TheThlaspi caerulescensNramphomologueTcNramp3 is capable of divalent cation transport.Mol Biotechnol, 2009, 41(1): 15−21.
[13] Oomen RJ, Wu J. Functional characterization ofNramp3 andNramp4 from the metal hyperaccumulatorThlaspi caerulescens.New Phytol,2009, 181(3): 637−650.
[14] Cobbett C, Goldsbrough P. Phytochelatins and metallothioneins: roles in heavy metal detoxification and homeostasis.Annu Rev Plant Biol, 2002, 53(1): 159−182.
[15] Roosens NH, Bernard C, Leplae R,et al. Adaptive evolution of metallothionein 3 in the Cd/Zn hyperaccumulatorThlaspi caerulescens.Z Naturforsch C, 2004, 60(1): 224−228.
[16] Roosens NH, Leplae R, Bernard C,et al. Variations in plant metallothioneins: the heavy metal hyperaccumulatorThlaspi caerulescensas a case study.Planta, 2005, 222(4):716−729.
[17] Stephan UW, Scholz G. Nicotianamine: mediator of transport of iron and heavy metals in the phloem?Physiol Plantarum, 1993, 88(3): 522−529.
[18] Mari S, Gendre D, Pianelli K,et al. Root-to-shoot longdistance circulation of nicotianamine and nicotianaminenickel chelates in the metal hyperaccumulatorThlaspi caerulescens.J Exp Bot, 2006, 57(15): 4111−4122.
[19] Ebbs S, Lau I, Ahner B,et al. Phytochelation synthesis is not responsible for the Cd tolerance in the Zn/Cd hyperaccumulatorThlaspi caerulescens(J. & C. Presl).Planta, 2002, 214(4): 635−640.
[20] Pence NS, Larsen PB, Ebbs SD,et al. The molecular basis for heavy metal hyperaccumulation in the Zn/Cd hyperaccumulatorThlaspi caerulescens.Proc Natl AcadSci USA, 2000, 97(9): 4956−4960.
[21] Grotz N, Fox T, Connolly E,et al. Identification of a family of zinc transporter genes fromArabidopsisthat respond to zinc deficiency.Proc Natl Acad Sci USA, 1998,95(12): 7220−7224.
[22] Wintz H, Fox T, Wu YY,et al. Expression profiles ofArabidopsis thalianain mineral deficiencies reveal novel transporters involved in metal homeostasis.J Biol Chem,2003, 278(48): 47644−47653.
[23] Küpper H, Sieb LO, Sivaguru M,et al. A method for cellular localization of gene expression via quantitative in situ hybridization in plants.Plant J, 2007, 50(1):159−175.
[24] Van der, Zaal BJ, Neuteboom LW,et al. Overexpression of a novelArabidopsisgene related to putative zinc-transporter genes from animals can lead to enhanced zinc resistance and accumulation.Plant Physiol, 1999,119(3): 1047−1055.
[25] Assuncão AGL, Martins PD,et al. Elevated expression of metal transporter genes in three accessions of the metal hyperaccumulatorThlaspi caerulescens.Plant Cell Environ, 2001, 24(2): 217−226.
[26] Mäser P, Thomine S, Schroeder JI,et al. Phylogenetic relationships within cation transporter families ofArabidopsis.Plant Physiol, 2001, 126(4): 1646−1667.
[27] Persans MW, Nieman K, Salt DE. Functional activity and role of cation-efflux family members in Ni hyperaccumulation inThlaspi goesingense.Proc Natl Acad Sci USA, 2001,17(98): 9995−10000.
[28] Bernard C, Roosens N, Czernic P,et al. A novel CPx-ATPase from the cadmium hyperaccumulatorThlaspi caerulescens.FEBS Lett, 2004, 569(1): 140−148.
[29] Papoyan A, Kochian LV. Identification ofThlaspi caerulescensgenes that may be involved in heavy metal hyperaccumulation and tolerance: characterization of a novel heavy metal transporting ATPase.Plant Physiol,2004, 136(3): 3814−3823.
[30] Curie C, Panaviene Z, Loulergue C,et al. Maize yellow strpie 1 encodes a membrane protein directly involved in Fe(III) uptake.Nature, 2001, 409(1): 346−349.
[31] Gendre D, Czernic P, Conejero G,et al.TcYSL3, a member of the YSL gene family from the hyper-accumulatorThlaspi caerulescens, encodes a noctianamine-Ni/Fe transporter.Plant J, 2007, 49(1): 1−15.
[32] Vidal S, Malo D, Vogan K,et al. Natural resistance to infection with intracellular parasites: isolation of a candidate for Bcg.Cell, 1993, 73(1): 469−486.
[33] Lang ML, Zhang YX, Chai TY. Identification of genesup-regulated in response to Cd exposure inBrassica junceaL..Gene, 2005, 363(19): 151−158.
[34] Cohen CK, Fox TC, Garvin DF,et al. The role of irondeficiency stress responses in stimulating heavymetal transport in plants.Plant Physiol, 1998, 116(3):1063−1072.
[35] Connolly EL, Fett JP, Guerinot ML. Expression of the IRT1 metal transporter is controlled by metals at the levels of transcript and protein accumulation.Plant Cell, 2002,14(6): 1347−1357.
[36] Lombi E, Tearall KL. Influence of iron status on cadmium and zinc uptake by different ecotypes of the hyperaccumulatorThlaspi caerulescens.Plant Physiol,2002, 128(4): 1359−1367.
[37] Plaza S, Tearall KL, Zhao FJ,et al. Expression and functional analysis of metal transporter genes in two contrasting ecotypes of the hyperaccumulatorThlaspi caerulescens.J Exp Bot, 2007, 58(7): 1717−1728.
[38] Guan ZQ, Chai TY. Gene manipulation of a heavy metal hyperaccumulator speciesThlaspi caerulescensL. viaAgrobacterium-mediated transformation.Mol Biotechnol,2008, 40(1): 77−86.
[39] Klein MA, Sekimoto H. Investigation of heavy metal hyperaccumulation at the cellular level: development and characterization ofThlaspi caerulescenssuspension cell lines.Plant Physiol, 2008, 147(4): 2006−2016.
Heavy metal absorption, transportation and accumulation mechanisms in hyperaccumulatorThlaspi caerulescens
Geyu Liu, Tuanyao Chai, and Tao Sun
College of Life Science,Graduate Universityof Chinese Academy of Sciences,Beijing100049,China
Received:November 17, 2009;Accepted:March 8, 2010
Supported by:National High Technology Research and Development Program of China (863 Program) (No. 2006AA10Z407), Genetically Modified Organisms Breeding Major Projects (No. 2009ZX08009-130B).
Corresponding author:Tuanyao Chai. Tel/Fax: +86-10-88256343; E-mail: tychai@gucas.ac.cn
国家高技术研究发展计划 (863计划) (No. 2006AA10Z407),转基因生物新品种培育科技重大专项 (No. 2009ZX08009-130B) 资助。
