聚球藻7942混养培养中碳代谢与能量利用
2010-10-11颜日明张志斌曾庆桂朱笃储炬
颜日明,张志斌,曾庆桂,朱笃,3,储炬
1 华东理工大学生物工程学院 生物反应器工程国家重点实验室,上海 200237
2 江西师范大学生命科学学院 江西省亚热带植物保护与利用重点实验室,南昌 330022
3 宜春学院,宜春 336000
代谢工程
聚球藻7942混养培养中碳代谢与能量利用
颜日明1,2,张志斌2,曾庆桂2,朱笃2,3,储炬1
1 华东理工大学生物工程学院 生物反应器工程国家重点实验室,上海 200237
2 江西师范大学生命科学学院 江西省亚热带植物保护与利用重点实验室,南昌 330022
3 宜春学院,宜春 336000
为了考察聚球藻 7942在混养条件下的能量利用效率,分别以葡萄糖和乙酸为碳源开展了聚球藻7942的混养培养研究,并在此基础上利用代谢通量分析方法对聚球藻7942混养条件下的碳代谢和能量利用进行了探讨。结果表明:葡萄糖和乙酸均能促进藻细胞生长,且乙酸促进藻细胞生长的作用更为明显;葡萄糖利用可明显增加藻细胞糖酵解途径中碳代谢流量,而乙酸利用则导致糖酵解途径中碳代谢流量减小,两种有机碳源均增加了柠檬酸循环中碳代谢流量;有机碳源导致藻细胞光化学效率下降,而葡萄糖较之乙酸降低藻细胞光化学效率更为明显。虽然混养条件下光能的贡献率要小于光自养,但基于能量的细胞得率和能量转换率均高于光自养,光自养和以葡萄糖、乙酸为碳源的混养中基于ATP生成的能量转换效率分别为6.81%、7.43%和8.77%。
聚球藻7942,混养培养,代谢通量分析,碳代谢,能量利用
Abstract:To investigate the energy utilization efficiency ofSynechococcussp. PCC7942 under mixotrophic conditions, we studied its growth characteristics in mixotrophic cultures with glucose and acetic acid respectively and discussed the carbon metabolism and energy utilization based on metabolic flux analysis. Results showed that both glucose and acetate could better enhance the growth ofSynechococcussp. PCC7942, and the latter was more effective. The metabolic flux through glycolytic pathway in mixotrophic cultures was stimulated by glucose whereas depressed by acetate, while the flux through the tricarboxylic acid cycle increased in both cases. Under mixotrophic conditions, glucose makes more significant impact on the diminishment of photochemical efficiency ofSynechococcussp. PCC7942. Although the contribution of light energy was smaller, the cell yields based on total energy in mixotrophic cultures were higher comparing with photoautotrophic culture. The energy conversion efficiencies based on ATP synthesis in photoautotrophic culture, mixotrophic cultures with glucose and with acetate wereevaluated to be 6.81%, 7.43% and 8.77%, respectively.
Keywords:Synechococcussp. PCC7942, mixotrophic cultivation, metabolic flux analysis, carbon metabolism, energetic utilization
聚球藻 (Synechococcus,过去亦称为Anacystis nidulans) 是分布最广的单细胞原核蓝藻类群之一,它们能利用光、CO2及其他无机物来生长,是全球碳循环的主要参与者和初级生产力的主要贡献者之一[1]。聚球藻在众多理论研究领域,如无机碳源吸收[2]、氮源调节[3]、铁缺乏应激响应[4],环境适应机制[5]和生物钟研究[6]等方面是一个很好的研究材料,同时也是一个良好的外源基因载体,迄今多种具有较高应用价值的药用蛋白基因被导入蓝藻,并获得了表达[7]。聚球藻曾经被认为是营专性光自养的单细胞蓝藻[8],因此绝大多数文献都集中在光自养培养研究,但也有一些研究表明很多营专性光自养蓝藻能同化有机碳源[9-12]。Takahashi等发现在光自养与氮饥饿的条件下,往培养基中添加前体物质乙酸钠能有效地提高聚球藻 7942 (Synechococcussp.PCC 7942) 藻细胞中PHB的含量[13]。汪晶[14]和康瑞娟[15]等对聚球藻7002 (Synechococcussp. PCC 7002)进行了混养培养,发现混养条件下菌体的生长和光合速率与光自养相比均有所提高。这些研究均表明聚球藻具备混养生长的能力。迄今,虽然已有关于聚球藻7942同化有机碳源的研究,但有关其混养培养的研究尚未见报道。同时,有关聚球藻研究都是建立在宏观分析的基础上,而对于聚球藻在混养条件下有机碳源促进细胞生长和产物合成的机理没有涉及,特别是对于其基于代谢流尺度的微观代谢特征还没有进行过相关研究。近年来,代谢通量分析作为一个用来研究微藻的碳代谢和能量利用特征的重要方法而得到广泛应用,我们曾应用该方法对聚球藻 7942的光自养培养不同光强条件下的碳代谢和能量代谢进行过探讨[16],但迄今有关其在混养条件下的代谢特征以及能量利用效率方面的研究未见报道。本文以聚球藻7942为研究对象,研究了葡萄糖和乙酸对聚球藻7942生长的影响,在此基础上应用代谢通量分析方法,以光自养为参照,着重研究其在混养条件下的碳代谢和能量代谢特征,并对其在不同培养条件下的能量利用情况进行了分析。
1 材料与方法
1.1 藻种与培养基
聚球藻7942 (Synechococcussp. PCC7942) 由中国科学院水生所藻种库提供。实验培养基采用BG-11培养基[17]。混养培养时在此基础上分别加入浓度为4.0 g/L葡萄糖或2.0 g/L的乙酸,灭菌后用NaOH调节至8.0备用。
1.2 培养方法
藻细胞在植物细胞反应器 (ALG-XL型,上海国强生化工程装备有限公司) 中进行,工作体积3 L,入射光强为 51.2 μmol/(m2⋅s),培养温度为 28℃,空气流量为0.5 vvm,pH控制在10.0以下。
1.3 培养方法
藻细胞测定:藻液用0.45 μm的醋酸纤维滤膜过滤,将过滤后的藻体在 105℃的烘箱恒温烘干至恒重,称重3次,取平均值。
光强采用光合有效辐射计 (北京师范大学光电仪器厂) 测定。
光合作用效率 (ΦPSII) 采用水体叶绿素荧光仪(AP100,捷克) 测定。
乙酸浓度采用气相色谱法测定[18]。
葡萄糖浓度采用葡萄糖测定试剂盒 (上海达豪生物科技有限公司) 测定。
叶绿素和胡萝卜素含量采用比色法测定[19]。
碳水化合物含量采用硫酸-蒽酮法[20]。
总脂含量采用氯仿/甲醇抽提法[21]。
蛋白质含量测定采用考马斯亮蓝法[22]。
藻液中碳酸盐测定采用盐酸滴定法[23]。
藻细胞碳 (C)、氧 (O)、氮 (N) 和氢 (H) 元素含量用Elementar Vario EL III型元素分析仪 (德国)进行测定。
尾气CO2和O2浓度分别采用PA200-GXH型红外线气体分析器 PA200-CJ型磁机械式氧分析器(重庆川仪分析仪器有限公司) 在线测定。
2 代谢网络构建及计算方法
2.1 代谢网络构建
聚球藻 7942光自养初级碳代谢网络在我们前期的工作中已经建立[16],主要包括卡尔文 (Calvin)循环、糖酵解 (EMP) 途径、磷酸己糖 (HMP) 途径和三羧酸 (TCA) 循环。在以葡萄糖为碳源时,葡萄糖直接通过糖酵解途径生成 6-磷酸葡萄糖进入代谢途径。而在以乙酸为有机碳源的混养条件下,乙酸进入藻细胞后首先在 ATP的参与下由乙酸激酶(Acetate kinase,AK) 催化生成乙酰磷酸,然后乙酰磷酸再在磷酸转乙酰酶 (Phosphotransacetylase,PTA) 的催化下生成乙酰辅酶A,进入三羧酸循环进行代谢[11]。为了降低代谢网络的复杂性和减少代谢流量平衡方程,本研究假定聚球藻7942没有胞外产物合成。图1为聚球藻7942混养条件下的主要碳代谢途径简图,相应反应方程式见文后附录II。
2.2 碳代谢流计算
代谢流分析的理论基础是物料平衡,代谢物之间的转变遵循化学反应计量关系。
以ri表示代谢反应网络中第i种代谢物的积累速率,则有

式 (1) 中aij和vj分别表示第i种代谢物在第j个反应中的化学计量系数和反应流量。整个代谢网络中的所有代谢物可以组成如下线性方程组

式 (2) 中A为m×n的化学计量系数矩阵,r和v分别为m维代谢物累积速率向量和n维流量向量。上述反应网络中包含19个方程和33个代谢流量,其中包括14个已知流量和19个未知流量。根据已知流量系数矩阵,利用Matlab软件可以计算出所有未知流量。
2.3 能量代谢计算
藻细胞能吸收光能用于细胞生长和产物合成,其比光能吸收速率Eab可用下式表示[24-25]:


图1 聚球藻7942混养代谢网络简图Fig.1 A schematic view of key pathways of central metabolism ofSynechococcussp. PCC7942 under photoautotrophic and mixotrophic conditions.
式 (3) 中Eab为比光能吸收速率,I0为入射光强,R为反应器半径,X为细胞浓度,Ka为吸光系数。
藻细胞吸收的光能除了一部分进行光化学反应外,还有相当多的能量是以产生荧光或者热耗散的形式消耗掉[26]。因此,在计算光能的利用和实际转换效率时应该以用于光化学的光能为基础。光合系统II的光化学效率ΦPSII正好表示为用于光化学的光能占总吸收的光能比例[27],因此实际用于光合作用的光能EP由式 (4) 计算

在混养条件下,藻细胞还可以利用有机碳源的化学能,总的能量供给ET可由下式表示:


藻细胞吸收光能和化学能后用于细胞的合成,因此基于总能量的细胞得率YX/E和基于ATP生成的细胞得率YATP分别由式 (6) 和式 (7) 获得。

上式中μ为藻细胞比生长速率,rATP为ATP的比生成速率。
基于ATP生成的能量转换效率为


3 结果与分析
3.1 聚球藻7942的混养培养
聚球藻7942除了光自养外,还能利用有机碳源进行混养培养。为了考察葡萄糖和乙酸浓度对藻细胞生长的影响,分别在 BG11培养基中加入了不同浓度的葡萄糖和乙酸进行混养培养,10 d后对菌体浓度进行测量。结果发现添加葡萄糖和乙酸的浓度分别为4.0 g/L和2.0 g/L时的藻细胞浓度最大,分别达到了0.79 g/L和0.90 g/L,比光自养条件下分别提高了 26%和 40% (图 2)。这表明,聚球藻 7942能在低浓度的有机碳源存在下进行混养培养,并且混养培养更有利于藻细胞的生长。
为了进一步比较不同营养类型对聚球藻生长的影响,本文比较了光自养、葡萄糖混养 (添加4.0 g/L的葡萄糖)、乙酸混养 (添加2.0 g/L的乙酸) 和异养(添加4.0 g/L的葡萄糖或2.0 g/L的乙酸) 条件下聚球藻7942的生长情况。从图3可以看到,在混养条件下,藻细胞的生长速率明显要高于光自养,在培养到第11天,葡萄糖混养和乙酸混养条件下的藻细胞浓度分别达到0.83 g/L和0.96 g/L,比光自养的0.65 g/L分别增加了 28%和 48%,这进一步说明了聚球藻7942在混养条件下细胞生长要优于光自养。同时,从图3也可以看出,聚球藻7942在异养条件下没有生长,并且在第 6天后几乎全部死亡,说明其不能进行异养培养。

图2 葡萄糖和乙酸浓度对聚球藻 7942混养培养生长的影响Fig.2 Effect of glucose and acetate concentration on the growth ofSynechococcussp. PCC 7942 in mixotrophic culture.

图3 聚球藻7942在不同营养方式下的生长比较Fig.3 Comparison ofSynechococcussp. PCC 7942 growth under photoautotrophic (◇), mixotrophic (Glucose □; Acetate ○)and heterotrophic (Glucose ■; Acetate ●) conditions respectively.
为了更好地研究混养条件下的碳代谢,本文考察了有机碳源对藻细胞组成成分的影响。从图4A可以看到,与光自养相比,在葡萄糖混养中藻细胞的碳水化合物的含量显著提高 (P<0.05),由光自养的20.6%提高到 22.5%。而在乙酸混养中,藻细胞的脂类含量也有一定的提高,由光自养的 12.9%提高到 13.8%。这说明葡萄糖和乙酸在藻细胞的碳水化合物和脂类合成中起重要作用,也表明葡萄糖和乙酸可以作为前体物质直接参与细胞物质的合成。同时,对细胞的主要色素叶绿素和类胡萝卜素含量的研究也发现,异养条件下,叶绿素的含量显著降低,而类胡萝卜素的含量则变化不大 (图4B)。作为光合作用最重要的色素,叶绿素含量的下降一方面可能是由于有机碳源的抑制作用[29];另一方面,在混养条件下,藻细胞生长的能量除了来自光源外,还能同化有机碳源所产生的能量,因此藻细胞可能通过降低细胞光合色素的含量来降低对光的依赖,同时还在一定程度上减少了光抑制[30]。

图 4 自养和混养条件下聚球藻 7942菌体主要成分 (A)及色素 (B) 比较Fig.4 Main compositions ofSynechococcussp. PCC 7942 cells under photoautotrophic and mixotrophic conditions (A)and changes of pigments contents inSynechococcussp. PCC 7942 cells under photoautotrophic (△) and mixotrophic(Glucose ○; Acetate □) conditions respectively (B).
3.2 聚球藻 7942光自养和混养条件下碳代谢流分布
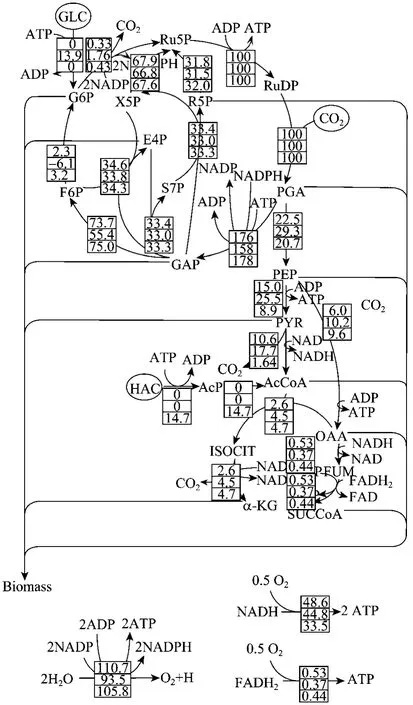
图5 聚球藻7942在光自养和混养条件下的代谢流分布(120 h)Fig.5 Metabolic flux distribution ofSynechococcussp.PCC7942 under photoautotrophic and mixotrophic conditions at culture time of 120 h. The flux values are normalized by the flux for CO2uptake, and the upside, middle and undersides numerals are the flux values calculated from photoautotrophic culture, mixotrophic culture with glucose and mixotrophic culture with acetate respectively.
以 CO2的比消耗速率为 100,图 5给出了聚球藻7942分别在光自养和混养条件下120 h时的碳代谢流量分布。聚球藻7942光自养条件下的代谢特征已有探讨[16],这里着重讨论与光自养相比的混养条件下的碳代谢特点。从图 5可以看到,在以葡萄糖为碳源的混养中,在糖酵解途径和Calvin循环的分支点3-磷酸甘油醛 (G3P) 处,通向糖酵解的碳代谢流量明显高于光自养和乙酸混养。这是由于葡萄糖的加入,能直接促进糖酵解途径的进行,并进一步使得柠檬酸循环也得到进一步加强。由于葡萄糖(GLC) 直接降解为6-磷酸葡萄糖,因此使得充足的6-磷酸葡萄糖供给能对于细胞内碳代谢产生重要影响:1) 能使得在光自养条件下由6-磷酸果糖 (F6P)生成6-磷酸葡萄糖 (G6P) 的途径发生流量逆转;2)由 6-磷酸葡萄糖 (G6P) 再生 5-磷酸核酮糖 (Ru5P)的途径流量有一定的加强;3) 直接作为菌体成分中糖类物质合成的前体来源;4) 直接产生更多的ATP用于细胞合成。而在以乙酸为碳源的混养中,乙酸首先被代谢生成乙酰辅酶 A (AcCoA)。由于不存在乙醛酸循环,因此乙酸的代谢对于细胞物质的合成起重要作用。一方面,由于乙酰辅酶A的大量存在,使得柠檬酸循环得到加强,生成大量的 α-酮戊二酸(α-KG) 用于细胞物质的合成;另一方面,通过反馈调节降低糖酵解途径中由磷酸烯醇式丙酮酸 (PEP)经丙酮酸 (PYR) 生成乙酰辅酶 A的代谢流量,使得累积更多的磷酸烯醇式丙酮酸和丙酮酸用于各种细胞组成物质的合成。更重要的是,乙酰辅酶A是合成脂肪酸的前体物质,因此它的积累可以大大促进细胞脂类物质的合成,这与前述在乙酸混养条件下细胞脂类物质含量增加一致。另外,我们也注意到,由于代谢流量是以 CO2固定流量为基础,因此不管是在光自养还是混养条件下,Calvin循环的相对流量保持不变,这进一步说明了 CO2的固定和Calvin循环是紧密关联的。
3.3 能量代谢分析
基于上述代谢流分布结果,我们可以获得以ATP为代表的3种培养条件下的能量产生和消耗速率 (表1)。从表1可以看到,在混养的条件下,虽然ATP仍主要来自光合磷酸化,约占总产生量的60%,但远低于在光自养条件下87%的水平。这表明有机碳源在混养过程中确实提供了一部分能量。此外,由于乙酸在代谢网络中的作用主要是提供细胞合成前体,很少提供能量,因此依赖光合磷酸化的比例要比葡萄糖的高。同时还可以看到,在混养条件下,糖酵解途径或柠檬酸循环的代谢流量比光自养明显增加,导致氧化磷酸化途径得到加强,从而使得在混养条件下氧化磷酸化所产生的ATP量要比光自养的高。在能量消耗方面,Calvin循环依然是主要的ATP消耗陷阱。在3种培养条件下,Calvin循环消耗的ATP占总消耗的ATP比例分别为81.5%、78.7%和79.5%。与光自养不同,在混养条件下的ATP的消耗除了Calvin循环、细胞合成和细胞维持等方面的ATP消耗外,还包括有机碳源基质吸收进入碳循环所需的ATP消耗。从表1的数据来看,有机碳源的吸收所需的 ATP约占总消耗的 4.2%,远远低于Calvin循环固定CO2所消耗的ATP量。因此从能量学角度来说,有机碳源可能比无机碳源更有利于细胞同化。

表1 聚球藻7942光自养和混养中ATP与NAD(P)H的产生与利用 (mmol/(g⋅h))Table 1 The generation and utilization of ATP and NAD(P)H in the photoautotrophic and mixotrophic cultures ofSynechococcussp. PCC7942 (mmol ATP/ (g⋅h))
3.4 能量利用与转换效率
在光自养条件下,藻细胞合成和产物生成所需的能量全部来自光能。而在混养条件下,除了光供给能量外,细胞还可以利用有机碳源代谢提供的能量用于细胞合成和产物生成。研究基于能量生成或消耗的细胞得率对于了解聚球藻 7942在混养条件下的能量利用和转换效率具有重要意义。
在聚球藻7942光自养和混养过程中,吸收的光能只有一部分用于光合作用。从图 6可以看到,聚球藻 7942在混养条件下的光化学效率明显要比光自养条件下的低,特别是在葡萄糖混养中,光化学效率仅为37%。这是因为有机碳源的存在能抑制低CO2浓度下光自养生长的藻细胞碳酸酐酶的活性,并在一定程度上降低了光合作用速率[31],从而进一步导致用于光合作用的光能利用率下降。尽管如此,藻细胞在混养条件下,光仍然是能量的主要提供者。在葡萄糖混养和乙酸混养条件下,光所提供的能量占细胞总吸收能量的比例分别达到69.9%和89.0%。

图6 聚球藻7942在不同培养条件下的能量吸收Fig.6 Energy absorption ofSynechococcussp. PCC7942 in different cultures. The photochemical efficiency of photosystem II(■) and the percentages of energy contribution were also showed in the figure.
为了进一步研究藻细胞在混养条件下的能量利用情况,根据上述聚球藻7942的代谢流数据,可以获得其分别在不同培养条件下的能量利用和转换效率相关参数 (表2)。聚球藻7942在葡萄糖混养和乙酸混养条件下基于总能量的得率YX/E分别为10.93×10−3g/kJ和 13.22×10−3g/kJ,远高于光自养条件的 6.85×10−3g/kJ水平。同样,混养条件下基于ATP生成的藻细胞得率YATP比光自养分别增加46%和50%。与此相对应,基于ATP生成的能量转换效率,分别为 7.43%和 8.77%,分别为光自养的 1.1和 1.3倍,这进一步表明混养的能量转换率要高于光自养。这是因为在光合微藻培养过程中,以 ATP为代表的生物能量的产生主要来自 2条途径:光合磷酸化和氧化磷酸化,并且氧化磷酸化途径的能量生产效率要远高于光合磷酸化[25]。在混养培养中,微藻细胞内的氧化磷酸化程度比光自养条件下的要高,从表 1也可以看出,混养条件下通过氧化磷酸化产生的ATP量是光自养水平下的4倍。因此,混养的能量利用和转换效率要高于光自养。另一方面,由于乙酸在代谢网络中主要是以前体物质提供者参与细胞合成,能量释放较少,而葡萄糖除了提供前提外,更多地参与了氧化磷酸化过程,能提供较多能量 (图 6)。所以乙酸混养的能量利用率略高于葡萄糖混养,相应的细胞得率也略有提高,这与分批培养数据比较吻合 (图3)。
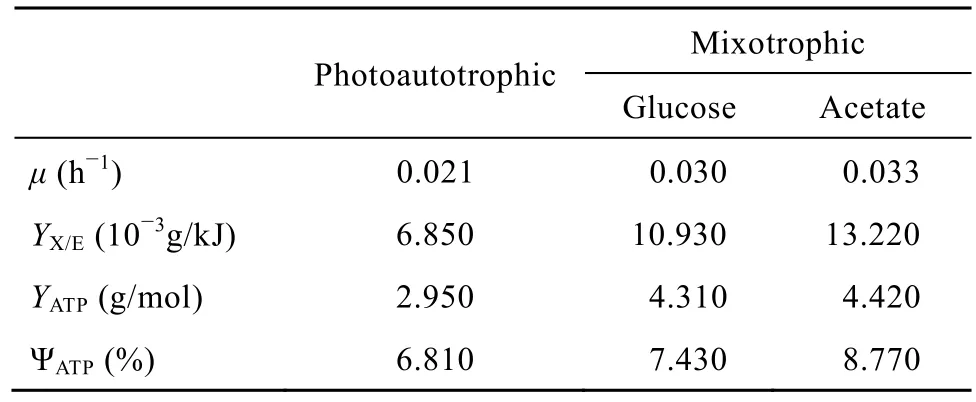
表2 聚球藻7942光自养和混养中的能量利用Table 2 The energy utilization ofSynechococcussp.PCC7942 in the photoautotrophic and mixotrophic cultures
4 小结
聚球藻7942曾经被认为是专性光自养蓝藻,然而本研究发现其能在低浓度有机碳源存在的情况下进行混养生长。本文以聚球藻7942为对象,分别以葡萄糖和乙酸为有机碳源进行混养培养,结果发现,在基本培养基中添加4.0 g/L的葡萄糖和2.0 g/L乙酸的藻细胞浓度分别达到了0.79 g/L和0.90 g/L,比光自养条件下有明显提高。在此基础上,本文运用代谢通量分析方法着重对聚球藻 7942在异养条件下的碳代谢特征进行了探讨。研究结果表明,在葡萄糖混养中,糖酵解途径的碳代谢流量要高于光自养和乙酸混养,并能直接产生更多的ATP用于细胞合成。而在乙酸混养中,乙酸主要作为合成细胞成分的前体物质参与碳代谢。从能量代谢角度来说,混养过程中光合磷酸化产生的 ATP明显低于光自养,但氧化磷酸化过程所产生的ATP要高于光自养。虽然聚球藻 7942在混养条件下的光化学效率低于光自养条件,但光仍然是能量的主要提供者。在能量利用方面,聚球藻7942在葡萄糖混养和乙酸混养条件下的基于总能量的得率和基于ATP生成的得率均高于光自养,能量转换效率是光自养的 1.1倍以上。本研究不仅从宏观的细胞生长的角度,而且还从碳代谢和能量利用的微观角度上进一步探讨了混养培养碳源对聚球藻7942生长促进的机制。这在一定程度上为其利用混养培养来提高藻细胞的培养密度,实现微藻的大规模培养奠定了理论基础。
附录 I Nomenclature




附录 II Biochemical reactions for flux estimation


REFERENCES
[1] Ma Y, Jiao NZ. Advances in molecular ecological research onSynechococcus.Prog Nat Sci, 2004, 14(9): 967–971.
马英, 焦念志. 聚球藻 (Synechococcus) 分子生态学研究进展. 自然科学进展, 2004, 14(9): 967–971.
[2] Tchernov D, Helman Y, Keren N,et al. Passive entry of CO2and its energy-dependent intracellular conversion to HCO3−in cyanobacteria are driven by a photosystem I-generateddeltamuH+.J Biol Chem, 2001, 276(26):23450–23455.
[3] Vazquez-Bermudez MF, Paz-Yepes J, Herrero A,et al. TheNtcA-activatedamt1 gene encodes a permease required for uptake of low concentrations of ammonium in the cyanobacteriumSynechococcussp. PCC 7942.Microbiology, 2002, 148(3): 861–869.
[4] Sandstrom S, Ivanov AG, Park YI,et al. Iron stress responses in the cyanobacteriumSynechococcussp.PCC7942.Physiol Plant, 2002, 116(2): 255–263.
[5] Sarcina M, Tobin MJ, Mullineaux CW. Diffusion of phycobilisomes on the thylakoid membranes of the cyanobacteriumSynechococcus7942. Effects of phycobilisome size, temperature, and membrane lipid composition.J Biol Chem, 2001, 276(50): 46830–46834.
[6] Schmitz O, Boison G, Bothe H. Quantitative analysis of expression of two circadian clock-controlled gene clusters coding for the bidirectional hydrogenase in the cyanobacteriumSynechococcussp. PCC7942.Mol Microbiol, 2008, 41(6): 1409–1417.
[7] Xi C, Wang CM, Shi DJ. Advances on cyanobacteria genetic engineering applications.China Biotech, 2010,30(3): 105–111.
席超, 王春梅, 施定基. 蓝藻基因工程应用研究进展.中国生物工程杂志, 2010, 30(3): 105–111.
[8] Kratz W, Myers J. Photosynthesis and Respiration of Three Blue-Green Algae.Plant Physiol, 1955, 30(3):275–280.
[9] Hoare DS, Hoare SL, Moore RB. The photoassimilation of organic compounds by autotrophic blue-green algae.Microbiology, 1967, 49(3): 351–370.
[10] Pelroy R, Rippka R, Stanier R. Metabolism of glucose by unicellular blue-green algae.Arch Microbiol, 1972, 87(4):303–322.
[11] Pearce J, Carr NG. The metabolism of acetate by the blue-green algae,Anabaena variabilisandAnacystis nidulans.Microbiology, 1967, 49(2): 301–313.
[12] Khoja T, Whitton B. Heterotrophic growth of blue-green algae.Arch Microbiol, 1971, 79(3): 280–282.
[13] Takahashi H, Miyake M, Tokiwa Y,et al. Improved accumulation of poly-3-hydroxybutyrate by a recombinant cyanobacterium.Biotechnol Lett, 1998, 20(2): 183–186.
[14] Wang J, Kang RJ, Shi DJ,et al. Effects of organic carbon sources on photosynethesis and growth of trans-hTN-αSynechococcussp. PCC7002.J Plant Physiol Mol Biol, 2003, 29(5): 405–408.
汪晶, 康瑞娟, 施定基, 等. 有机碳源对转hTNF-α基因聚球藻生长和光合作用的影响. 植物生理与分子生物学学报, 2003, 29(5): 405–408.
[15] Kang R, Wang J, Shi D,et al. Interactions between organic and inorganic carbon sources during mixotrophic cultivation ofSynechococcussp.Biotechnol Lett, 2004,26(18): 1429–1432.
[16] Yan RM, Zhang ZB, Zhu D,et al. Carbon and energetic metabolism ofSynechococcussp. PCC7942 under photoautotrophic conditions.Chin J Biotech, 2009, 25(9):1352–1359.
颜日明, 张志斌, 朱笃, 等. 聚球藻7942光自养培养的碳代谢和能量代谢. 生物工程学报, 2009, 25(9):1352–1359.
[17] Zhu D, Li YG, Ye Q,et al. Effect of CO2concentrations on growth, thymosinα1 expression and photosynthesis of transgenicSynechococcussp. PCC7942.Acta Hydrob Sin,2004, 28(4): 361–366.
朱笃, 李元广, 叶勤, 等. CO2对转基因聚球藻 7942生长、表达等的影响. 水生生物学报, 2004, 28(4): 361–366.
[18] Smith P, Mah R. Kinetics of acetate metabolism during sludge digestion.Appl Environ Microb, 1966, 14(3): 368.
[19] Lichtenthaler H. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes.Methods Enzymol, 1987,148(2): 350–382.
[20] Hewitt B. Spectrophotometric determination of total carbohydrate.Nature, 1958, 182(6): 246–247.
[21] Piorreck M, Baasch K, Pohl P. Biomass production, total protein, chlorophylls, lipids and fatty acids of freshwater green and blue-green algae under different nitrogen regimes.Phytochemistry, 1984, 23(2): 207–216.
[22] Bradford M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem, 1976,72(1/2): 248–254.
[23] Fresenius W, Quentin K, Schneider W. Water Analysis.Berlin: Springer Verlag, 1988: 283–285.
[24] Grima EM, Camacho FG, Perez JAS,et al. Evaluation of photosynthetic efficiency in microalgal cultures using averaged irradiance.Enzyme Microb Tech, 1997, 21(5):375–381.
[25] Yang C, Hua Q, Shimizu K. Energetics and carbon metabolism during growth of microalgal cells under photoautotrophic, mixotrophic and cyclic light-autotrophic/dark-heterotrophic conditions.Biochem Eng J, 2000, 6(2):87–102.
[26] Campbell D, Hurry V, Clarke A,et al. Chlorophyll fluorescence analysis of cyanobacterial photosynthesis and acclimation.Microbiol Mol Biol Rev, 1998, 62(3):667–683.
[27] Maxwell K, Johnson G. Chlorophyll fluorescence-a practical guide.J Exp Bot, 2000, 51(345): 659–668.
[28] Lide D. CRC Handbook of Chemistry and Physics. 87th ed. Cleveland: CRC Press, 2006.
[29] Stadnichuk I, Rakhimberdieva M, Bolychevtseva Y,et al.Inhibition by glucose of chlorophyll a and phycocyanobilin biosynthesis in the unicellular red algaGaldieria partitaat the stage of coproporphyrinogen III formation.Plant Sci, 1998, 4(7): 11–23.
[30] Nakajima Y, Ueda R. Improvement of microalgal photosynthetic productivity by reducing the content of light harvesting pigment.J Appl Phycol, 1999, 11(2):195–201.
[31] Villarejo A, Orús M, Martinez F. Regulation of the CO2-concentrating mechanism inChlorella vulgarisUAM 101 by glucose.Physiol Plantarum, 2006, 99(2): 293–301.
Carbon metabolism and energetic utilization ofSynechococcussp. PCC7942 under mixotrophic condition
Riming Yan1,2, Zhibin Zhang2, Qinggui Zeng2, Du Zhu2,3, and Ju Chu1
1State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai200237,China
2Key Laboratory of Protection and Utilization of Subtropical Plant Resources of Jiangxi Province,Jiangxi Normal University,Nanchang330022,China
3Yichun University,Yichun336000,China
Received:April 29, 2010;Accepted:July 12, 2010
Supported by:National Natural Science Foundation of China (No. 20506009), Natural Science Foundation of Jiangxi Province (No. 0530095),Education Department of Jiangxi Province (No. GJJ08147).
Corresponding author:Du Zhu. Tel: +86-795-3200616; E-mail: zhudu12@163.com
Ju Chu. Tel: +86-21-64253021; E-mail: juchu@ecust.edu.cn
国家自然科学基金 (No. 20506009),江西省自然科学基金 (No. 0530095),江西省教育厅 (No. GJJ08147) 资助。
