Rhodobacter sphaeroides偶氮还原酶三级结构同源建模与分析
2010-09-28柳广飞,周集体,王竞,周觅
柳 广 飞, 周 集 体, 王 竞, 周 觅
(大连理工大学环境学院,辽宁大连 116024)
0 引 言
偶氮染料是分子中具有一个或多个偶氮基的芳香类化合物,由于其易于合成且性质稳定,被广泛应用于印染、纺织、食品和制药等行业中[1].上述行业产生的染料废水的处理一直备受关注.相对于传统的物理、化学方法,微生物法对染料废水的处理由于其成本低廉、环境友好而成为人们研究的热点.细菌的偶氮还原酶将电子传递给偶氮染料而使其偶氮键断裂,在偶氮染料的脱色降解中发挥着重要作用.近年来,人们从废水、土壤、皮肤等不同来源的微生物中得到了多种偶氮还原酶.其中除了源自 Pigmentiphaga kullae和Xenophilus azovorans的偶氮还原酶外,大都在分子中含有黄素单核苷酸(FMN)辅基,统称为依赖黄素的偶氮还原酶(flavin-dependent azoreductase)[2].
目前研究蛋白质三级结构的主要方法有X-射线衍射和核磁共振等,但这些方法往往成本昂贵,成功率低.近些年来,随着基因组学和蛋白质组学的发展,人们所获得的基因和蛋白质序列越来越多,积累了大量的生物信息,与计算机和信息技术相结合,逐渐形成了一系列崭新的、以生物信息学为基础的预测蛋白质三级结构、构建结构模型的方法.同源建模法(homology modeling method)是在蛋白质数据库中寻找未知结构蛋白质的同源伙伴,再将同源蛋白质的结构优化而构建出预测的蛋白质三维结构[3].
本文利用同源建模方法构建Rhodobacter sphaeroides偶氮还原酶AZR的三级结构模型,并在此基础上探讨依赖黄素的偶氮还原酶的分类与结构特征.
1 材料和方法
1.1 材 料
以本实验室克隆测序的Rhodobacter sphaeroides(R.sphaeroides)偶氮还原酶基因azr(GenBank登录号AY150311)[4],翻译成偶氮还原酶 AZR蛋白序列(GenBank登录号AAN17400)作为分析的模板序列.
1.2 应用软件、数据库与服务器
序列对齐分析采用GeneDoc软件完成;进化树采用MEGA软件构建;应用Swiss PdbViewer(DeepView)软件构建三级结构模型;采用PyMOL软件分析三级结构模型;采用Whatcheck与Procheck软件进行模型评价.
基因与蛋白质序列检索比对数据库:National Center for Biotechnology Information/GenBank(NCBI/GenBank,http://www.ncbi.nlm.nih.gov/GenBank);蛋白质结构数据库:Research Collaboratory for StructuralBioinformatics/Protein Data Bank(RCSB/PDB,http://www.rcsb.org/pdb/home/home.do);蛋白质同源建模服务器:SWISS-MODEL(http://swissmodel.expasy.org//SWISS-MODEL);蛋白质三级结构比较服务器:DALI(http://www.ebi.ac.uk/dali).
1.3 同源建模的方法
(1)新建一个 FASTA格式的偶氮还原酶AZR的蛋白序列文件.
(2)打开软件 SwissPdbViewer,在SwissModel菜单下选择 Load Raw Sequence to Model命令;在新对话框中打开序列文件.
(3)寻找合适模板结构.在SwissModel菜单下选择Find Appropriate ExPDB Templates.
(4)选择合适模板(1NNI)并用 Swiss PdbViewer打开.
(5)序列对齐.在Wind菜单下选择Sequence Alignment命令,进行目标结构与模板结构的序列对齐.
(6)结构模拟与调整.在 Fit菜单下选择Magic Fit命令,初步进行结构模拟;在Select菜单下选择aa Making Clashes命令,然后在Tools菜单下选择Fix Selected Sidechains下的Quick and Dirty进行调整.
(7)提交构建模型申请.选择SwissModel菜单下的Submit Modeling Request命令,填写相关信息后等待服务器返回结果.
2 结果与讨论
2.1 AZR蛋白序列的对齐分析
以AZR的蛋白序列在GenBank中进行BLAST搜索,根据搜索结果利用GeneDoc软件进行对齐分析.如图1所示,AZR与来自Bacillus sp.OY1-2、Bacillus subtilis、Staphylococcus aureus、Saccharomyces cerevisiae 和 Pseudomonas aeruginosa的蛋白分别有 97%、51%、21%、20%和15%的序列一致性.Pro72-Gly111之间的氨基酸残基具有较高的相似性,其中包括一个新的黄素氧化还原蛋白家族的特征序列(P-X-Y-H/N-6X-L-K-N-S/A-L/I-D)[5]和一个参与 NAD(P)H结合的甘氨酸富集区(G-G-G-K/H-G-G).
2.2 AZR的结构模型
利用Swiss PdbViewer软件和SWISS-MODEL服务器开展模型构建工作.通过搜索,在PDB中发现一个与AZR具有51%序列一致性的已知结构蛋白质,编号为1NNI,为源自B.subtilis的蛋白YhdA.按照生物信息学理论,如果两种蛋白质在连续100个氨基酸范围内有大于40%的一致性,那么它们在结构上则具有较为显著的相似性,已知结构的蛋白可以作为建立目标蛋白结构模型的模板.此种情况下,按照同源建模方法能够提供详细而又准确的结构预测结果.因此,本文采用1NNI作为模板开展AZR的结构预测工作.

图1 AZR与相似黄素氧化还原蛋白的序列对齐分析Fig.1 Multiple sequence alignment of AZR with similar flavodoxins
经前述方法中的步骤,得到如图2所示的AZR三级结构模型.AZR结构模型Ramachandran图中所有氨基酸残基均分布在允许的范围内(favoured and allowed regions),无不允许残基位置出现,模型中蛋白质主链残基的二面角构象合理;Procheck与WhatCheck的评价结果表明模型的结构和均方根Z大多在允许范围内,模型较为合理,可用来分析AZR的结构.
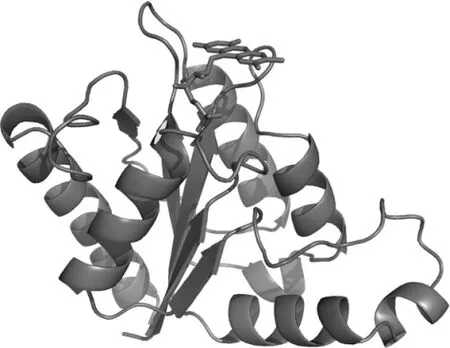
图2 AZR的三级结构模型Fig.2 3D structure model of AZR
AZR为α/β型结构,分子中含有5个α螺旋,5个β折叠,螺旋与折叠交替出现.5个β折叠相互平行,形成一个平面,位于分子的中间;α螺旋分列于平面的两侧,一侧2个,另一侧3个;在β折叠的C端非共价地结合一个黄素单核苷酸(FMN)分子.生物化学中把这类由一条多肽链结合一个黄素辅基(FMN或FAD)组成的蛋白称为黄素蛋白(flavoprotein),每个辅基能够提供两个质子和电子;相对分子质量在15~22 kDa,分子结构为α/β型,非共价地结合一个FMN作为氧化还原中心的黄素蛋白又称为黄素氧化还原蛋白(flavodoxin).因此,AZR为一种黄素氧化还原蛋白.
通过DALI服务器将AZR的结构与所有已知蛋白结构进行比较,结构相似程度最高的即为本文作为模板的1NNI,Z=32.5,均方根偏差Drms=0.4.其他相似结构还包括1RTT,Z=19.2,Drms=1.8;2FZV,Z=19.1,Drms=1.8等.关于这些蛋白的功能报道并不一致,但它们都属于黄素氧化还原蛋白,分子结构都为α/β型三明治结构.
2.3 AZR的乒乓动力学机理
此前研究发现AZR在还原偶氮类化合物时遵循双底物乒乓动力学机理.由对AZR的结构模型分析发现,作为黄素氧化还原蛋白的AZR中存在着FMN这一氧化还原反应中心,因此,乒乓机理可更具体地表示如下(其中E表示偶氮还原酶AZR,S表示电子受体底物,P表示产物):

NAD(P)H为电子供体,另一底物(如偶氮染料)为最终电子受体.在双底物乒乓动力学反应过程中,AZR分子中的FMN辅基作为中介,首先获得NAD(P)H提供的电子,变成还原态FMNH2;NAD(P)+离开反应中心后,另一底物分子进入其中,从FMNH2获得电子而被还原,同时AZR回复到初始状态.
2.4 依赖黄素的偶氮还原酶分类
通过序列对齐分析发现,依赖黄素的偶氮还原酶按序列相似性可以归入两个家族,分别以R.sphaeroides的偶氮还原酶 AZR和 Escherichia coli的偶氮还原酶AzoR为代表;两个家族之间无序列同源性可言.
分别由上述两种代表性的偶氮还原酶的序列,通过NCBI的TBLAST寻找相似序列,并利用MEGA 4.0软件以邻接法(neighbor-joining method)构建两类依赖黄素的偶氮还原酶家族的进化树(见图3).

图3 两类依赖黄素的偶氮还原酶家族的系统进化树Fig.3 Phylogenetic trees of two flavin-dependent azoreductase families
图3中各物种及其GenBank登录号如下:B.anthracis AE017334,B.cereus AE016877,Bacillus sp.OY1-2 AB032601,R.sphaeroides AY150311, B. thuringiensis CP000485,B.licheni f ormis AE017333, B. subtilis AB071366,G.stearothermophilus AB071367,H.marismortui AY596297, S.aureus AY545994, P. aeruginosa AE004091,S.cerevisiae AY558199, B. henselae BX897699,B.anthracis AE017225,B.cereus CP000001, C. perf ringens BA000016,L.monocytogenes AE017262, E.f aecalis AY122207,L.lactis AE006275,S.boydii CP000036,E.coli NC000913,S.ty phimurium AE008772,P.f luorescens CP000094.
光合细菌R.sphaeroides偶氮还原酶AZR所属的第一类家族中偶氮还原酶的结构此前未见报道.而来自第二类家族偶氮还原酶的三级结构的报道表明E.coli和E.f aecalis的偶氮还原酶AzoR和 AzoA,PDB代号分别为1V4B和2HPV,也是α/β型的黄素氧化还原蛋白,分子中央为5个相互平行的β折叠构成的平面,6个α螺旋分列两侧,一侧2个,另一侧4个[6、7].
如图4,利用PyMOL软件比较两类依赖黄素的偶氮还原酶的结构.可以发现,尽管两类偶氮还原酶家族在氨基酸序列上无同源性可言,但它们的三级结构非常相似,分子中FMN辅基的结合位置和方式也很相似.两类序列上无同源性却具有相同功能的偶氮还原酶家族在本质上是同一类黄素氧化还原蛋白.蛋白质科学中认为结构决定功能,这一发现加深了对具有偶氮还原酶活性的蛋白质在结构上的认识,蛋白质的三级结构要比其序列的保守性更高.
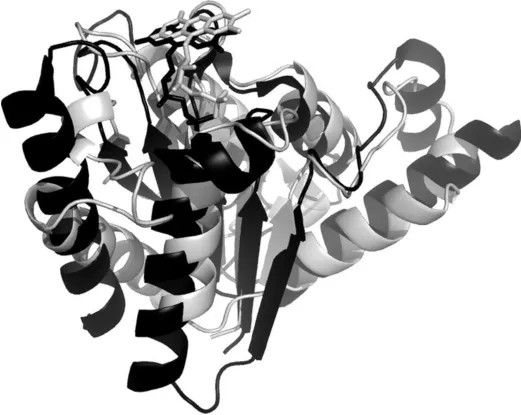
图4 AZR(灰色)与AzoR(黑色)的结构对比Fig.4 Structure comparison of AZR(gray)and AzoR(black)
2.5 依赖黄素的偶氮还原酶活性区域分析
结合对AZR三级结构的分析发现,序列对齐分析中所发现的两处保守序列,黄素氧化还原蛋白特征序列和甘氨酸富集区分别对应着FMN附近的两个环状结构(Loop 1和Loop 2).特别地,在另一类依赖黄素的偶氮还原酶,E.coli的AzoR中也发现了类似的环状结构(图5).有报道认为Loop 1可能参与对FMN的结合;而位于嘧啶环附近的Loop 2可能是参与NAD(P)H结合的位点[8、9].这进一步证明了尽管两类依赖黄素的偶氮还原酶的蛋白序列无相似性,但其功能是有相似的结构基础的.
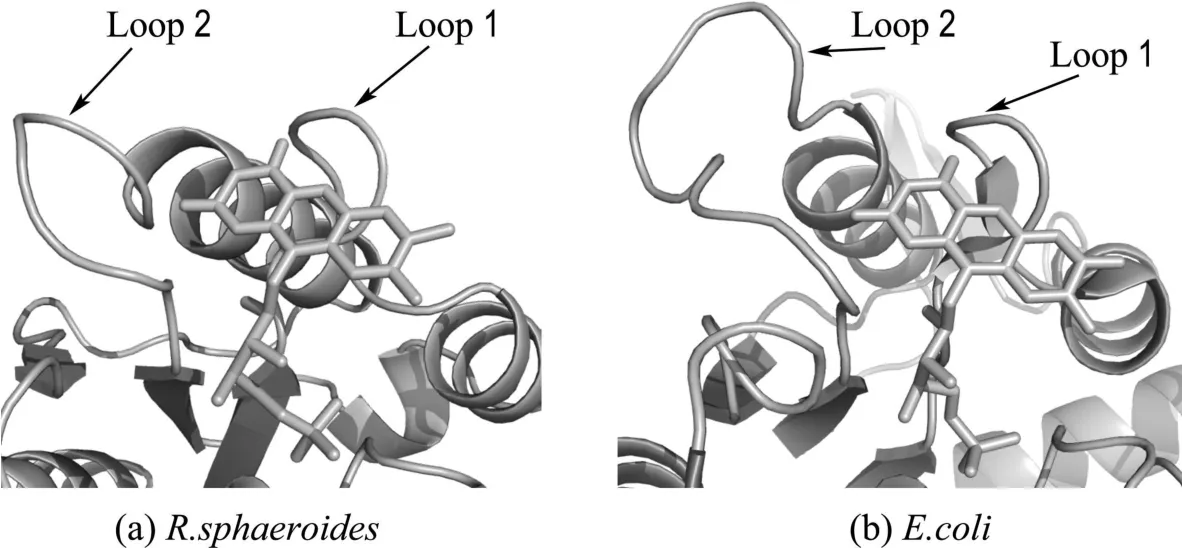
图5 R.sphaeroides和E.coli的依赖黄素偶氮还原酶FMN辅基附近的保守环状结构Fig.5 Conserved loops around FMN cofactors of flavin-dependent azoreductases from R.sphaeroides and E.coli
3 结 论
(1)序列对齐分析发现R.sphaeroides偶氮还原酶AZR的蛋白序列中存在两处保守功能序列,即一类新的黄素氧化还原蛋白的特征序列和一个参与NAD(P)H结合的甘氨酸富集区.
(2)利用同源建模法,构建了AZR的三级结构模型,AZR为一α/β型的黄素氧化还原蛋白,蛋白分子呈三明治结构,含有一个FMN辅基,参与双底物乒乓动力反应的电子传递.
(3)根据序列对齐分析,可将依赖黄素的偶氮还原酶分为两个家族,分别构建了两个家族的进化树.
(4)尽管两类依赖黄素的偶氮还原酶在序列上无相似性可言,但它们的三级结构非常接近,都是α/β型的黄素氧化还原蛋白,FMN辅基的结合位置与方式也很相似,辅基周围保守存在着两个环状区域.蛋白质的三级结构比其氨基酸序列的保守性更高.这一认识为发现新的偶氮还原酶及其编码基因和深入研究AZR的功能奠定了基础.
[1]RAFFIF,HALL JD,CERNIGLIA C E.M utagenicity of azo dyes used in foods,drugs and cosmetics before and after reduction by Clostridium species from the human intestinal tract[J].Food and Chemical Toxicology,1997,35(9):897-901
[2]CHEN H.Recent advances in azo dye degrading enzyme research[J].Current Protein and Peptide Science,2006,7(2):101-111
[3]谌 容,陈 敏,杨春贤,等.基于SWISS-MODEL的蛋白质三维结构建模[J].生命的化学,2006,26(1):54-56
[4]YAN Bin,ZHOU Ji-ti,WANG Jing,etal.Expression and characteristics of the gene encoding azoreductase from Rhodobacter sphaeroidesAS1.1737[J].FEMS Microbiology Letters, 2004,236(1):129-136
[5]LIU Guang-fei,ZHOU Ji-ti,LV Hong,et al.Azoreductase from Rhodobacter sphaeroidesAS1.1737 is a flavodoxin that also functions as nitroreductase and flavin mononucleotide reductase[J].Applied Microbiology and Biotechnology,2007,76(6):1271-1279
[6]ITOK,NAKANISHIM,LEEW C,etal.Three-dimensional structure of AzoR from Escherichia coli.An oxidereductase conserved in microorganisms[J].The Journal of Biological Chemistry,2006,281(29):20567-20576
[7]LIU Z J,CHEN H,SHAW N,et al.Crystal structure of an aerobic FMN-dependent azoreductase(AzoA)from Enterococcus faecalis[J].Archives of Biochemistry and Biophysics,2007,463(1):68-77
[8]CHENH,HOPPERSL,CERNIGLIA CE.Biochemical and molecularcharacterization of an azoreductase from Staphylococcus aureus, a tetrameric NADPH-dependent flavoprotein [J].Microbiology,2005,151(5):1433-1441
[9]LIGER D,GRAILLE M,ZHOU C Z,et al.Crystal structure and functional characterization ofyeast YLR011wp,an enzyme with NAD(P)H-FMN and ferriciron reductase activities[J].Journalof Biological Chemistry,2004,279(33):34890-34897
