番茄叶霉病菌产毒条件研究
2010-09-28李小波康立功李景富
李小波, 康立功, 路 盼, 张 贺, 李景富
(东北农业大学园艺学院番茄研究所,哈尔滨 150030)
番茄叶霉病是番茄的主要病害之一,在欧洲、美洲、亚洲、大洋洲、非洲都有该病发生的报道,在我国以华北和东北地区受害最为严重[1]。番茄叶霉病是由半知菌亚门黄枝孢菌引起的真菌性病害,具有间歇暴发的特点。近年来,番茄普遍采取保护地种植方式,而保护地环境条件客观上促进了叶霉病的大规模发生和流行,因此该病害在保护地有逐年加重的趋势[2],目前,已成为保护地番茄高产、稳产的重要限制因素。
番茄叶霉病菌分泌的毒素是导致叶霉病发生及给番茄造成伤害的关键生化因子[3],因此探明番茄叶霉病菌分泌毒素的条件,有利于番茄抗/感叶霉病菌生化机理的研究和筛选、鉴定番茄抗叶霉病种质资源。前人研究结果表明:番茄叶霉病菌产生毒素为多组分糖蛋白[4],该毒素对番茄组织细胞具有明显的损伤作用,主要包括:诱导叶组织坏死,加速胼胝质沉积和电解质渗漏,提高脂加氧酶活性和脂质过氧化作用等[5-6]。
番茄叶霉病菌具有明显的生理分化现象,至少有13个生理小种已被报道[7]。目前,国内外对番茄叶霉病菌的研究,仅限于番茄叶霉病菌的分离、纯化和生理小种鉴定等;而有关番茄叶霉病菌毒素的产生条件国内外均鲜见报道。本试验以东北农业大学番茄研究所保存的番茄叶霉病菌生理小种1.2.3.4及番茄感病品种东农704为研究材料,系统详尽地对番茄叶霉病菌产毒条件、提取方法、浓度测定及生物学活性分析方法进行了研究,以期为番茄抗叶霉病育种奠定基础和提供现实条件。
1 材料与方法
1.1 供试菌株
番茄叶霉病菌生理小种1.2.3.4及番茄感病品种东农704,均由东北农业大学番茄研究所提供。
1.2 培养条件
1.2.1 培养液种类
在无菌条件下,分别采用 Czapek、改进的Czapek、Fries、Richard 、PS 、PD 6 种培养液,培养液配方见文献[8],放入直径为8mm的菌碟5片,pH 7,25℃振荡培养20 d,3次重复。
1.2.2 pH
在无菌条件下,分别在 pH 3、5、6、7、9的 PS 培养液中,放入直径为8mm的菌碟5片,25℃恒温振荡培养20 d,3次重复。
1.2.3 培养时间
在无菌条件下,分别在pH7的PS培养液中放入直径为8mm的菌碟5片,25℃恒温振荡培养7、14、21 d和28 d,3次重复。
1.2.4 温度
在无菌条件下,分别在pH7的PS培养液中放入直径为8mm 的菌碟5 片,分别在 22、24、26、28、30℃及34℃下振荡培养20 d,3次重复。
1.2.5 培养方式
在无菌条件下,在pH 7的PS培养液中放入直径为8 mm的菌碟5片,分别在25℃下进行静止培养、每天振荡12 h培养和全天振荡培养20 d,3次重复,定时测定毒素浓度。
1.2.6 光照
在无菌条件下,在pH 7的PS培养液中放入直径为8 mm的菌碟5片,分别在25℃下振荡培养20 d,设黑暗、每天光照12 h和24 h共3个处理,3次重复,定时测定毒素浓度。
1.2.7 菌碟数
在无菌条件下,分别在pH7的PS培养液中放入3、5、7碟直径为8 mm的菌碟,在25℃下振荡培养20 d,3次重复,定时测定毒素浓度。
1.3 叶霉病菌粗毒素的提取与浓度的测定
1.3.1 毒素蛋白的提取
参照陈旭升[9]介绍的方法,略作改进。具体为:将上述培养的菌液在无菌条件下,每样品每次吸取5m L,5 000 r/min离心15m in,取上清液,再经滤膜(d=0.45μm)过滤,粗毒素滤液做显微观察,确定无菌后用 90%饱和度硫酸铵沉淀过夜。再经15 000 r/min离心20 min,弃上清液得蛋白质粗提物。用0.05 mol/L磷酸缓冲液含有0.15 mol/L NaCl(pH=7.0)溶解蛋白质,15 000 r/min离心5 min,得上清蛋白质溶液。
1.3.2 毒素蛋白的浓度测定
按考马斯亮蓝G-250法[10],以牛血清白蛋白作标准曲线(图1),在722分光光度计上595 nm处测定滤液中的毒素蛋白浓度,以磷酸缓冲液作对照。
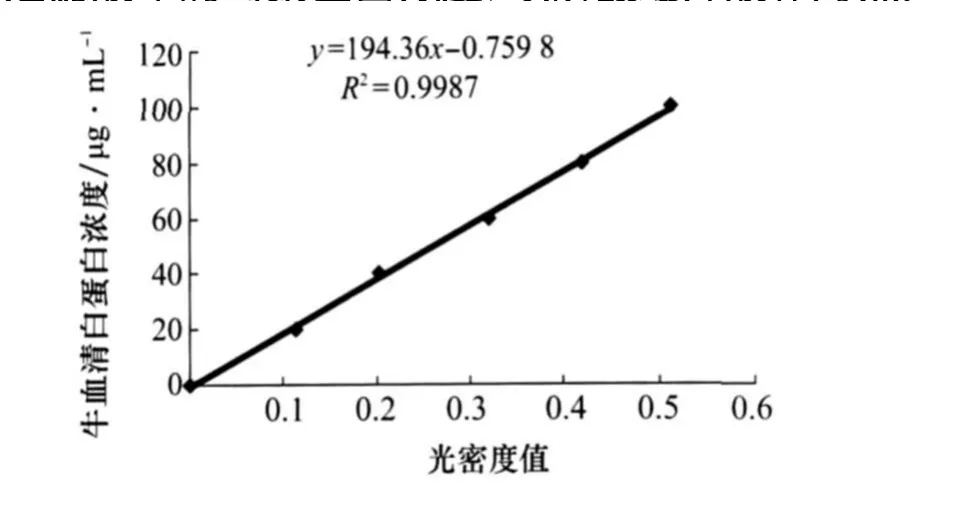
图1 牛血清白蛋白的标准曲线
1.4 叶霉病菌毒素生物测定
种子萌发法[3]:种子在40℃水中浸泡4 h,用0.1%高锰酸钾浸泡15 min。将种子放在铺有滤纸的培养皿中,每皿放50粒,分别各自加入上述7个浓度的毒素液2m L,然后每日加1m L,并透气1 h,置于28℃培养箱中黑暗培养,以未接菌的培养液作对照。5 d后测其萌发率,计算萌发抑制率。

2 结果与分析
2.1 不同培养液对产毒的影响
由图2可以看出,培养液对病菌产毒有很大的影响,其中以在PS液体培养液中产毒量最高,并且种子萌发抑制率最高达88%;其次是PD液体培养液;在Czapek、Richard这2种培养液中几乎不产毒素,说明它们是最不适合产毒的培养液。
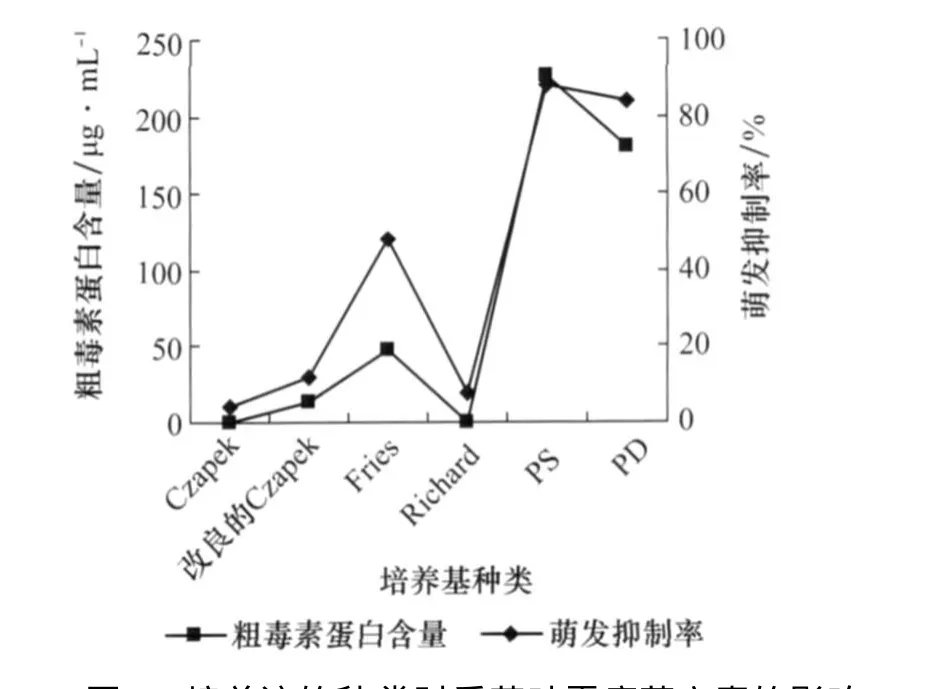
图2 培养液的种类对番茄叶霉病菌产毒的影响
2.2 pH对产毒的影响
由图3可以看出,培养液pH对病菌产毒有一定的影响,偏酸性的环境有利于产毒,pH为6时,毒性最强,种子萌发抑制率也达到最大为82%。
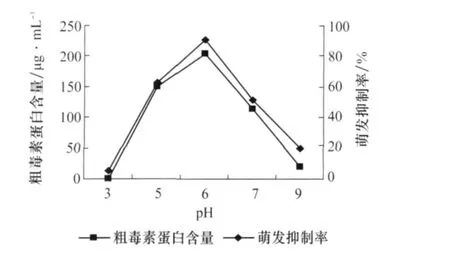
图3 pH对番茄叶霉病菌产毒的影响
2.3 培养时间对产毒的影响
由图4可以看出,从第7天到第21天产毒增长量都很明显,第28天趋于平缓。虽然第21天的粗毒素蛋白含量比第28天稍低一点,但是它的种子萌发抑制率达到最大为94%,所以21天为最适培养时间。
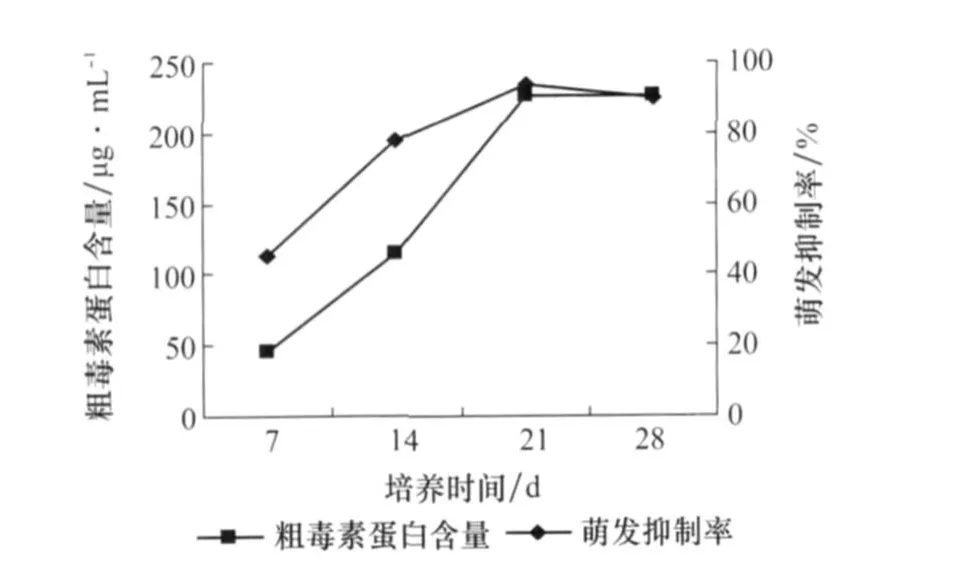
图4 培养时间对番茄叶霉病菌产毒的影响
2.4 温度对产毒的影响
由图5可以看出,温度对产毒量有一定的影响,温度偏高或偏低都不利于产毒,以26℃产毒量最多,种子萌发抑制率也最高,这可能跟菌丝产毒时所需酶的活性有关,28、30℃产毒量与种子萌发抑制率仅次于26℃,所以产毒的最佳温度范围为:26~30℃。
2.5 培养方式对产毒的影响
由图6可以看出,全天振荡培养产毒量与种子萌发抑制率均达到最高。可能是振荡培养加速了气体的交换,提供了充足的氧气,也加速了培养液中营养的利用,从而增强了菌丝的产毒能力;而静止培养菌落仅仅漂浮于培养液表面生长,无法获得充足的氧气与营养,致使产毒的量较低。
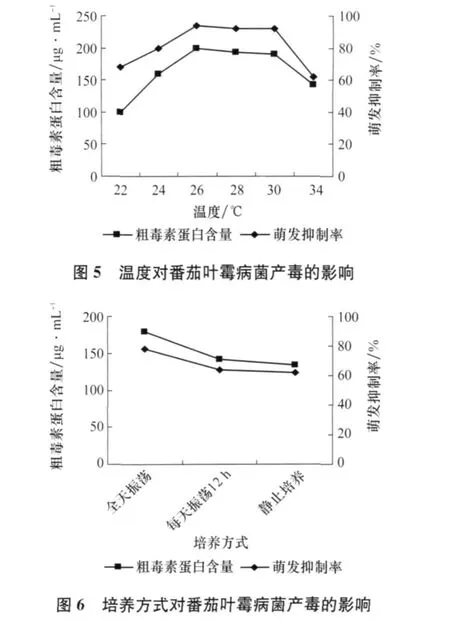
2.6 光照对产毒的影响
由图7可以看出,总的来说光照对产毒的影响不大。光照不但没有使毒素增加,反而有减少的趋势,可能光照对产毒有抑制作用,所以本试验采用黑暗培养。
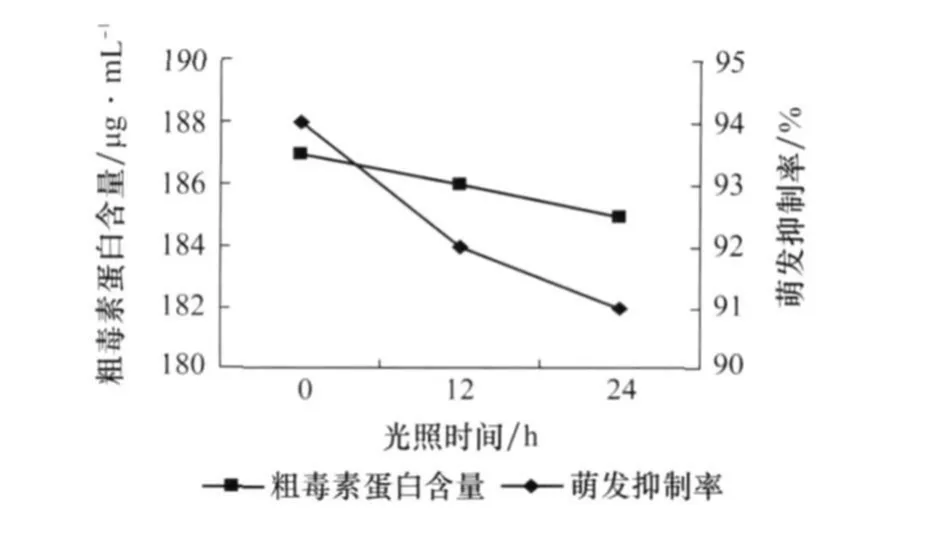
图7 光照对番茄叶霉病菌产毒的影响
2.7 接菌数量对产毒的影响
由图8可以看出,接菌数量从1碟到5碟产毒量与种子萌发抑制率逐渐上升,接菌数量为5碟时产毒量与种子萌发抑制率达到最高;7碟时有所降低,其可能原因是菌碟数量太多导致培养液营养供应不足。
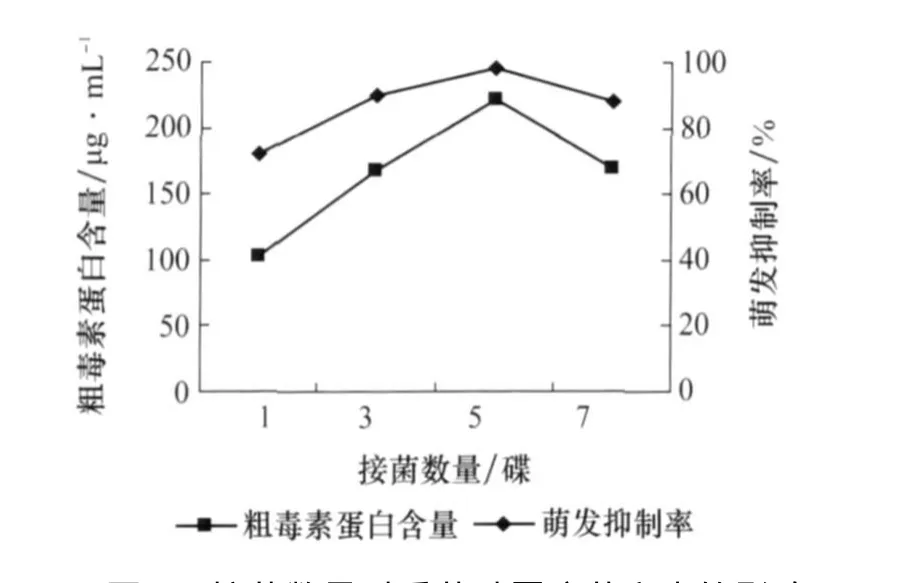
图8 接菌数量对番茄叶霉病菌产毒的影响
3 讨论
培养液对病原菌产毒影响很大,Plich's培养液最适于辣椒疫霉(Phy tophthora capsici)的生长和产毒[11]。高洪敏用4种培养基培养禾谷镰孢菌,以Richard培养基产生毒素的活性最高[12]。番茄叶霉病菌毒素的产生也同样受到培养液的影响,试验结果表明,PS培养液是番茄叶霉病菌的最佳产毒培养液。
在科研和生产中,都需要尽可能地获得最多的毒素。培养条件如:培养温度、培养基的pH及培养时间等是影响毒素产量的重要因素。石晓燕等对禾谷镰刀菌(F.gram inearum)液体培养产毒条件研究表明,禾谷镰刀菌产毒的最适温度为20℃,pH为5~6,光照可抑制毒素的产生,一般培养21~28 d达到产毒高峰[13]。刘亚光等[8]得出大豆灰斑病菌(Cerospora sojina)的最适产毒条件为:pH6~7,蔗糖浓度为3%,在25~28℃静止培养25~27 d。本试验得到的最适培养条件为:pH为6、温度为26~30℃、培养时间21 d、黑暗条件下振荡培养、接菌数量5碟。
许多研究[14-17]表明,各种培养条件分别达到最优,组合起来即为最优培养条件。这为本研究寻找到最优产毒条件提供了理论基础。
赵晓军等[18]研究表明,同一菌株毒素对胚芽的抑制率大于胚根。因此,在利用毒素测定不同菌株的生物活性时,采用种子萌发抑制率为宜。所以,本试验没有对胚根抑制率进行测定。
多数植物病原真菌可以产生毒素,这些毒素在其致病过程中的作用不同。由于有些植物病原菌分泌的毒素在植物上可以引起与活菌相似的症状和病理变化,因此可以替代活菌进行品种的抗性鉴定。这种方法快速、简单、定量性好,使繁重的田间抗病性鉴定工作可在室内完成[19]。刘慧芹在试验中证实了中杂8号与其他品种相比较,对毒素的敏感性最小,与其田间抗病性强一致[3]。这表明可以利用叶霉病菌毒素对番茄进行抗病性鉴定。
[1] 陈宇飞.我国番茄叶霉病研究进展[J].东北农业大学学报,2000(12):411-414.
[2] 张满良.农业病理学[M].中国农业出版社,1997.
[3] 刘慧芹.叶霉病菌粗毒素对番茄的生物活性测定[J].天津农学院学报,2004(11):10-13.
[4] LazarovitsG,Higgins V J.Biological activity and specificity of a toxin produced by Cladospor ium fulvum[J].Physiology and Biochem istry,1979,69(10):1056-1061.
[5] Dow B JM,Callow J A.Partial characterization of glycopeptides from cu lture filtrates of Fulvia fulva(Cooke)Ciferri,the tomato leaf mould pathogen[J].Journal of General M icrobiology,1979,113:57-66.
[6] Tobin L P,Higgins V J.Electrolyte leakage,lipoxygenase,and lipid peroxidation induced in tomato leaf tissue by specific and nonspecificelicitors from Cladospor ium fulvum[J].Plan t Physiol,1989,90:867-875.
[7] 卢钢,杨悦俭,寿森炎,等.番茄分子育种研究进展[J].分子植物育种,2003,1(5/6):805-811.
[8] 刘亚光.大豆灰斑病菌毒素组分、致病性及其诱导抗性的研究[D].哈尔滨:东北农业大学农学院,2002.
[9] 陈旭升,陈永萱,黄骏麒,等.棉花黄萎病菌致萎峰蛋白氨基酸组分及其有关生化特性分析方法[J].江苏农业学报,2000,16(1):10-14.
[10]夏正俊,顾本康,吴蔼民.毒素法苗期快速检测棉花品种抗黄萎病性研究[M]∥董金皋,李树正.植物病原菌毒素研究进展.北京:中国科学技术出版社,1997:200-204.
[11]谢丙炎,牛国仁.辣椒疫霉致病毒素[J].菌物系统,1997,16(4):274-280.
[12]高洪敏,陈捷.玉米茎腐菌毒素的产生条件和化学特征的初步研究[J].沈阳农业大学学报,1999,30(3):223-226.
[13]石晓燕,邓福友.禾谷镶刀菌液体培养产毒条件研究初报[J].河北农业大学学报,1992,15(4):34-38.
[14]孙文元,翟玉柱,赵凤岩,等.草莓灰霉病菌的培养及其毒素的生物测定[J].华北农学报,1999,14(增刊1):112-116.
[15]陆宁海,齐尚红,吴利民,等.番茄褐斑病菌产毒培养条件及其毒素的致病范围[J].微生物学杂志,2006,26(4):36-38.
[16]陆宁海,吴利民,田雪亮,等.黄瓜褐斑病菌的产毒培养条件及其毒素的致病范围[J].辽宁农业科学,2007(3):42-43.
[17]唐树戈,庄敬华,高增贵,等.玉米弯孢菌毒素培养条件的研究[J].安徽农业科学,2007,35(1):1-3.
[18]赵晓军,王美琴,刘慧平,等.番茄叶霉病菌不同菌株粗毒素对种子萌发的影响[J].山西农业科学,2005,33(1):50-52.
[19]台莲梅.大豆根腐病菌(Fusar ium oxysporum)毒素及其对大豆根部致病作用的研究[D].哈尔滨:东北农业大学农学院,2003.
