离子色谱法同时测定嗜热厌氧菌发酵液中的有机酸与无机阴离子
2010-09-24杨海燕
法 芸, 张 聪, 杨海燕, 包 艳, 秦 勇
(中国科学院 青岛生物能源与过程研究所 生物液体燃料重点实验室, 山东 青岛 266101)
离子色谱法同时测定嗜热厌氧菌发酵液中的有机酸与无机阴离子
法 芸, 张 聪, 杨海燕, 包 艳, 秦 勇
(中国科学院 青岛生物能源与过程研究所 生物液体燃料重点实验室, 山东 青岛 266101)
建立了一种利用离子色谱法同时测定甲酸、乙酸、乳酸、丙酸、丁酸5种有机酸及PO4−3、SO4−2、NO3−、Cl−、F−5种无机阴离子的方法。样品通过过滤、预柱处理后用IonPac AS11柱分离, 以自动淋洗液发生器生成的KOH为淋洗液进行梯度洗脱, 建立了优化的洗脱程序。用抑制型电导检测器检测有机酸的相对标准偏差为0.73%~1.01%, 加标回收率为88.1%~100.2%; 无机阴离子的平均相对标准偏差为 2.03%, 加标回收率为 92.6%~101.1%, 该方法可用于嗜热厌氧菌发酵液中低分子的有机酸和无机阴离子的同时测定。
离子色谱法; 梯度洗脱; 有机酸; 发酵液
近年来细胞的新陈代谢和通量研究已被广泛关注[1~3], 通过分析细胞代谢物的某些成分, 特别是重要代谢物成分的检测, 对准确地阐明新陈代谢的途径有着非常重要的意义[4]。同时可为合理地设计目标微生物提供有力的技术支持。
热纤梭菌是嗜热产芽孢的严格厌氧菌, 它是目前将纤维素直接转化为乙醇的最有效菌种, 因而引起众多生物能源研究者的关注。乙酸、乳酸等有机酸是热纤梭菌发酵后的重要代谢产物。通过对乙酸、乳酸等小分子质量有机酸的测定, 可为阐明热纤梭菌发酵的代谢途径提供有力的技术支持。
用于有机酸的测定方法很多, 如比色法、分光法、酶法、气相色谱法等。但这些方法一般需要对样品进行预分离或衍生化, 操作繁琐, 且同时分离检测的有机酸种类较少。也有采用高效液相色谱法分析有机酸的报道[5~9], 但紫外(UV)检测器在210 nm对干扰物质的选择性差。离子色谱法自20世纪70年代中期问世以来, 因其分析速度快、灵敏度高、能实现多组分同时分离定量等优点, 已经成为分析有机酸的有效方法[10~16]。常规无机阴离子存在的条件下对测试有一定干扰, 因此同时分析有机酸和无机阴离子具有一定的挑战性。作者采用戴安公司的 ICS3000型离子色谱系统, 建立了优化的梯度洗脱程序, 可以同时准确检测嗜热厌氧菌发酵液中的乙酸、乳酸等5种有机酸和等 5种无机阴离子, 结果准确可靠。目前国内相关的报道较少。
1 仪器与材料
ICS 3000多功能色谱装置(美国 Dionex公司),包括双泵(DP)模块、抑制电导检测器/色谱(DC)模块、淋洗液自动发生模块(EG)、自动进样器(AS)模块。Milli-Q® Advantage A10超纯水制备仪。
有机酸标准品: 甲酸、乙酸、乳酸、丙酸、丁酸均为色谱纯(购于上海晶纯试剂有限公司); 无机阴离子标准品:均为国家标准物质, 去离子水(电阻>18.2 MΩ), 其他试剂均为优级纯。
2 实验方法
2.1 样品制备
取 1 mL发酵液置于 2 mL塑料离心管中, 以6 000 r/min速度离心5 min, 固体杂质沉淀于离心管底。取适量上清液, 用水稀释 50倍, 稀释液经0.23 μm滤膜过滤除去微米级悬浮物。过IC-RP柱除去蛋白、色素等有机杂质。
IC-RP柱(1.0 mL, Agela Technologies)使用前须先经5 mL甲醇、10 mL水活化, 放置20 min后使用。当样品溶液通过该柱时, 前面3 mL弃去, 后面溶液待检测。
2.2 标准曲线的绘制
分别取上述测定项目的标准溶液, 配制不同浓度梯度的混合标准溶液。按不同浓度分别进样, 以峰面积-浓度绘制各组分的标准曲线, 表1列出了6个混合标准溶液的浓度。
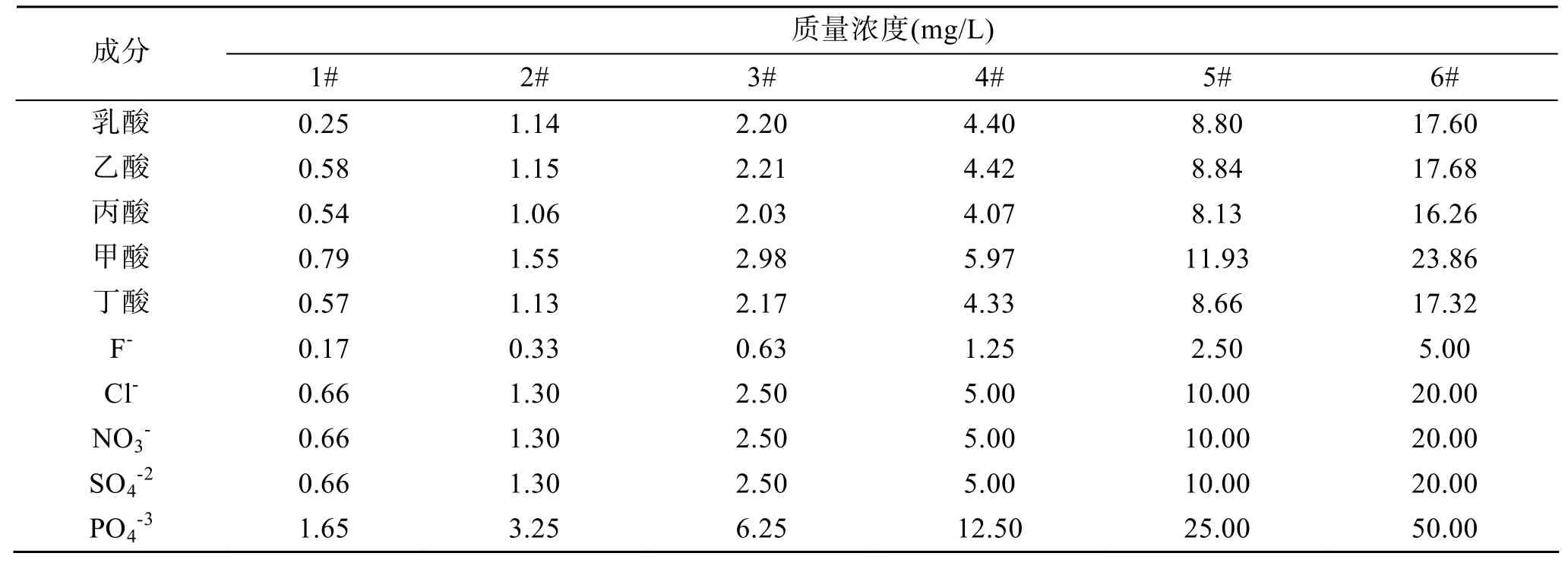
表1 混合标准溶液的质量浓度Tab. 1 Concentrations of standard solutions
2.3 色谱条件
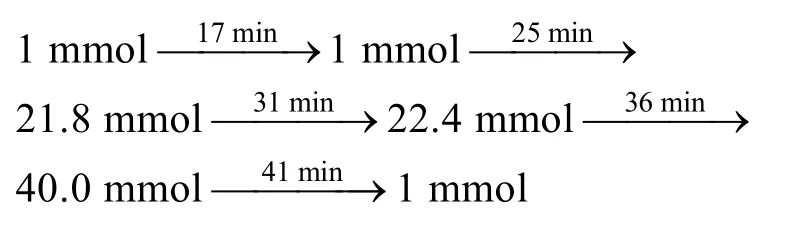
IonPac AS11阴离子交换柱, 包括分析柱(250 mm×4 mm)和保护柱(50 mm×4 mm)。采用梯度淋洗,流速1 mL/min, 柱温30 ℃, 进样体积 25 μL 。梯度淋洗程序见表2。

表2 梯度淋洗程序Tab. 2 Gradient profile for separation
3 结果与讨论
3.1 色谱条件的选择
样品的有效分离受到色谱柱和淋洗液的影响十分明显。作者选用固定相为接枝型阴离子交换聚合物的IonPac AS11型阴离子交换柱, 基核是表面胺化的乙基乙烯基苯的聚合物, 亲水性较强。接枝季胺基可以控制厚度, 导致快速的质量传递而得到较高的色谱柱效。KOH中的 OH-是强亲水性离子, 容易进入树脂亲水区, 以 KOH为淋洗液, 能同时分离与树脂亲和力不同的阴离子, 并且抑制产物是水, 本底电导比较低[17]。由于无机阴离子与固定相的亲和力远远大于小分子质量的有机酸根离子, 故不易洗脱。为使10种离子在一定的时间内完全洗脱, 故采用梯度淋洗方法。由试验得知, 丙酸、甲酸、丁酸在淋洗液浓度5~10 mmol时可得到良好的分离且峰形尖锐。但乳酸、乙酸的出峰时间接近, 分离度不到 1, 氟离子对乳酸有干扰, 因此使用较小浓度淋洗液洗脱,可达到理想的分离效果。由于无机阴离子和固定相的结合力较强, 因此用大浓度淋洗液洗脱。采用0.1~2 mL/min不同流速做分离, 对组分的分离效果影响不大。经过反复试验, 确定最佳条件为流速1 mL/min, 梯度洗脱程序:
3.2 方法的准确度和精密度
实验测得有机酸的线性相关系数均大于 0.99, 混合标准溶液(甲酸5.97 mg/L、乙酸4.42 mg/L、乳酸4.40 mg/L、丙酸4.06 mg/L、丁酸4.33 mg/L、磷酸根12.50 mg/L、硫酸根5.00 mg/L、硝酸根5.00 mg/L、氯离子5.00 mg/L、氟离子1.25 mg/L)连续进样6次, 测得有机酸的相对标准偏差均小于2%。结果见表3。
3.3 样品分析
标准溶液的色谱图如图1。由图1可见, 在梯度洗脱程序下, 乳酸、乙酸和氟离子得到较好分离, 峰形尖锐。其他无机阴离子不干扰有机酸的测定。
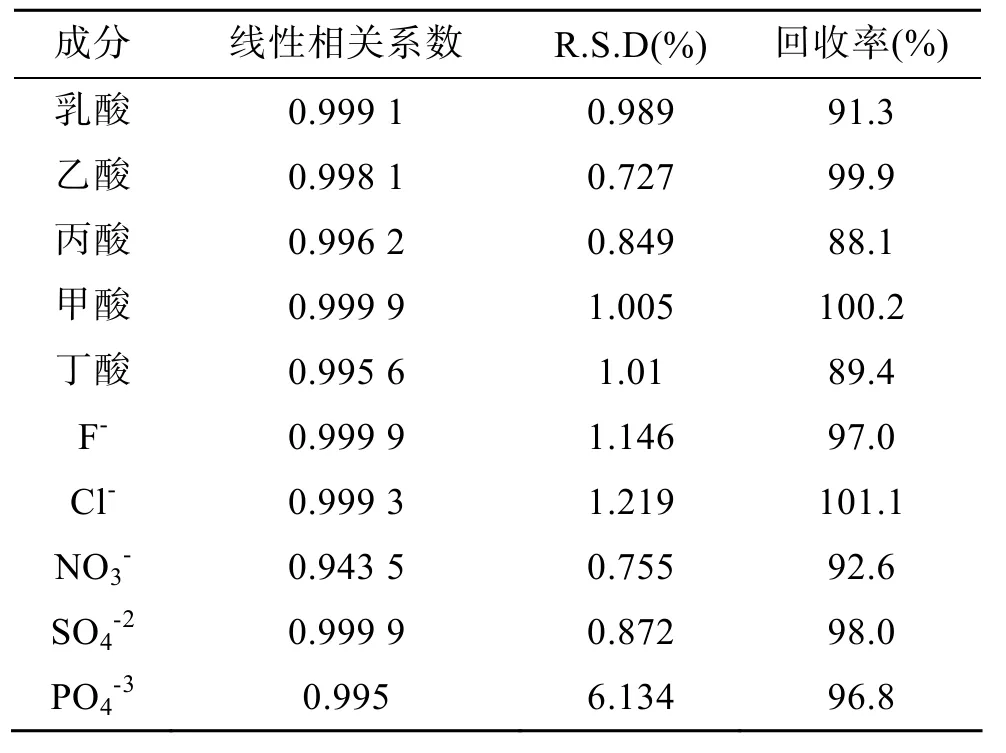
表3 线性相关系数、相对标准偏差、回收率Tab. 3 Correlation coefficients, relative standard deviations, and revoveries
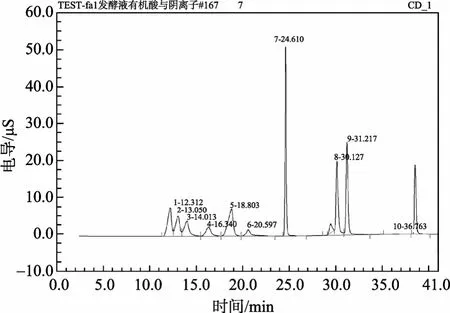
图1 6#混合标准溶液的色谱图Fig. 1 Chromatograms of a mixture of No. 6
有机酸的相对标准偏差为 0.73%~1.01%, 加标回收率为 88.1%~100.2%; 无机阴离子的平均相对标准偏差为2.03%, 加标回收率为92.6%~101.1%。
本方法用于嗜热厌氧菌热纤梭菌发酵液中乙酸、乳酸的测定。图2为培养时间为18 h发酵液的色谱图。发酵时间分别为3 h、6 h、18 h、24 h、40 h的测定结果如表4。作者也用试剂盒作了乙酸和乳酸的测定。虽然灵敏度也很高, 可达到5×106以下, 但该法不能同时分析多种有机酸, 且成本较高。
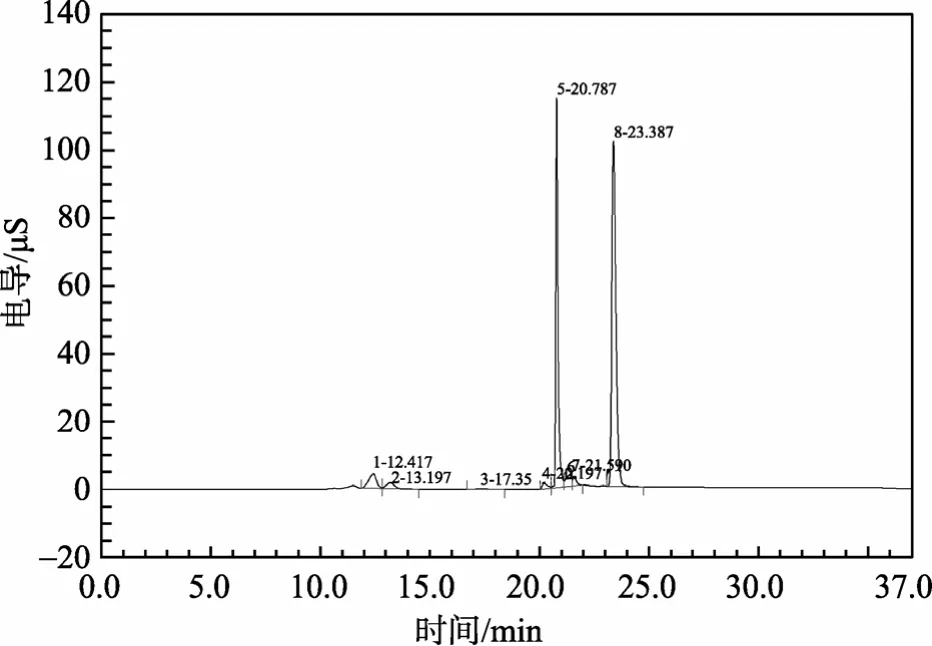
图2 嗜热厌氧菌培养时间为18 h样品的色谱图Fig. 2 The chromatogram of the sample with a fermentation time of 18 h
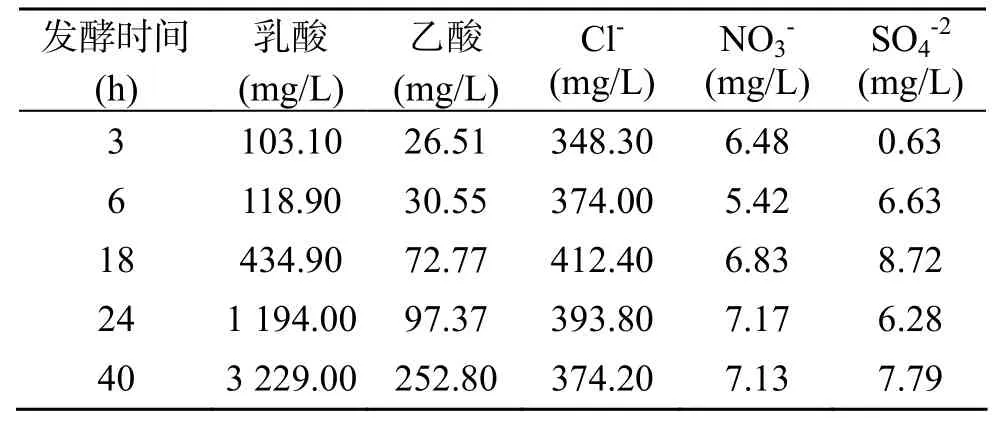
表4 原样品分析结果Tab. 4 Results of original samples
4 结语
离子色谱法可同时测定嗜热厌氧菌热纤梭菌发酵液中的有机酸和无机阴离子, 本文所用方法相关性好, 排除了氟离子等其他无机阴离子的干扰, 为发酵工艺过程中技术监控和质量控制提供了有效的分析方法。
[1] Loret M O, Pedersen L, Francois J. Revised procedures for yeast metabolites extraction: application to a glucose pulse to carbon-limited yeast cultures, which reveals a transient activation of the purine salvage pathway[J]. Yeast, 2007, 24(1): 47-60.
[2] Antoniewicz M R, Kraynie D F, Laffend L A,et al.Metabolic flux analysis in a nonstationary system:Fed-batch fermentation of a high yielding strain of E.coli producing 1,3-propanediol[J]. Metabeng, 2007,9(3): 277-292.
[3] Teusink B, Wilersma A, Molenaar D, et al. Analysis of growth of lactobacillus plantarum WCFS1 on a complex medium using a genome-scale metabolic[J].Model Chem, 2006, 281: 40 041-40 048.
[4] Geng Xiu-mei, Zhang Su-fang, Wang Qian, et al. De-termination of organic acids in the presence of inorganic anions by ion chromatography with suppressed conductivity detection[J]. Journal of Chromatography A, 2008, 1192: 187-190.
[5] 钱兵, 章燕, 李莎, 等. 反相高效液相色谱法测定丙酸发酵液中的有机酸[J]. 分析化学研究简报, 2007,35(11): 1 651-1 653.
[6] Dan B, Sara H N, Sofia A E, et al. Analysis of low molecular mass organic acids in natural waters by ion exclusion chromatography tandem mass spectrometry[J].Journal of Chromatography A, 2007, 1176: 89-93.
[7] Destandau E, Vial J, Jardya A, et al. Development and validation of a reversed- phase liquid chromatography method for the quantitative determination of carboxylic acids in industrial reaction mixtures[J]. Journal of Chromatography A, 2005, 1088: 49-56.
[8] Chen S F, Mowery R A, Castleberr V A, et al.High-performance liquid chromatography method for simultaneous determination of aliphatic acid, aromatic acid and neutral degradation products in biomass pretreatment hydrolysates[J]. Journal of ChromatographyA, 2002, 1104: 54-61.
[9] Chinnici F, Spinabelli U, Riponi C, et al. Optimization of the determination of organic acids and sugars in fruit juices by ion-exclusion liquid chromatography[J]. Journal of Food Composition and Analysis, 2005, 18: 121-130.
[10] 丁明玉, 陈培榕, 罗国安. 离子色谱法同时分析董酒中的有机酸与无机阴离子[J]. 色谱, 1998, 16(1):59-61.
[11] Agnieszka K, Velichka Kontozova-Deutsch, László B, et al. Single-run ion chromatographic separation of inorganic and low-molecular-mass organic anions under isocratic elution: Application to environmental samples[J]. Talanta, 2009, 79: 16-21.
[12] George T C, Katherine D H. Novel ion chromatography technique for the rapid identification and quantification of saturated and unsaturated low molecular weight organic acids formed during the Fenton oxidation of organic pollutants[J]. Journal of Chromatography A,2007, 1139: 95-103.
[13] Masson P. Influence of organic solvents in the mobile phase on the determination of carboxylic acids and inorganic anions in grape juice by ion chromatography[J].Journal of Chromatography A, 2000, 881: 387-394.
[14] Qiu Jin-shu, Jin Xiao-hong. Development and optimization of organic acid analysis in tobacco with ion chromatography and suppressed conductivity detection[J]. Journal of Chromatography A, 2002, 950:81-88.
[15] 屈峰, 刘克纳, 牟世芬. 离子色谱法同时测定柠檬酸发酵液中无机阴离子和有机酸[J]. 环境化学, 1995,14(5): 466-470.
[16] 胡维胜, 汪东风, 刘源源, 等. 离子色谱法分析麦汁和啤酒体系中 9种有机酸含量的研究[J]. 安徽农业科学, 2007, 35(4): 947-948.
[17] 林华影, 林风华, 盛丽娜, 等. 淋洗液自动发生-离子色谱法同时测定食品中的 21种有机酸[J]. 色谱,2007, 25(1): 107-111.
Received: Dec., 2, 2009
Key words:ion-chromatography; gradient elution; organic acid; fermentation broth
Abstract:Simultaneous separation of ten anions, including formate, acetate, lactate, phosphate, and sulfate, had been investigated using ion chromatography. The samples were prepared through filtration and clean-up column before analysis. Analysis was performed on an IonPac AS11 column coupled to a suppressed conductivity detector,with an injection volume of 25 μLand a flow rate of 1mL/min, The relative standard derivations of organic acids were 0.73%~1.01%. Analyte recoveries observed for triplicate analysis ranged from 88.1% to 101.2%. This method had been applied to determine low-molecular- weight organic acids and inorganic anions in Aerobic Microbes fermentation broth with satisfactory results.
(本文编辑:梁德海)
Simultaneous determination of organic and inorganic anions in Aerobic Microbes fermentation broth by ion chromatography
FA Yun, ZHANG Cong, YANG Hai-yan, BAO Yan, QIN Yong
(Key Laboratory of Bio-fuels, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Science, Qingdao 266101, China)
O658
A
1000-3096(2010)11-0023-04
2009-12-02;
2010-03-05
法芸(1975-), 女, 山东胶南人, 硕士, 高级工程师, 研究方向为化学分析, 电话: 0532-80662692, E-mail: fayun@qibebt.ac.cn
