新疆大叶紫花苜蓿两种再生体系的比较
2010-09-20施莉娟蒲小鹏
施莉娟,许 雷,温 洋,蒲小鹏*
(1.甘肃农业大学草业学院,兰州 730070;2.中国农业科学院研究生院,北京 100081)
豆科牧草是最具有经济价值和营养价值牧草之一,紫花苜蓿由于具有营养丰富、适应性强、改土固氮等多个优点被人们冠以“牧草之王”的美称[1]。近年来随着DNA重组技术和转基因技术的广泛利用,有关抗性紫花苜蓿新品种的研究也越来越多。国外已有将外源基因导入紫花苜蓿获得再生植株的报道[2-4]。异源目的基因的高效遗传转化有赖于植物高频再生体系的建立[5],目前虽然已经有许多学者对紫花苜蓿的组织培养进行了大量的研究工作[6-7],许多实验室也已经成功建立了自己的紫花苜蓿再生体系,但大多数都是通过先诱导愈伤组织,然后诱导再生芽和根的途径获得再生植株[8],普遍存在再生周期长、再生频率低等不足[9]。作为基因转化的受体系统,必须克服这些缺点才能使通过基因转化途径改良性状取得实质性进展[10]。本研究通过对两种再生途径各个指标的比较,选择出一种相对快速并且高效的再生方式,为今后通过基因转化改良紫花苜蓿性状建立稳定高效的再生体系作准备。
1 材料与方法
1.1 供试材料
试验研究材料为新疆大叶紫花苜蓿(Medicago sativa L.cv.Xinjiang Daye)品种,种子由甘肃农业大学曹致中教授提供。
1.2 培养基组成
试验中所用培养基成分如下:①基本培养基为MS培养基,蔗糖3%,pH 5.8,附加不同激素,高温灭菌;②愈伤诱导培养基:MS+2,4-D 2.0 mg·L-1+KT 0.5 mg·L-1+琼脂 9 g·L-1;③ 分化培养基 1: MS+6-BA 0.5 mg·L-1L+NAA 0.05 mg·L-1+琼脂 9 g·L-1;④ 分化培养基 2:MS+5 μmol·L-1TDZ+0.5 mg·L-1NAA+琼脂0.8%;⑤生根诱导培养基:1/2MS+IBA 1 mg·L-1+蔗糖 1.5%+琼脂 0.8%。
1.3 培养方法
1.3.1 胚胎发生途径
1.3.1.1 外植体的获得
选择籽粒饱满、有光泽的种子在流水下冲洗1 h,在超净工作台用70%的酒精浸泡50 s,无菌水冲洗3~5次,再用10%的次氯酸钠震荡处理30 min,无菌水冲洗6~8次,无菌滤纸吸干。将消过毒的苜蓿种子接种至不含激素的MS培养基上,培养室培养(光照培养,强度为1 000~2 000 lx,昼夜温度为25℃左右)。20 d后取无菌幼苗的叶片作为试验用外植体。
1.3.1.2 愈伤组织的诱导
参照梁慧敏等[11]、王瑞云等[12]方法,将20日龄的无菌苗叶片切成0.5 cm2左右的小块接入愈伤诱导培养基[13],每20 d继代一次,培养条件为黑暗培养20 d后光照培养10 d;光周期16 h,光照强度1 000~2 000 lx,昼夜温度为25℃左右。记录外植体愈伤产生时间,30 d后统计出愈率、正常的愈伤组织率。
1.3.1.3 丛生芽的分化
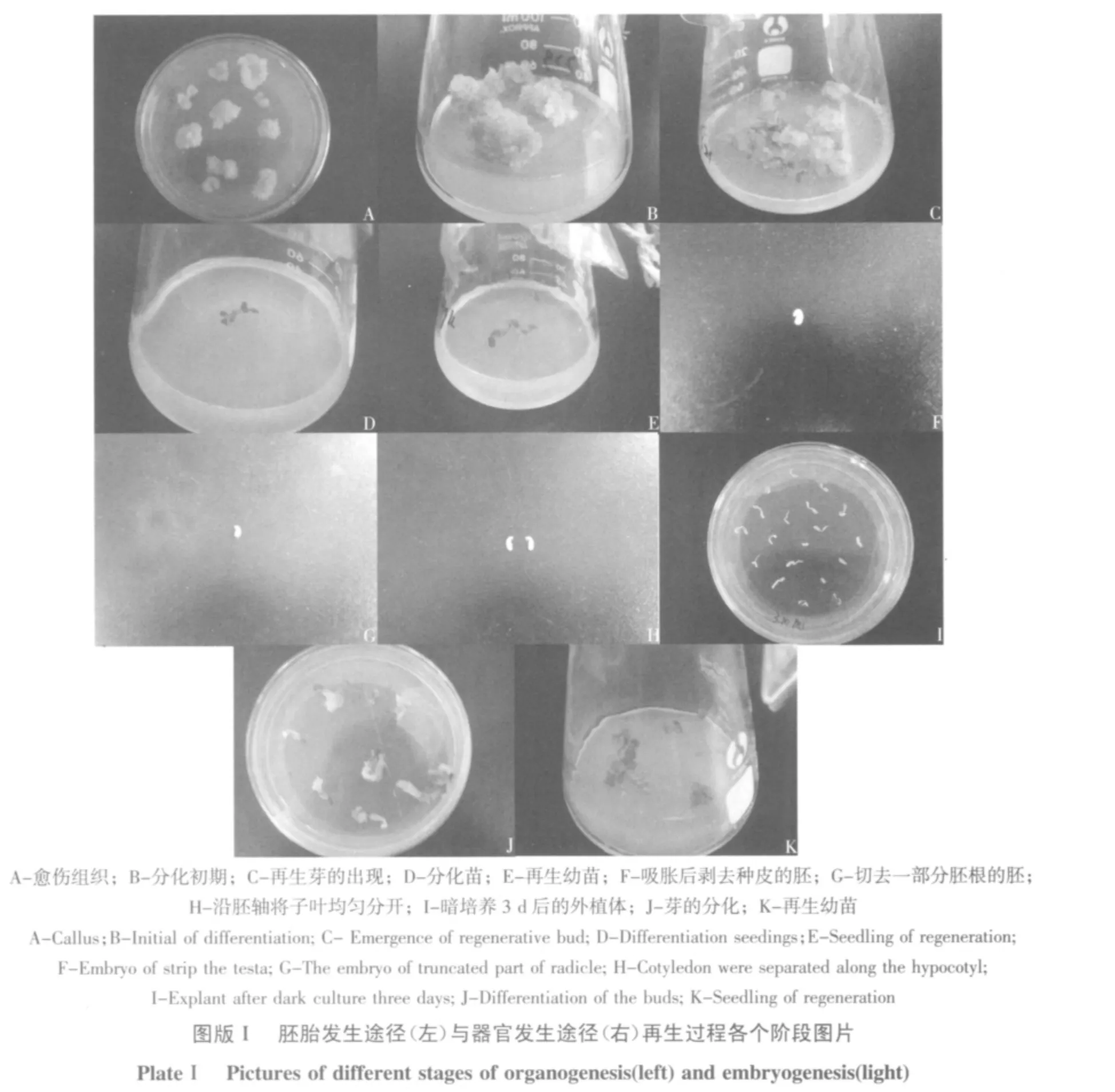
愈伤组织经过30 d的诱导,淘汰褐色的愈伤,筛选出呈黄白色、浆糊状、水分含量高、表面有突起的组织(见图版Ⅰ-A)接入分化培养基,一段时间之后,浆糊状的胚状体上出现许多绿色小颗粒(见图版Ⅰ-B),当成团状的胚状体长得较大时,可将其分割培养,有利于体胚分化。每20 d继代一次。培养条件为光周期16 h,光照强度1 000~2 000 lx,昼夜温度为25℃左右。记录出芽时间,统计芽分化率和单个组织生芽数(见图版Ⅰ-C)。
1.3.1.4 根的诱导
待分化苗(见图版Ⅰ-D)长至1 cm高时,在节间下部处将幼芽切下,移入生根培养基,每20 d继代一次,记录生根时间,统计生根率及单个幼苗生根数(见图版Ⅰ-E)。
1.3.2 器官发生途径
1.3.2.1 外植体的获得
在灭过菌(方法同上)的种子中加入约50 mL的无菌水,置于黑暗中温育过夜。第2天,在超净台上用解剖针将萌动的种子拨去种皮(见图版Ⅰ-F),切去一部分胚根(见图版Ⅰ-G),再将子叶从中间沿胚轴均匀平滑的分开(见图版Ⅰ-H),作为本试验的两个外植体。将带胚轴的子叶置于无激素的MS培养基中,暗培养3 d。
1.3.2.2 丛生芽的分化
参照许仕珍[14]的方法,将暗培养3 d后出芽的外植体(见图版Ⅰ-I)转入分化培养基2,送入培养室,培养条件为光周期16 h,光照强度1 000~2 000 lx,昼夜温度为25℃左右。20 d继代一次。记录出芽时间,25 d以后,统计出芽率及单个外植体产生再生芽的数量。
1.3.2.3 根的诱导
参照马晖玲等方法[15],将生长了一个月的丛生芽(见图版Ⅰ-J)切开,把单个的再生芽转入生根诱导培养基,记录生根时间,20 d以后,统计生根率、单个幼苗(见图版Ⅰ-K)生根数。
1.4 再生频率的统计
紫花苜蓿从接种外植体到再生植株需要一段不短的时间,同时涉及好几个关键阶段,因而,评价苜蓿的再生频率必须从这几个阶段综合考虑。在理想状态下(不考虑在试验中因人为操作引起的污染等其他影响试验结果统计的因素),用如下公式计算再生频率[14]:
器官形成途径:再生频率(%)=外植体萌发率(%)×芽的分化率率(%)×平均单个外植体生芽数(个)×生根率(%)×平均单个幼苗生根数(个);
胚胎发生途径:再生频率(%)=出愈率(%)×芽的分化率率(%)×平均单个外植体生芽数(个)×生根率(%)×平均单个幼苗生根数(个);
其中:外植体出芽率(%)=萌发的材料数/接种的外植体数×100%;
出愈率(%)=诱导出愈伤组织的外植体数/接种的外植体数×100%;
芽的分化率(%)=分化出芽的材料数/接种的材料总数×100%;
平均单个外植体生芽数(个)=分化的丛生小芽总数/从生芽总数;
生根率(%)=生根的幼苗数/接种的幼苗总数×100%;
平均单个幼苗生根数(个)=诱导生出的根总数/生根幼苗数。
2 结果与分析
2.1 再生时间的比较
本试验中新疆大叶紫花苜蓿再生幼苗的生成,两种途径所用时间相差明显,器官形成途径中从种子消毒到再生幼苗的生成所需的时间为69 d左右(种子处理1 d+外植体预培养3 d+芽分化培养约25 d+生根约20 d+再生幼苗培养约20 d≈69 d),而胚胎发生途径中从接种到再生幼苗的生成大约需要125 d(外植体的获得20 d+愈伤诱导约30 d+芽分化约45 d+生根约30 d≈125 d)。利用成熟种子胚的再生方式最大特点就是不通过愈伤组织,直接诱导苜蓿丛生芽,其最大的优点就是能快速地产生丛生芽,外植体接入芽分化培养基25 d后就可以用来生根。而传统的胚胎发生途径,外植体经过脱分化形成愈伤组织后经过再分化阶段,然后才是根的诱导形成植株,本试验中,两种再生方式在生根时间上差异不是很大,最显著的差异就是外植体的准备和芽分化上,本文中胚胎发生途径选择生长15~20 d时间的无菌苗叶片作为试验外植体,即使外植体选择准备时间较少的下胚轴也需要5~6 d,在这之后需要一个月左右的时间进行愈伤组织的诱导,从愈伤到分化出丛生芽又是一个很长的过程。而器官发生途径中外植体的获得仅需要1 d的种子预处理,接下来的过程又避开了愈伤组织诱导,25 d后就有丛生芽生出,并且每个芽又分离出好几个小芽,直接进入生根阶段,大大缩短了再生时间。显然,器官形成途径再生所需时间远远少于胚胎发生途径,使再生幼苗的完成节约了55 d左右。
2.2 再生频率的比较
从表1看出,新疆大叶紫花苜蓿器官发生途径中子叶外植体的再生频率(396.57%)是胚胎发生途径中叶片外植体再生频率(121.52%)的三倍多,最主要的差距还是在芽分化率上,器官发生途径可以在较短的时间(约69 d)内达到较高的分化率,而传统的胚胎发生途径经过脱分化形成愈伤、再分化形成植株这样一个漫长的过程后(约125 d),得到的再生频率反而不是很理想,这也再次体现了紫花苜蓿再生体系的建立周期长、频率低的特点。

表1 两种再生途径各项再生指标及再生频率的比较Table1 Comparison of regeneration index and regeneration rate of two difference regeneration ways
3 讨论与结论
直接诱导丛生芽的再生途径具有再生周期短(69 d左右)、再生频率高(396.57%)的特点,而传统的再生方式大多数都是通过先诱导愈伤组织,然后诱导再生芽和根的途径获得再生植株,苜蓿愈伤再生成苗的主要问题是愈伤分化率偏低,不能满足进行高效遗传转化研究的需要[16]。相比之下,器官发生途径利用成熟种子的胚直接诱导丛生芽分化成苗,此过程不需要诱导愈伤,无论是再生周期还是再生频率都具有明显优势。用此种方式再生紫花苜蓿的报道国内较少,研究不是很成熟,但是鉴于此方法的诸多优点,有必要更进一步完善这一体系,以建立一套普遍适用的快速高效的紫花苜蓿再生体系,并推广应用到其他植物中去[14],这对将来的分子生物学研究具有重大的现实意义。
[1]马海燕,张博,郝兴明,等.新疆苜蓿愈伤组织再生体系建立的研究[J].新疆农业科学,2005,42(1):19-23.
[2]李进军,吴跃明,朱诚,等.苜蓿遗传转化的研究进展[J].四川草原,2005(3):20-23.
[3]梁慧敏,夏阳,孙仲旭.根癌农杆菌介导苜蓿遗传转化体系的建立[J].农业生物技术学报,2005,13(2):152-156.
[4]Su Y,Wang P W,Dong Y S.Process of biotechnologe in alfalfa[J].Molecular Plant Breeding,2004,2(5):733-739.
[5]潘竟丽,曾幼玲,张富春.新疆大叶紫花苜蓿(Medicago sativa.L.cv.Xinjiang Daye)子叶、下胚轴、根的植株再生[J].中国农学通报,2007,23(6):51-56.
[6]王强龙,王锁民,张金林,等.紫花苜蓿体细胞胚高频再生体系的建立[J].草业科学,2006,23(11):21-27.
[7]黄远新,谭鹃,黄玉兰,等.紫花苜蓿离体叶片愈伤组织诱导的研究[J].草业与畜牧,2008(6):1-10.
[8]钱谨.紫花苜蓿高频再生体系的建立及农杆菌介导的木霉几丁质酶基因转化的研究[D].兰州:甘肃农业大学,2006.
[9]王凭青,周兴龙,杨青川,等.紫花苜蓿高频再生组织培养体系建立[J].重庆大学学报:自然科学版,2005,28(2):132-136.
[10]梁美霞,刘守伟,李景富.农杆菌介导的番茄遗传转化研究进展[J].东北农业大学学报,2004(2):118-122.
[11]梁慧敏,黄剑,夏阳,等.苜蓿组织培养高频率再生体系的建立[J].农业生物技术学报,2003,11:321-322.
[12]王瑞云,岳文斌,任有蛇.不同苜蓿品种对叶片愈伤组织诱导及植株再生的影响[J].中国草地,2004,26(2):36-43.
[13]郑宝仁,王洪军,卢宝伟.苜蓿子叶节离体培养体系的研究[J].东北农业大学学报,2008,39(10):33-38.
[14]许仕珍.紫花苜蓿不同再生体系的比较及农杆菌介导的ATNHX1基因转化研究[D].兰州:甘肃农业大学,2006.
[15]马晖玲,卢欣石,曹致中,等.紫花苜蓿不同栽培品种植株再生的研究[J].草业学报,2004,13(6):99-105.
[16]张万军,王涛.紫花苜蓿愈伤成苗高频再生体系的建立及其影响因子的研究[J].中国农业科学,2002,35(12):1579-1583.
