辣椒素生物合成途径基因pal克隆及原核表达分析
2010-09-20郭庆勋阮文渊怀凤涛郝宏智
郭庆勋,阮文渊,怀凤涛,郝宏智
(1.吉林大学植物科学学院,长春 130062;2.东北农业大学园艺学院,哈尔滨 150030)
辣椒是全世界范围内被广泛消费的蔬菜和香料之一。其主要的辛辣成分是辣椒素(Capsaicin),辣椒素的化学名称为反-8-甲基-N-香草基-6-壬烯基酰胺[1]。辣椒的次生代谢物辣椒素类物质(Capsaicinoides)是一种机制独特的植源性抗癌新药的合成前体。辣椒素的药理作用包括预防心血管疾病,预防和治疗消化道疾病,止痛、抗癌和减肥等[2]。在临床上常用于治疗带状疱疹后遗症所致的神经痛、坐骨神经痛、糖尿病性神经痛等疾患,另外,对于预防老年人吸入性肺炎、腰痛、血尿综合征以及银屑病也有显著疗效[3-4]。但另外的一些研究显示[5],辣椒素可以阻止一些化学致癌物在体内的活化或者将这些化学致癌物去除的能力,因此辣椒素可作为一种化学保护剂。
目前的研究还没有明确辣椒素生物合成路径的调控机制,包括关键基因的定位、克隆和调控的分子机理,相关基因启动子的分离和调控作用。辣椒素作为一种天然植物中的有效成分,其来源广泛,且不良反应较化学合成药物要少。辣椒素具有相当广泛的药理作用,辣椒素在各种疾病的预防和治疗方面已经得到了应用[6]。但是目前对涉及辣椒素生物合成的许多酶类缺乏研究,且其合成路线也未完全研究清楚,只做了部分数量有限的研究。如Charles等总结了辣椒素的生物合成途径,此途径由香草基胺和C9~C10支链脂肪酸两部分组成[7-8]。参与辣椒素合成途径中目前已知的酶有:苯丙氨酸裂解酶、肉桂酸水解酶、对香豆酸水解酶和咖啡酸转甲氧基酶,其中苯丙氨酸裂解酶(Phenylalanine Ammonia-lyase,PAL)是香草基胺支链的第一个酶,Mazourek等克隆了该序列[9]。
为此,如何有效提高辣椒素的生物合成量已成为广大科研工作者关注的焦点。本文则根据pal基因保守序列设计引物,通过PCR扩增得到了辣椒益都红的pal核苷酸序列。利用苯丙氨酸裂解酶在原核T7强启动子作用下的高效表达,重组苯丙氨酸裂解酶的获得为其作用机理及辣椒素合成代谢调控机制的研究提供了基础。
1 材料与方法
1.1 材料
以辣椒益都红胎座组织为试验材料;克隆菌株为大肠杆菌(Escherichia coli)Top10,为本实验室保存;原核表达载体为pET-32a,由吉林大学张世宏教授馈赠;原核表达菌株为E.coli BL21(DE3),由吉林大学原亚萍教授馈赠。
1.2 试剂
PfuDNA聚合酶(2.5 U·μL-1)(购自 MBI公司),高纯 dNTP(2.5 mmol·L-1)和克隆载体 pGM-T Easy vector(均购自天根生化科技(北京)有限公司);RNA提取试剂RNAiso Reagent与核酸限制性内切酶(购自TaKaRa公司);反转录试剂盒,Biospin胶回收试剂盒,质粒提试剂盒(购自BioFlux公司);引物(合成于南京金思特科技有限公司);丙烯酰胺(Acr)及甲叉双丙烯酰胺(Bis)(购自 Bebco公司);过硫酸铵(AP)及四甲基乙二胺(TEMED)(购自Sigma公司);DNA Marker(购自上海生物工程技术服务有限公司);低分子质量标准蛋白(购自天根生化科技(北京)有限公司);其余试剂为国产分析纯。
1.3 方法
1.3.1 RNA的提取和cDNA模板的制备
用RNAiso Reagent提取辣椒胎座总RNA,经核酸测定仪和琼脂糖电泳确认质量和产量后,于-20℃保存备用。反转录cDNA的制备参照BioFlux公司反转录试剂盒说明书。
1.3.2 pal基因的克隆
根据GenBank中已登录的pal基因保守序列,设计1对带有酶切位点的特异引物,即,PAL-F:5'CGGAATTCATGGCATCAACAATTGCAC 3'(下划线部分为Eco RⅠ酶切位点)和PAL-R:5'TTGCG GCCGCCTAACAGATTGGAAGGGGAG 3'(下划线部分为NotⅠ酶切位点),进行PCR扩增,其PCR反应体系及条件:10×PCR PfuDNA聚合酶Buffer with MgSO42.5 μL,引物(10 pmol·μL-1)各 1 μL,dNTP(2.5 mmol·L-1)2 μL,PfuDNA 聚合酶(2.5 U·μL-1)0.5 μL,模板 cDNA(60 ng·μL-1)1 μL,ddH2O 17 μL。反应程序为:95℃预变性5 min,94℃变性30 s,53℃退火30 s,72℃延伸4 min,35个循环;72℃延伸10 min,4℃保存。扩增产物克隆于pGM-T Easy载体上,转化大肠杆菌Top10感受态细胞。载体连接反应体系为:T4Ligase buffer 1 μL,T4Ligase(350 U·μL-1),pGM-T Easy vector(50 ng)1 μL,PCR 产物(60 ng)7 μL,ddH2O 补至10 μL,16℃连接过夜。转化后的大肠杆菌Top10在37℃、180 r·min-1的摇床上振荡培养1.5 h之后,吸取100 μL菌液至LB固体培养基(Amp 100 mg·L-1,IPTG 0.5 mmol·L-1,X-gal 40 mg·L-1)上,37℃培养过夜。挑取白色单菌落,经PCR与Eco RⅠ/NotⅠ双酶切鉴定后送上海生物工程技术服务有限公司测序。
1.3.3 pal基因的生物信息学分析
对测序得到的核酸序列和推导的氨基酸序列分别用BLASTn和BLASTp进行相似性搜索,用DNAMAN 4.0绘制序列聚类图。
1.3.4 原核表达载体pET-32a-pal的构建
将pGM-pal阳性克隆质粒经核酸限制性内切酶Eco RⅠ/NotⅠ双酶切后回收pal片段与经Eco RⅠ/NotⅠ双酶切的pET-32a载体连接。酶切体系为:10×K Buffer 2 μL,Eco RⅠ/NotⅠ各 1 μL,ddH2O补至20 mL,37℃酶切5 h。连接体系:T4Ligase(350 U·μL-1)1 μL,经 Eco RⅠ/NotⅠ酶切的 pET-32a 载体(20 ng)2 μL,回收片段 pal(100 ng)5 μL,ddH2O补至10 μL,16℃过夜连接。转化大肠杆菌Top10的方法步骤同1.3.2。将挑取的单菌落进行菌液PCR鉴定后,再将PCR阳性菌落进行Eco R I/Not I酶切鉴定。将阳性菌落扩摇提取质粒,于-20℃保存备用。
1.3.5 原核表达条件的优化及SDS-PAGE电泳检测
将pET-32a-pal转化BL21感受态细胞,转化步骤同 1.3.2。挑取阳性菌落 200 r·min-1摇 10~12 h,按10%的接种量进行扩摇,当菌液OD值约0.8左右时,冰浴20~30 min后加入不同 IPTG浓度,在不同温度条件下诱导不同的时间。收集1.5 mL菌体经PBS洗涤后加入蛋白上样缓冲液煮沸15 min,12 000 r·min-1离心10 min后将上清与沉淀分开,分别于-20℃保存备用。将上述蛋白样品进行SDS-PAGE电泳检测,浓缩胶(5%)电泳电压80 V,分离胶(12%)电泳电压160 V。
2 结果与分析
2.1 辣椒pal基因的克隆与测序
2.1.1 pal基因RT-PCR扩增
以益都红胎座总RNA的反转录产物为模板,用PAL-F/PAL-R为引物进行RT-PCR扩增。RTPCR产物经1.0%琼脂糖凝胶电泳检测到一条约2 200 bp的特异扩增条带,与预期结果相符(见图1)。
2.1.2 重组质粒PCR检测及酶切鉴定
挑取白色菌落培养,提取质粒经PCR扩增得到约2 200 bp的目的条带,质粒经NotⅠ和Eco RⅠ双酶切,得到约2 200 bp的目的条带和2 700 bp的载体条带,说明目的基因已克隆到pGEM-T载体中(见图2)。
以益都红胎座cDNA为模板,扩增出了1条约2 200 bp目的条带(见图1)。测序结果表明,该片段的实际长度为2 157 bp。

图1 PCR产物电泳分析Fig.1 Electrophoresis analysis of PCR product
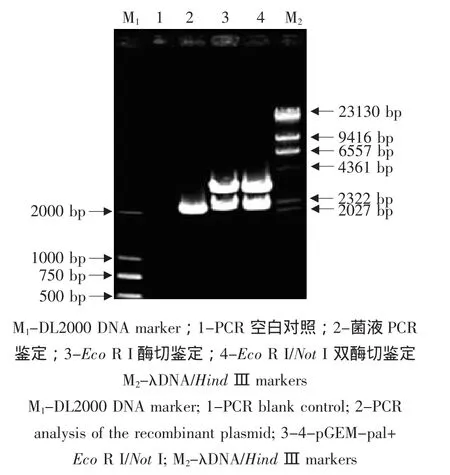
图2 重组质粒pGM-pal菌液PCR与双酶切鉴定Fig.2 PCR and restriction analysis of the recombinant plasmid pGM-pal
2.2 辣椒pal基因的序列分析
测序结果表明,该序列含有完整的开放阅读框,其碱基组成为G+C=44%,A+T=56%,翻译起始密码子为ATG,终止密码子为TAG,编码718个氨基酸(见图3)。该DNA序列与GenBank中登录的其他植物的pal基因同源性较高,大致分布在70%~90%。其中与 Capsicum chinese同源性达99%。
2.3 辣椒pal基因聚类分析
运用DNAMAN自带的Multiple Sequence Alignment程序分析了不同科属植物苯丙氨酸裂解酶的进化关系,建立了苯丙氨酸裂解酶的系统进化树(见图4)。结果表明,辣椒PAL与所选的14种植物的pal基因可归为双子叶、单子叶、和蕨类植物三类。蕨类植物与单子叶植物之间的同源性为57%,单子叶植物与双子叶植物之间的同源性为65%左右。而与同科同属的菜椒和朝天椒亲缘关系最近。

图3 辣椒pal基因核酸序列推导的氨基酸序列Fig.3 Protein sequence of pal gene from Capsicum annuum

图4 pal基因核苷酸序列聚类图Fig.4 Homology tree of nucleic acid sequence of pal gene
2.4 重组载体pET-32a-pal的鉴定
pGM-pal经Eco RⅠ/NotⅠ酶切后的pal片段与pET-32a酶切后连接转化大肠杆菌BL21,抗生素筛选后分别进行PCR鉴定和酶切鉴定,鉴定结果如图5所示,结果表明pET-32a-pal PCR的电泳结果产生2.2 kb左右的条带,双酶切后产生一条2.2 kb和5.4 kb左右的条带;双酶切产生的大片段与单酶切产生的片段相差约2.2 kb,与预期的结果相符。将阳性结果送上海生物工程技术服务有限公司进一步测序验证。
2.5 辣椒pal基因在E.coli中诱导表达的SDSPAGE分析
将包含pET-32a-pal的重组菌分别在不同诱导条件下培养,收集菌体煮沸15 min后上样进行SDS-PAGE,如图6~8所示,包含pal基因的重组菌诱导后在分子质量约为93 ku处有一条特异性表达条带。在对照菌中,BL21没有出现此蛋白表达;包含空载体pET-32a的菌诱导出现了一条约20 ku的特异条带,与预期相符;因此,试验组可能为目的表达产物,其分子质量大小(93 ku,等于pal分子质量73 ku加20 ku)与理论值(92.2 ku,预测网站 http://www.expasy.ch/tools/pi_tool.html)相符。由图6~8分析结果得出pET-32a-pal重组菌的最优诱导表达条件为:IPTG 0.3 mmol·L-1,温度28℃,时间6 h。

图5 重组质粒pET-32a-pal菌液PCR与酶切鉴定Fig.5 PCR and restriction analysis of the recombinant plasmid pET-32a-pal

图6 不同诱导温度条件下H-PAL融合蛋白在E.coli BL21(DE3)细胞中的表达检测Fig.6 SDS-PAGE analysis of the recombinant H-PAL protein expression in E.coli BL21(DE3)under different temperature

图7 不同IPTG诱导浓度条件下H-PAL融合蛋白在E.coli BL21(DE3)细胞中的表达检测Fig.7 SDS-PAGE analysis of the recombinant H-PAL protein expression in E.coli BL21(DE3)under different IPTG concentration
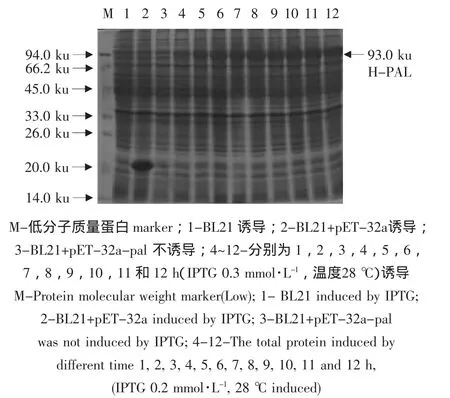
图8 不同诱导时间条件下H-PAL融合蛋白在E.coli BL21(DE3)细胞中的表达检测Fig.8 SDS-PAGE analysis of the recombinant H-PAL protein expression in E.coli BL21(DE3)under different time
3 讨论与结论
在辣椒素的生物合成途径中,苯丙氨酸裂解酶(PAL)是辣椒素合成的第一个酶,辣椒素分子结构中的苯环就来自苯丙氨酸。但辣椒在合成辣椒素的过程中对苯丙氨酸的利用效率是非常低的。Hall与Yeoman等研究报道表明仅有不到1%的苯丙氨酸最终参与合成辣椒素,大部分的酚类物质将转变为不溶于水的的细胞壁成分,约占50%~70%,25%~35%的转变为简单酚类、黄酮及水溶性的酯类,另外约有10%~20%苯丙氨酸生成蛋白质。另外,PAL在植物抗病方面具有重要作用[10]。目前关于PAL活性变化与植物抗病性的关系有3种看法:即正相关、负相关和无相关性。研究结果表明,苯丙氨酸解氨酶的活性变化与辣椒对白粉病的抗性尤其具有密切关系。受白粉菌侵染后,抗、感材料的PAL活性都上升,但是在非亲合互作中,PAL的活性变化量高于亲合互作中的变化量,因而PAL活性与菜椒白粉病抗病性存在正相关关系。
本试验获得的辣椒pal基因的片段长度与其他物种中己报道的苯丙氨酸解氨酶基因长度接近,且具有较高的相似度。与朝天椒、大圆茄等物种的苯丙氨酸解氨酶基因相同。此外,还对pal基因编码的氨基酸序列进行了一系列的生物信息学分析,与Mazourek等克隆的序列基本一致[9],同源性达99%。通过克隆pal基因与原核表达,为研究辣椒PAL的基因结构、生物活性、表达调控机制以及辣椒素的生物合成机制提供了基础。
[1]谭仁祥.植物成分功能[M].北京:科学出版社,2003:142.
[2]徐兵,李昕,张莉.辣椒素药理作用的研究进展[J].中南药学,2007,5(6):542-545.
[3]郭建明.辣椒的风味化学及其在调味品中的应用[J].中国调味品,1998(7):2-4.
[4]吴明光.新型长效镇痛药辣椒碱研究进展[J].中国新药杂志,1994,3(4):10-13.
[5]Callingham B B A,Lembeck F,Shacman D F.Biochem[J].Phacmaeol,1991(41):l863-1869.
[6]李竞芸.辣椒素类物质生物合成研究进展[J].河北农业科学,2009,13(11):46-48.
[7]Charles S,Mazourek M,Giulia M S,et al.Genetic control of pungency in C.chinense via the Pun1 locus[J].Journal of Experimental Botany,2007,58(5):979-991.
[8]Charles S,Kang B C,Liu K D,et al.The Pun1 gene for pungency in pepper encodes a putative acyltransferase[J].The Plant Journal,2005,42:675-688.
[9]Mazourek M,Pujar A,Borovsky Y P,et al.A dynamic interface for capsaicinoid systems biology[J].Plant Physiol,2009,150(4):1806-1821.
[10]HallRD,YeomanMM.The influence of intracellular pools of phenylalanine derivatives upon the synthesis of capsaicin by immobilized cell cultures of the chili pepper,Capsicum frutescens[J].Planta,1991,185:72-80.
