三国吴简蚀斑可培养微生物的多样性
2010-09-17
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
竹简是中国在晋以前档案的主要载体,对我国传统文明的传播起了至关重要的作用。湖南长沙简牍博物馆收藏了一批走马楼出土的三国时期吴国竹简,具有极为珍贵的史料价值。在出土后保存过程中,该批竹简爆发了一种竹简蚀斑病,竹简损害严重,白斑中的竹简竹体变为半透明膜状物质。胡东波等[1]从走马楼出土的带菌竹简浸泡液中分离出未知的M菌、桔青霉、黄曲霉、黑曲霉等霉菌和副球菌,通过对竹简被侵害的特征以及竹简蚀斑病爆发的环境条件进行分析,认为其中的霉菌M菌是造成竹简腐蚀斑的主要侵害菌;Zeng等[2]采用牛肉膏蛋白胨培养基从该批爆发蚀斑病的竹简中分离出10株细菌,其中菌株Be-2反接回废竹片,能使竹片的表面由原来的亮褐色变成黑褐色,且在竹片上形成的腐蚀斑与初始爆发的腐蚀斑相似。然而,目前还缺乏证据证明导致该批竹简发生蚀斑病的微生物的种群和分类地位,病原菌还未得到分离,其快速侵蚀竹简的机制更是未知。本研究以该批爆发蚀斑病的竹简浸泡液为原料,采用适于各种微生物生长的不同丰富培养基分离纯化其中的微生物,并对获得的纯培养进行多样性分析,以期为进一步研究不同种群微生物在竹简腐蚀过程中的作用提供依据。
1 材料和方法
1.1 培养基
牛肉膏蛋白胨:蛋白胨5 g,牛肉膏3 g,NaCl 5 g,琼脂15~20 g,蒸馏水1 000 mL。
高氏一号:KNO31 g,可溶性淀粉20 g,K2HPO40.5 g,MgSO4·7H2O 0.5 g,NaCl 0.5 g,FeSO4·7H2O 0.01 g,琼脂15~20 g,蒸馏水1 L。
查氏培养基:蔗糖 30 g,NaNO33 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·7H2O 0.01 g,K2HPO41 g,琼脂15~20 g,蒸馏水1 L。
1.2 菌株分离与纯化
将长沙简牍博物馆密封保藏的竹简浸泡液分别接种于牛肉膏蛋白胨、高氏一号以及查氏培养基进行富集培养。培养物以稀释平板法结合划线分离法在相应的固体平板上进行分离,直至获得各种微生物的纯培养为止。培养温度为30 ℃。
1.3 菌株基因组DNA提取、PCR扩增和序列分析
1.3.1 细菌16SrDNA PCR
采用菌落 PCR扩增所获得的细菌的部分16SrDNA片段,从固体平板上挑取单克隆,用solutionⅡ(10 μL 10% SDS,2 μL 40% NaOH,88 μL超纯水)裂解菌体,裂解液稀释后作为模板,引物为细菌16SrDNA通用引物(27F,1492R)[3]。
1.3.2 真菌18SrDNA和ITS PCR
真菌基因组DNA采用氯化苄法[4]提取,根据真菌18SrDNA 保守区域设计引物。ITS(包括 ITS1,5.8SrDNA,ITS2)序列用通用引物ITS4和ITS5[5]扩增,引物由上海生物工程有限公司合成。

1.3.3 序列分析
PCR产物经琼脂糖DNA回收试剂盒(天根,北京)切胶回收后,由上海生物工程有限公司完成测序。将得到的细菌16SrDNA、真菌18SrDNA以及ITS序列与NCBI中的核酸数据库进行Blast比对,利用Mega 4.0软件分析亲缘关系、构建系统发育树。
1.3.4 细菌多样性分析
定义16SrDNA序列相似性小于97%作为不同的分类单元,采用 Shannon Wienerps指数(以下简称Shannon多样性指数H)计算多样性[6]:

式中:s为物种(这里采用分类单元)数目;Pi为属于第i种的个体占全部个体的比例。
2 结果
2.1 菌株分离及形态特征
长沙简牍博物馆密封保藏的腐蚀竹简浸泡液经无菌操作接种于各种丰富培养基,富集培养、分离纯化后,共获得8株细菌以及1株霉菌的纯培养,分别命名为菌株B-1,B-2,B-3,B-4,B-6,B-7,B-8,B-9以及F-1。其菌落形态、革兰氏染色和菌体形态如表1所示。
2.2 细菌16SrDNA序列与多样性分析
2.2.1 16SrDNA序列分析
通过菌落PCR扩增得8株细菌的16SrDNA 1 500 bp左右片段,经测序获得相关序列,将这些序列与NCBI的核酸数据库进行Blast比对,结果如表2所示。所有分离得到的细菌 16SrDNA序列均与数据库中已知细菌的相关序列有较高的相似性(≥99%)。定义16SrDNA序列相似性低于 97%时作为不同分类单元进行多样性计算,结果表明分离得到的8株细菌可分为7个不同的分类单元,Shannon多样性指数为2.92。
2.2.2 细菌系统发育分析
基于分离细菌 16SrDNA序列基础上的系统发育分析结果(图 1)表明:这些细菌分别属于 4个不同的纲,包括α-Proteobacteria(1 株),β-Proteobacteria(3 株),γ-Proteobacteria(1 株)以及 Bacilli(3 株)。
结合菌落形态、细胞形态和基于分离细菌16SrDNA序列基础上的系统发育树分析,Bacilli纲的3株细菌中 B-1和B-3属于Bacillus,B-4为Staphylococcus,Bacillus是分离得到的优势细菌;β-Proteobacteria纲的菌株 B-6,B-8和 B-9分别属于Pandoraea,Cupriavidus和Comamonas;α-Proteobacteria纲的菌株B-7属于Novosphingobium;γ-Proteobacteria纲的菌株B-2属于Acinetobacter。

表1 各分离菌株形态学特征及革兰氏染色情况Table 1 Morphological characteristic of the isolated strains

表2 分离细菌16SrDNA序列分析Table 2 Analysis of partial 16SrDNA gene sequences of the isolated strains
2.3 真菌的分类鉴定
以氯化苄法提取霉菌F-1的基因组DNA,以此作为模板PCR扩增得到该菌的18SrDNA和ITS部分片段,经测序获得相关序列,将这些序列与NCBI的核酸数据库进行Blast比对,结果如表3所示。
从表3可知:霉菌F-1的18SrDNA和ITS 序列均与曲霉属(Aspergillus)有很高相似性(99%)。基于霉菌ITS序列的系统发育分析结果(图2)表明:霉菌F-1与Aspergillus的关系密切,由此将霉菌F-1归为曲霉属的1个种。
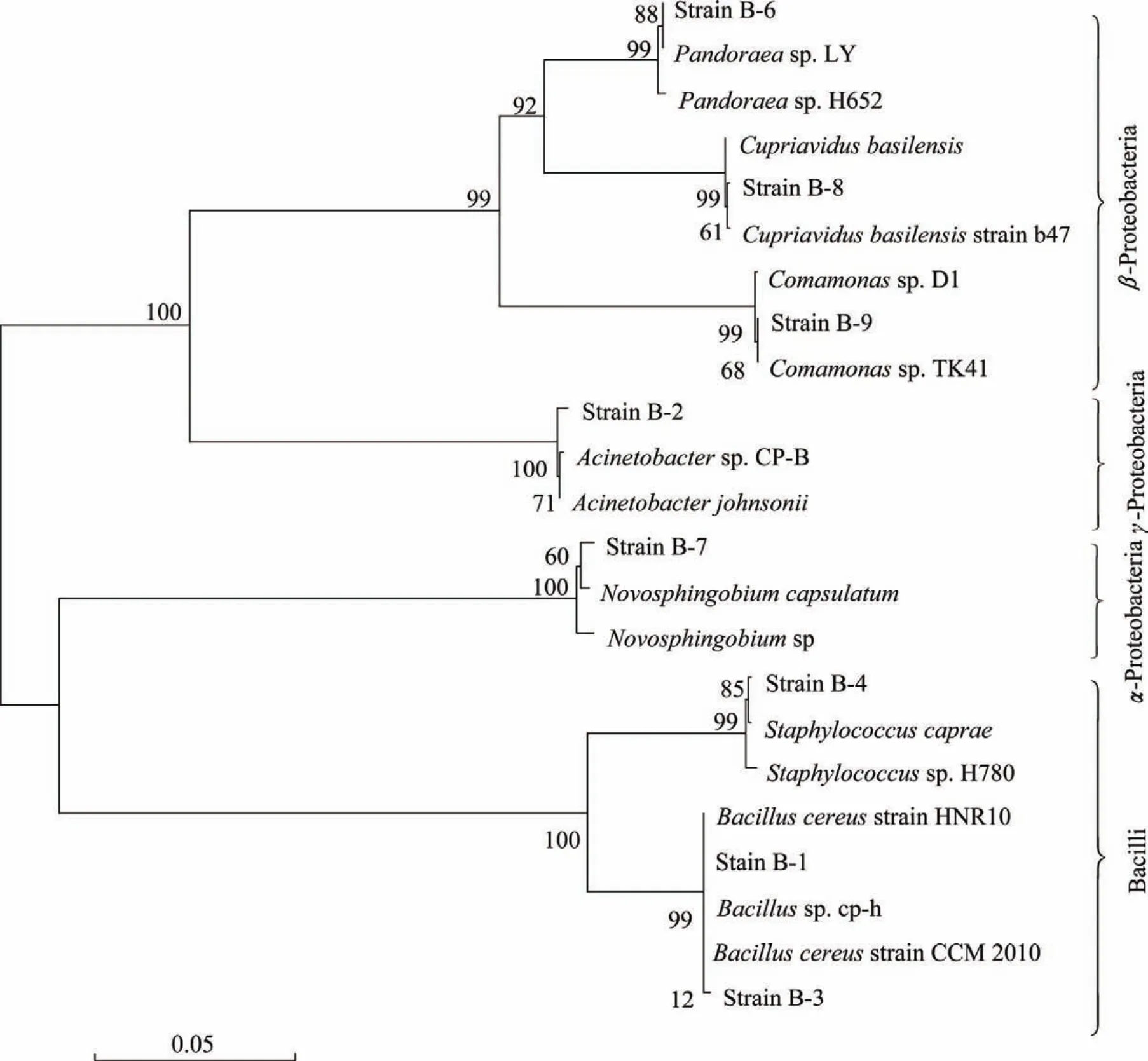
图1 基于分离细菌16SrDNA序列构建的系统发育树Fig.1 Phylogenetic analysis based on the 16SrDNA sequences of the isolated strains

表3 霉菌F-1 18SrDNA及ITS序列比对结果Table 3 Analysis of partial 18SrDNA and ITS of the isolated fungus
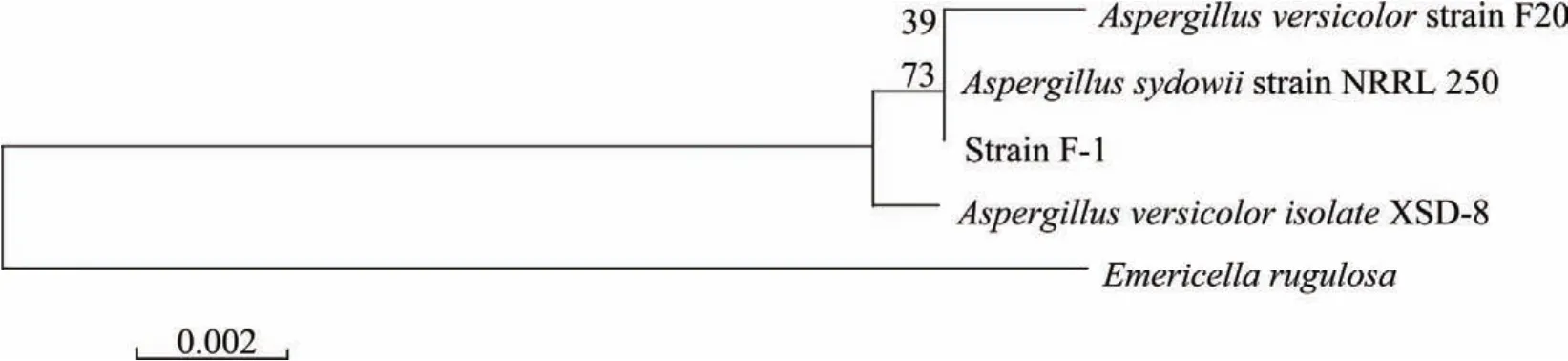
图2 基于霉菌F-1 ITS序列构建的系统发育树Fig.2 Phylogenetic tree based on the ITS sequences of the strain F-1
3 讨论
湖南长沙走马楼出土的竹简的竹材经鉴定为刚竹属,竹材主要成分为木质素、纤维素和半纤维素,另外还有少量的抽提物和灰分[7]。竹材的腐蚀是真菌、细菌共同作用的结果,吴开云等[8−10]分离了大量能引起竹材霉变的霉菌,而关于细菌在竹材腐蚀中的作用研究较少。傅筱冲等[11]在土法造纸嫩毛竹自然发酵过程中分离纯化得到了100株细菌,60株为芽孢杆菌,另外40株有微球菌、葡萄球菌、李氏杆菌、不动杆菌、肠杆菌等,并发现其中的3株芽孢杆菌能使嫩毛竹明显软化。李超等[12]从毛竹林地的腐朽竹伐桩分离筛选出16株具有较好纤维素或木质素降解能力的菌株,其中8株霉菌、5株细菌和3株放线菌。Zeng等[2]从走马楼出土的竹简中分离出属于4个属的10株细菌,但这些菌株降解竹材的能力未见报道。
本研究采用牛肉膏蛋白胨、高氏一号和查氏培养基3种培养基分离竹简浸泡液中的微生物,得到8株细菌及 1株霉菌,属于Bacillus,Acinetobacter,Staphylococcus,Pandoraea,Novosphingobium,Cupriavidus,Comamonas以及Aspergillus,呈现出丰富的生物多样性。目前,已发现来自Bacillus,Acinetobacter以及Aspergillus中的一些菌株具有降解木质素的能力。Chandra等[13]从造纸废水中分离出 3株具有较强木质素降解能力的Bacillussp.,6 d即可使木质素降解 30%~40%;Gajanan等[14]从一株Acinetobactersp.中纯化得到了木质素过氧化物酶。曲霉菌(Aspergillussp.)则是一种常见的木质素、纤维素降解菌。习兴梅等[15]从农林废物堆肥中分离得到一株黑曲霉,对木质素、纤维素和半纤维素的降解率分别为16.87%、39.85%和45.32%。Ahammed等[16]从红树林中分离得到一株Aspergillussp.,并测定了其木质素过氧化物酶活性。木质素、纤维素和半纤维素的结构单元中含有大量的芳香基和苯环结构,Staphylococcus,Pandoraea,Novosphingobium,Cupriavidus和Comamonas的细菌未见报道参与木质素降解,对芳烃类、苯酚类有机物的降解却有较多报道。卢涛等[17]分离得到一株能降解邻硝基酚细菌Staphylococcussp.;蒋析文等[18]对一株Pandoraeasp.的氯苯降解机理进行了深入的研究;崔志松等[19]从厦门近海海水中筛选到一株能够降解多环芳烃的细菌Novosphingobiumsp.;Sanchez等[20]对一株 2, 4, 6-三氯苯酚降解菌Cupriavidus necatorJMP134的遗传特性进行了研究。吴建峰等[21]从污水处理厂分离了一株能以对氯硝基苯为唯一碳源、氮源和能源生长的丛毛单胞菌(Comamonassp.CNB1)。因此,从三国吴简中分离出的菌株具有降解木质素、纤维素和半纤维素的潜力,其降解木质素、纤维素和半纤维素的能力和相关机制有待进一步通过实验证明。
4 结论
(1) 采用细菌和真菌普通培养基,从腐蚀竹简浸泡液中共分离得到9株可培养菌株,其中有8株细菌,1株霉菌。
(2) 分析了从被腐蚀竹简中分离得到的 9株菌具有降解木质素、纤维素和半纤维素的潜力。
[1] 胡东波, 宋少华, 肖静华, 等. 长沙走马楼出土饱水竹简的防腐保存[J]. 文物保护与考古科学, 2003, 15(2): 14−18.HU Dong-bo, SONG Shao-hua, XIAO Jing-hua, et al. The antisepsis of the bamboo slips and lacquer wares in water [J].Sciences of Conservation and Archaeology, 2000, 15(2): 14−18.
[2] ZENG Wei-zheng, CHEN Rui, SONG Shao-hua, et al.Study on erosive microorganisms of the bamboo slips unearthed from Zoumalou, Changsha, China[J]. Journal of Microbiology, 2007,27(5): 50−56.
[3] Martin F P, Collen M C. Bias in template to product ratios in multitemplate PCR[J]. Appl Environ Microbiol, 1998, 64(2):3724−3730.
[4] 朱衡, 瞿峰, 朱立煌. 利用氯化苄提取适于分子生物学分析的真菌DNA[J]. 真菌学报, 1994, 13(1): 34−40.ZHU Heng, QU Feng, ZHU Li-huang. Isolation of genomic DNAs from fungi using benzyl chloride[J]. Acta Mycologica Sinica, 1994, 13(1): 34−40.
[5] 章初同, 徐龙. 木霉属Trichoderma组和Pachybasium组的分子系统学研究[J]. 菌物系统, 2002, 21(4): 538−546.ZHANG Chu-tong, XU Long. Molcular phylogenetic analysis of section Trichoderma and Pachybasium in the genus Trichoderma[J]. Mycosystema, 2002, 21(4): 538−546.
[6] 戴欣, 王保军, 黄燕, 等. 普通和稀释培养基研究太湖沉积物可培养细菌的多样性[J]. 微生物学报, 2005, 45(2): 161−165.DAI Xin, WANG Bao-jun, HUANG Yan, et al. Bacterial diversity in the sediments of Taihu lake by using traditional nutrient medium and dilution nutrient medium[J]. Acta Microbiologica Sinica, 2005, 45(2): 161−165.
[7] 江泽慧, 于文吉, 余养伦. 竹材化学成分分析和表面性能表征[J]. 东北林业大学学报, 2006, 34(4): 1−6.JIANG Ze-hui, YU Wen-ji, YU Yang-lun. Analysis of chemical components of bamboo wood and characteristic of surface performance[J]. Journal of Northeast Forestry University, 2006,34(4): 1−6.
[8] 吴开云, 翁月霞. 竹材霉腐类型及其与环境条件的关系[J].林业科学研究, 2000, 13(1): 63−70.WU Kai-yun, WENG Yue-xia. Bamboo mildew-rotting and its relation with environmental condition[J]. Forestry Research,2000, 13(1): 63−70.
[9] 李河, 周国英, 周德明. 用于提取可纺性竹原纤维菌株的选育[J]. 中南林学院学报, 2006, 26(1): 48−52.LI He, ZHOU Guo-ying, ZHOU De-ming. Extract ion of bamboo fiber through screening of fungus[J]. Journal of Central South Forestry University, 2006, 26(1): 48−52.
[10] 王文久, 辉朝茂, 陈玉惠, 等.竹材霉腐与霉腐真菌[J]. 竹子研究汇刊, 2000, 13(1): 40−43.WANG Wen-jiu, HUI Chao-mao, CHEN Yu-hui, et al. Mildew and rot of bamboo wood and mold fungi[J]. Journal of Bamboo Research, 2000, 13(1): 40−43.
[11] 傅筱冲, 廖延雄, 曹晖, 等. 土法造纸木素降解之探索Ⅲ: 嫩毛竹自然发酵过程中的细菌分离鉴定与嫩竹软化菌的筛选[J].江西科学, 1998, 16(1): 12−20.FU Xiao-chong, LIAO Yan-xiong, CAO Hui, et al. Studies on lignin degradation by local native method of paper-pulp production[J]. Jiangxi Science, 1998, 16(1): 12−20.
[12] 李超, 李潞滨, 杨凯, 等. 竹伐桩促腐微生物的分离筛选[J].林业科学研究, 2008, 21(2): 253−257.LI Chao, LI Lu-bin, YANG Kai, et al. Isolating and screening of microorganisms for decomposing bamboo stump[J]. Forestry Research, 2008, 21 (2): 253−257.
[13] Chandra R, Raj A, Purohit H J, et al. Characterisation and optimisation of three potential aerobic bacterial strains for kraft lignin degradation from pulp paper waste[J]. Chemosphere, 2007,67(4): 839−846.
[14] Gajanan S, Ghodake, Satish D K, et al. Purification and partial characterization of lignin peroxidase fromAcinetobacter calcoaceticusNCIM 2890 and its application in decolorization of textile dyes[J]. Appl Biochem Biotechnol, 2009, 152(1):6−14.
[15] 习兴梅, 曾光明, 郁红艳, 等. 黑曲霉Aspergillusniger木质纤维素降解能力及产酶研究[J]. 农业环境科学学报, 2007, 26(4):1506−1511.XI Xing-mei, ZENG Guang-ming, YU Hong-yan, et al.Lignocelluloses degrading ability ofAspergillusnigerand the enzyme production [J]. Journal of Agro-Environment Science,2007, 26(4): 1506−1511.
[16] Ahammed S, Prema P. Influence of media nutrients on synthesis of lignin peroxidase fromAspergillussp[J]. Appl Biochem Biotechnol, 2002, 102/103(1/6): 327−336.
[17] 卢涛, 雷蕾, 张杰, 等. 降解邻硝基酚葡萄球菌的分离与特性研究[J]. 四川大学学报: 自然科学版, 2000, 37: 187−190.LU Tao, LEI Lei, ZHANG Jie, et al. Isolation of a bacteria strain which can biodegrade o-Nitropenol[J]. Journal of Sichuan University: Natural Science, 2000, 37: 187−190.
[18] 蒋析文.Pandoraeasp. MCB032氯苯降解机理的研究[D]. 北京: 中国科学院研究生院武汉病毒研究所, 2007: 7−11.JIANG Xi-wen. Studies on degradation pathway of chlorobenzene inPandoraeasp. MCB032[D]. Beijing: Master Dissertation Chinese Academy of Sciences, Wuhan Institute of Virology, 2007: 7−11.
[19] 崔志松, 邵宗泽. 一株海洋新鞘氨醇杆菌phe-8(Novosphingobiumsp)的 PAHs降解基因和降解特性[J].厦门大学学报: 自然科学版, 2006, 45(S1): 257−261.CUI Zhi-song, SHAO Zong-ze. Characterization of a PAHs degrading marine strainNovosphingobiumsp. Phe-8 and its degradative genes[J]. Journal of Xiamen University: Natural Science, 2006, 45(S1): 257−261.
[20] Sanchez M A, González B. Genetic characterization of 2,4,6-Trichlorophenol degradation inCupriavidusnecatorJMP134 [J]. Appl Environ Microbiol, 2007, 73(9): 2769−2776.
[21] 吴建峰, 沈锡辉, 周宇光, 等. 一株降解对氯硝基苯的Comamonassp.CNB1的分离鉴定及其降解特性[J]. 微生物学报, 2004, 44(1): 8−12.WU Jian-feng, SHEN Xi-hui, ZHOU Yu-guang, et al.Characterization of p-chloronitrobenzene-degradingComamonassp. CNB1 and its Degradation of p-chloronitrobenzene[J]. Acta Microbiologica Sinica, 2004, 44(1): 8−12.
