HKC细胞损伤前后对草酸钙晶体吞噬能力的差异
2010-09-15邓穗平欧阳健明
谈 金 邓穗平 欧阳健明
(暨南大学生物矿化与结石病防治研究所,暨南大学化学系,广州 510632)
HKC细胞损伤前后对草酸钙晶体吞噬能力的差异
谈 金 邓穗平 欧阳健明*
(暨南大学生物矿化与结石病防治研究所,暨南大学化学系,广州 510632)
采用人类肾脏近端小管上皮细胞系(HKC)建立氧化性损伤模型,研究损伤前后HKC调控草酸钙(CaOxa)结晶的差异。采用CCK-8法检测HKC的细胞活性;利用激光共聚焦显微镜观察HKC损伤后表达的晶体粘附分子骨桥蛋白(OPN);采用倒置显微镜观察HKC的形态变化;采用扫描电子显微镜(SEM)观察HKC微结构及其诱导的晶体;采用X射线衍射分析(XRD)表征晶体的组分。在CaOxa过饱和溶液中,正常HKC主要诱导形成二水草酸钙(COD)晶体,而损伤HKC则同时诱导了COD和一水草酸钙(COM)晶体。正常HKC对COD晶体有较强的吞噬能力,而损伤HKC的这种能力较弱;HKC损伤后表达OPN,促进CaOxa晶体的成核和聚集,从而增加了肾结石形成的危险性。
草酸钙;细胞调控;肾结石;生物矿化
对肾结石矿物与肾小管上皮细胞之间相互作用的研究已经较为广泛[1-2]。尽管普遍认为晶体对肾小管上皮细胞具有损伤作用,但是也有一些研究结果表明晶体对肾小管上皮细胞影响不大[3]。
McMartin等[1]报导,一水草酸钙(COM)晶体可引起人近端肾小管细胞、大鼠近端肾小管细胞的坏死。Schepers等[3]认为,COM晶体对猪和犬的近端肾小管细胞(LLC-PK1和MDCK-Ⅱ)具有毒害作用,但是对鼠和犬的集合管细胞 (RCCD1与MDCK-Ⅰ)没有毒害作用。近端肾小管细胞能迅速粘附晶体,随后内吞晶体,1 d后内吞晶体的细胞从细胞层中脱落;但是,集合管细胞与COM晶体共同孵育一段时间后,既没有粘附也不会内吞COM晶体,集合管细胞的形貌也没有发生改变。上述结果说明,COM晶体对肾脏中不同部位或不同类型肾小管细胞的作用不同。
例如,对于犬肾小管上皮细胞(MDCK),实际上还可细分为两种细胞株:MDCK-Ⅰ和MDCK-Ⅱ,这两种细胞的性质互不相同;而在早期的研究中,并没有对此加以区分,因此导致以MDCK作为研究对象所得到的结论不一致。Verkoelen等[4]报导,MDCK与COM晶体作用后没有检测到细胞的损伤,COM晶体粘附到MDCK后被细胞内吞,随后从细胞层中被除去;而Thongboonkerd等[5]报导,COM晶体能够损伤MDCK;Khan等[6]亦报导了COM晶体可以损伤MDCK,导致20%~30%的细胞脱落,且部分脱落细胞中内吞有晶体。
另外,由于不同的研究小组采用不同类型或不同来源的晶体进行研究,亦导致所得到的结论不一致。例如,Aihara等[2]研究了不同浓度的磷酸钙与LLC-PK1和MDCK-Ⅰ的相互作用,发现两类细胞与磷酸钙晶体接触后都产生细胞损伤现象,从而促进了晶体的粘附和结石的发展。Escobar等[7]发现,来自肾结石中的草酸钙(CaOxa)晶体、磷酸钙晶体对大鼠肾小管上皮细胞(NRK-52E)的损伤程度较小,而人工合成的上述晶体对细胞的损伤程度较大。
此外,在以往的文献里,大多数情况是采用预先制备好的COM种晶与细胞作用,对二水草酸钙(COD)晶种与细胞作用的研究很少,目前仅见Lieske等[8]的报道,他们采用非洲绿猴肾上皮细胞(BSC-1)与COD晶体相互作用,发现COD晶体的(100)晶面能够选择地快速粘附在BSC-1细胞上。
因此,研究细胞与尿石晶体的相互作用时,必须确定细胞的种类、晶体类型、晶体来源、以及体系中CaOxa溶液的过饱和度等。
HKC是分化良好的人类肾脏近端小管上皮细胞,存活时间长、易于传代培养,是研究肾毒性的一种有重要价值的体外细胞模型。HKC细胞具有肾小管上皮细胞特有的结构和功能,能表达近端肾小管特异性标志酶如碱性磷酸酶 (AP)、γ-谷氨酰转肽酶(γ-GT)及上皮细胞分化的标志物细胞角蛋白。
基于此,本文研究了HKC与CaOxa饱和溶液的相互作用,观察了CaOxa晶体在正常HKC与损伤HKC上的成核、生长以及与HKC的相互作用,期望为进一步了解结石形成的细胞机制提供新的启示。
1 实验部分
1.1 试 剂
人类近端肾小管上皮细胞系(HKC)来自Johns Hopkins大学医学院Racusen博士,由第二军医大学上海长征医院肾内科梅长林教授惠赠。培养液DMEM-F12(Gibco,美国),新生牛血清(Gibco,新西兰),青霉素(华北制药股份有限公司),链霉素(大连美罗大药厂),细胞増生分析试剂盒(CCK-8)(日本同仁化学研究所),细胞培养板(Iwaki,日本)。丙二醛(MDA)试剂盒(南京建成生物工程研究所)。其它试剂如 NaCl、KCl、Na2HPO4·2H2O、KH2PO4、NaHCO3均为分析纯。
在D-Hanks平衡液中制备草酸钾储液(20 mmol·L-1)、氯化钙储液 (20 mmol·L-1),pH 值调至7.4。使用前配制 cCa2+=c=0.3 mmol·L-1的CaOxa 饱和溶液。
1.2 仪 器
XL-30型环境扫描电子显微镜 (ESEM,Philips公司),样品喷金处理,测量电压为20 kV。酶标仪(Safire2,Tecan,瑞士),在酶标仪上测量吸光度值,测试波长为 450 nm(检测 CCK-8)或者 532 nm(检测MDA)。日本理学D/max 2400(Rigaku)X射线衍射仪,Cu靶,Kα 射线,石墨单色器,40 kV,30 mA,扫描范围5°~60°。倒置显微镜为倒置荧光显微镜(IX51)(日本奥林巴斯公司)。激光共聚焦荧光显微镜(510 META DUO SCAN,CARL ZEISS,德国)。
1.3 HKC培养
HKC用含10%新生小牛血清的DMEM-F12培养液培养,同时加入 100 U·mL-1青霉素和 100 μg·mL-1链霉素。培养条件为37℃、5%CO2、饱和湿度。HKC传代采用胰蛋白酶消化法。细胞达80%融合后,吸除培养液,用D-Hanks平衡液洗涤HKC 2次,加入0.25%胰酶消化液,置于37℃培养箱中3~5 min后,在倒置显微镜下观察HKC的消化程度,当细胞变圆,细胞之间出现孔隙且不再连接成片,表明此时细胞消化适度,加入含10%新生小牛血清的DMEM-F12培养液终止消化,并吹打细胞脱离瓶壁形成单细胞悬液;离心3 min(1 000 r·min-1),弃去上清液,再加入含10%新生牛血清的DMEM-F12培养液,吹打细胞形成单细胞悬液,备用。
1.4 细胞的损伤和损伤程度检测
(1)损伤HKC的活性检测:采用CCK-8法检测HKC的损伤[9],以细胞活性反映HKC的损伤程度。
按细胞浓度为 1×104cell·mL-1、100 μL·hole-1接种于96孔培养板,加入含10%新生牛血清的DMEM-F12培养液孵育24 h,改用无血清DMEMF12培养液孵育12 h,使细胞同步化。将HKC分两组,每组均设3个平行复孔。①对照组:只加入无血清培养液;② 损伤组:加入含有 0.5 mmol·L-1H2O2的无血清培养液,分别作用 HKC 细胞 0、0.5、1、1.5、2 h。然后,两组细胞改用新鲜的无血清培养液,每孔加入 10 μL的 CCK-8,于 37℃下孵育 4 h后,用酶标仪在450 nm处测量吸光度 (A),各个条件下的HKC平行测定3个重复孔,求A值的平均值。
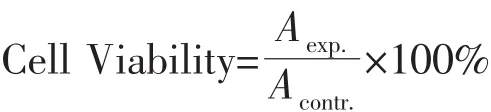
(2)HKC损伤前后丙二醛(MDA)含量检测:按照上面方法损伤细胞后,将细胞悬浮液移入EP管内,在4℃离心10 min。取上清液,采用南京建成生物工程研究所提供的试剂盒,用硫代巴比妥酸(TBA)法测量MDA的含量,严格按照试剂盒说明书操作,比色法测定。
(3)HKC损伤前后表达的骨桥蛋白(OPN)检测:将培养瓶中70%~80%融合生长的HKC经胰酶消化后,取 1 mL(浓度 1×105cell·mL-1)细胞悬浮液接种于预先铺有盖玻片的6孔细胞培养板中,在37℃、5%CO2条件下培养 24 h后,改用无血清DMEM/F12培养液孵育12 h,使细胞同步化。按照上面方法损伤细胞后,从孔板中取出盖玻片,用0.01 mol·L-1的 PBS洗 3 次,每次 5 min。4%甲醛/0.1%戊二醛固定 10 min,PBS 洗 3 次(5 min×3)。加入含有羊血清的1%牛血清白蛋白(BSA)封闭液,在37℃条件下孵育20 min。甩掉多余血清,滴加OPN抗体(sc-20788,Santa Cruz)(1∶150),于 37℃下孵育 1 h,PBS洗3次(5 min×3)。滴加FITC标记羊抗兔IgG抗体(sc-2012,Santa Cruz)(1∶100),放于暗处,在 37 ℃下孵育30 min,PBS充分冲洗3次(5 min×3)。使用4′,6-二脒基-2-苯基吲哚 (DAPI) 封闭液(sc-24941,Santa Cruz)封片。对照组以兔血清代替OPN抗体。于激光共聚焦荧光显微镜下观察并拍摄照片。
1.5 HKC诱导CaOxa晶体生长及晶体的SEM和XRD检测
按细胞浓度为 1×105cells·mL-1、1000 μL·hole-1接种于12孔培养板内,孔板底部预先平铺有大小合适的盖玻片。用含10%新生牛血清的DMEM-F12培养液孵育24 h后,改用无血清DMEM-F12培养液孵育12 h,使细胞同步化。将HKC分为4组,每组均设3个平行复孔。①空白对照组:加入无血清培养液;② H2O2组:每孔加入含 0.5 mmol·L-1H2O2的无血清培养液,作用1 h;③ CaOxa组:加入含0.3 mmol·L-1CaOxa过饱和溶液的无血清培养液,置于37 ℃下分别孵育 0、0.33、3、6、12、24 h; ④ H2O2+CaOxa 组: 加入含 0.5 mmol·L-1H2O2的无血清培养液,37℃下孵育1 h后,吸除培养液,用D-Hanks清洗细胞2次,加入含0.3 mmol·L-1CaOxa过饱和溶液的无血清培养液,置于37℃下分别孵育0、0.33、3、12、24 h。
达到预定的结晶时间后,取出盖玻片,用DHanks冲洗细胞2次,加入2.5%戊二醛固定细胞2 h,再用1%OsO4对细胞进行后固定,D-Hanks冲洗3次,梯度乙醇(30%、50%、70%、90%、100%)脱水,CO2临界点干燥,装样并将样品喷镀包被,在SEM下观察细胞形态和晶体生长情况。同时对盖玻片上的晶体进行XRD检测,确定晶体的组分。
1.6 统计学方法
2 结果与讨论
2.1 H2O2对HKC的损伤及损伤程度检测
2.1.1 H2O2对 HKC 的损伤及损伤程度检测
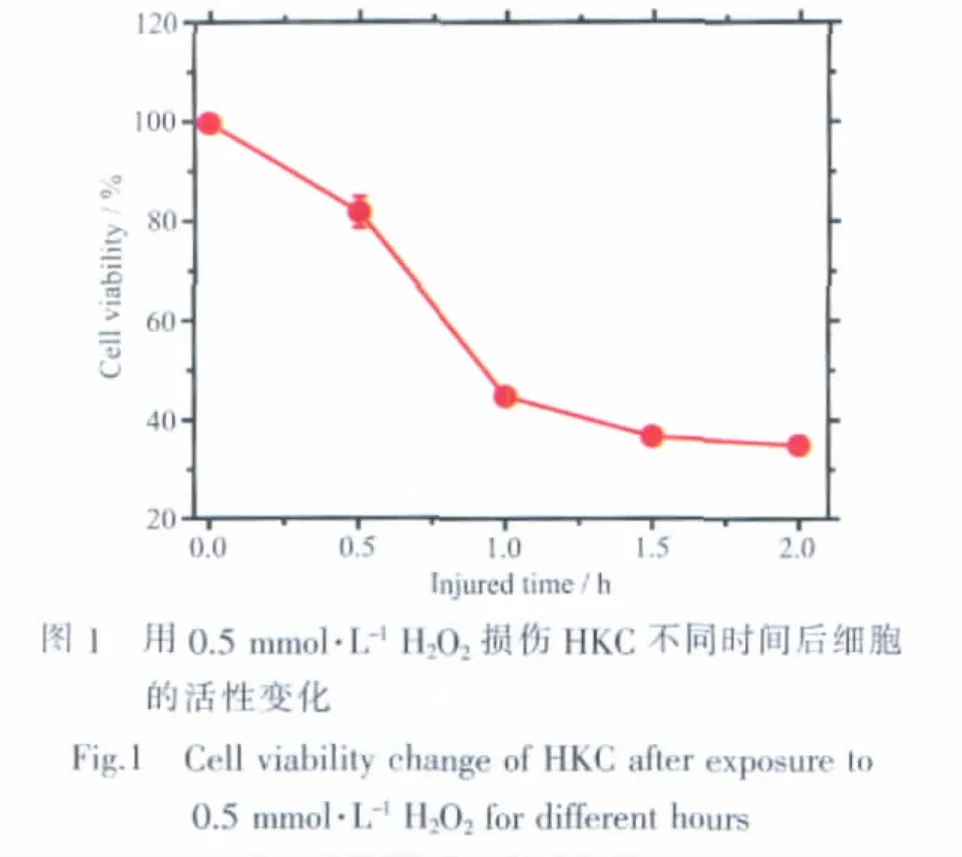
通过检测H2O2对HKC的增殖抑制作用,来衡量H2O2对HKC的损伤程度,结果如图1所示。用0.5 mmol·L-1的 H2O2作用细胞 0.5 h 后,细胞的活性为(82.1±3.1)%,表明 HKC 已经发生明显的损伤(P<0.05);作用 1 h 后,细胞活性显著下降到(45.0±0.9)%;增加H2O2作用时间,对HKC的损伤进一步加剧,细胞活性进一步降低;作用2 h后,HKC活性为(35.1±0.6)%(P<0.05)。
2.1.2 HKC 损伤后的丙二醛含量增加
在生物体内,肾上皮细胞在病理情况下通过非酶反应与酶促反应产生大量的氧自由基。而生物膜的主要成分磷脂含有不饱和脂肪酸,氧自由基对这些不饱和脂肪酸中的不饱和键具有很高的亲和力,从而产生过氧化反应,导致细胞损伤,并因此形成脂质过氧化物[10],如醛基、酮基、羟基、羰基、氢过氧基等,其中醛类所占比例较大。丙二醛(MDA)是细胞脂质过氧化反应的终产物,其含量的多少可反映机体内脂质过氧化的程度,也间接地反映出细胞受损伤的程度[11]。
表1为 0.5 mmol·L-1H2O2作用于 HKC 不同时间后MDA含量的变化。可以看出:H2O2作用HKC细胞 0.5 h 后,MDA 含量从对照组的 (0.38±0.03)μmol·L-1明显上升到 (0.86±0.06)μmol·L-1,说明H2O2对细胞膜造成了损伤,导致MDA水平上升(P<0.05)。随着作用时间增加,MDA含量增加;当作用2 h 时,MDA 含量达到(1.23±0.03)μmol·L-1,表明此时对细胞膜的损伤进一步加剧。
表1 用0.5 mmol·L-1H2O2作用HKC不同时间后细胞释放的MDA含量变化(±s)Table 1 Content change of MDA released by HKC after exposure to 0.5 mmol·L-1H2O2for different time(±s)

表1 用0.5 mmol·L-1H2O2作用HKC不同时间后细胞释放的MDA含量变化(±s)Table 1 Content change of MDA released by HKC after exposure to 0.5 mmol·L-1H2O2for different time(±s)
*Data are mean±standard deviation of three independent experiments;*P<0.05 compared with control without addition of H2O2at 0 h.
Time/h 0 0.5 1 1.5 2 Content of MDA/(μmol·L-1) (0.38±0.03) (0.86±0.06)* (1.063±0.06)* (1.11±0.08)* (1.23±0.03)*
2.1.3 细胞损伤后骨桥蛋白(OPN)分子检测
HKC损伤后,会表达晶体粘附分子骨桥蛋白(OPN)。图2为反映HKC损伤前后OPN分子表达量变化的激光共聚焦显微镜图片。可看出,对照组HKC周围没有或只有少量的绿色荧光(图2a),说明没有损伤的HKC不表达或只表达少量的OPN分子。
经 0.5 mmol·L-1H2O2损伤 0.5 h 后,HKC 周围出现明显的绿光荧光 (图2b),说明HKC被损伤之后,表达了OPN分子。当损伤时间增加至1.5 h后,绿色荧光强度增强(图2c),说明HKC损伤加剧后,导致大量OPN分子的表达。
正常肾上皮细胞表面具有抵抗晶体粘附的性质;但当细胞受损伤后,细胞表面的微结构发生改变,并表达大量带负电荷的物质,如透明质酸、胶原蛋白和OPN等[12-13],这些负电荷的物质能够吸引钙离子和草酸钙晶体,是潜在的晶体粘附位点,被称为晶体粘附物质。图2结果表明,HKC被损伤后,表达了OPN;从其绿色荧光强度可以看出,随着损伤强度增加,OPN的表达量也增多。
2.2 损伤前后HKC与CaOxa过饱和溶液的作用
2.2.1 损伤前后HKC与CaOxa过饱和溶液作用后的活性变化
经0.5 mmol·L-1H2O2损伤1 h后的HKC细胞,其活性为(45.0±0.9)%(图1);将此损伤的HKC再用0.3 mmol·L-1CaOxa过饱和溶液孵育后,其活性继续降低,如图3所示。随着孵育时间增加到24 h,损伤HKC的活性从刚开始时的(45.0±0.9)%继续降低至(33.5±0.6)%。
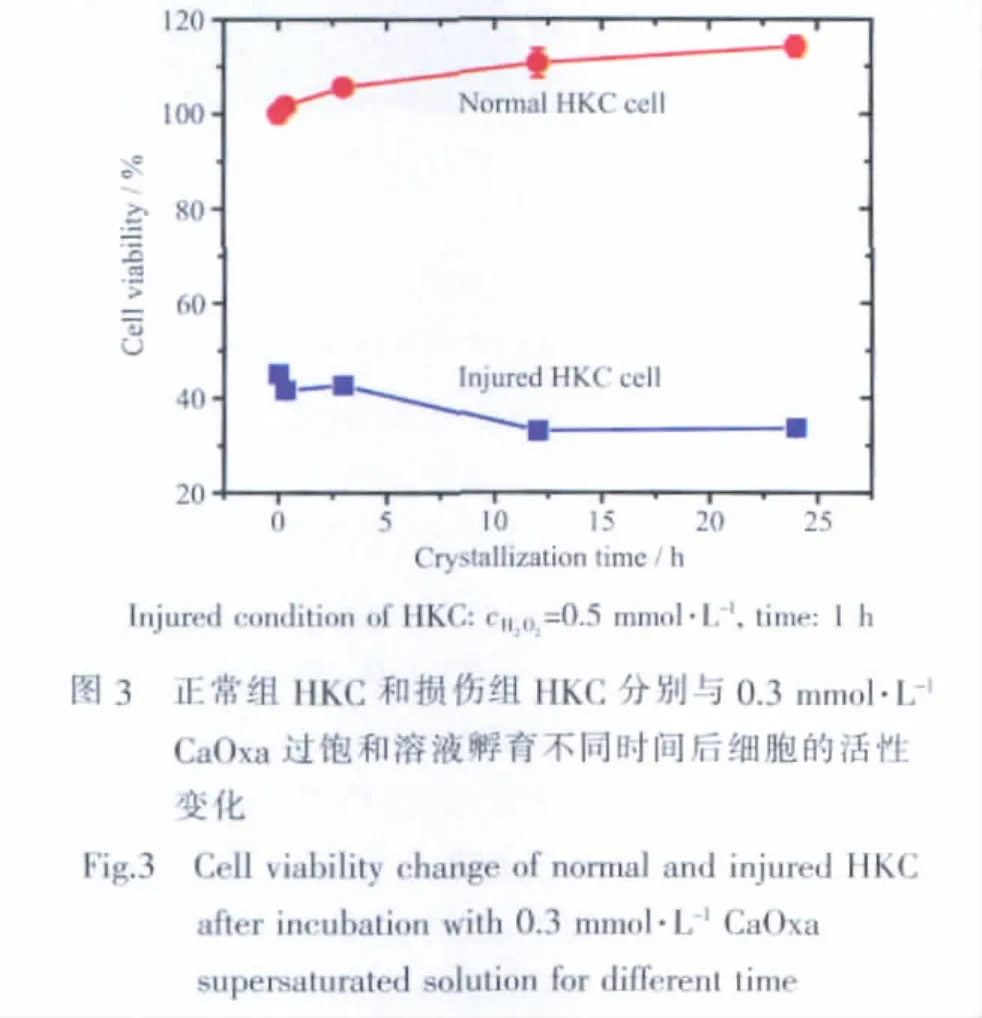
相比之下,正常HKC用0.3 mmol·L-1CaOxa过饱和溶液孵育后,细胞的活性略有增加;如分别孵育3 h和24 h后,其活性分别为 (105.61.2)%和(114.12.1)%(图3),说明细胞仍在继续生长。
2.2.2 正常HKC对COD晶体的内吞作用
图4为正常 HKC与 0.3 mmol·L-1的 CaOxa过饱和溶液孵育不同时间后诱导生成的晶体的SEM。可以看出,孵育0.33 h后,CaOxa晶体就已经在HKC表面成核生长(图4a),这些晶体具有COD的典型形貌四角双锥形。
倒置显微镜观察表明,孵育3 h后,HKC开始覆盖在其诱导的COD晶体表面上,表明此时HKC已经开始内吞晶体。SEM进一步显示,被HKC覆盖后的COD晶体,会在HKC的不断作用下逐渐分解成尺寸较小的微晶(图4b中箭头所示);且随着孵育时间的增加,越来越多的COD晶体被分解形成尺寸更小的微晶(图4c、4d中箭头所示)。在此过程中,正常HKC的活性变化不大。该结果与Lieske等[8]研究BSC-1细胞与COD晶体相互作用的结果相似。
尽管有一些文献报导[14-15],CaOxa晶体对培养的肾小管上皮细胞产生损伤作用。但是,在这些文献里采用的CaOxa晶体均为COM晶体。COM晶体与COD晶体对肾细胞的病理学行为不同,COD晶体是肾结石成分的另外一种矿物相,其含量比COM晶体少[16];加上HKC还可以内吞一部分COD晶体,因此,总体来看,COD晶体对肾细胞生长的影响不大。即:相比COM晶体,在尿液中形成较多的COD晶体被认为有利于减少形成结石的风险[17]。
正常HKC能够抵御由一定量CaOxa晶体所造成的损伤,这可能是由于正常HKC诱导生成的主要为COD晶体、且晶体尺寸较小、数量较少所致。Lieske等[18-20]报导,COM晶体在15 s内即可粘附在BSC-1细胞上面,随后被BSC-1细胞内吞,且被内吞的COM晶体没有对BSC-1细胞的生长产生不利影响,反而促进BSC-1细胞的增殖。
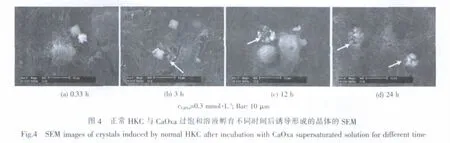
一般认为,与远端肾小管上皮细胞 (如MDCKⅠ)和集合管细胞(如RCCD1)相比,近端肾小管上皮细胞(如LLC-PK1)对粘附在其表面的晶体的内吞能力较强,且是一种主动摄取的过程,因此,没有观察到MDCKⅠ与RCCD1对晶体的内吞现象。这是肾脏上皮细胞的一种保护性机制,可以除去细胞表面潜在的晶体成核和生长位点。从图4c和图4d可以看到,COD晶体被HKC内吞,这正是HKC对肾结石形成的防御机制[21]。
2.3 损伤的HKC对COD晶体的内吞能力减弱
损伤的HKC与0.3 mmol·L-1的CaOxa过饱和溶液孵育不同时间后,其诱导生成的晶体形貌如图5所示。可以看出,在0.33 h内,便有较多的草酸钙晶体在损伤的HKC表面形成(图5a);但一直孵育到24 h(图5d),均很少发现损伤HKC内吞晶体的现象。这与细胞内蛋白激酶的活性有关。蛋白激酶在细胞的内吞作用中起着重要调控作用[22],细胞受到损伤后,蛋白激酶的活性降低,从而减弱了细胞的内吞作用。
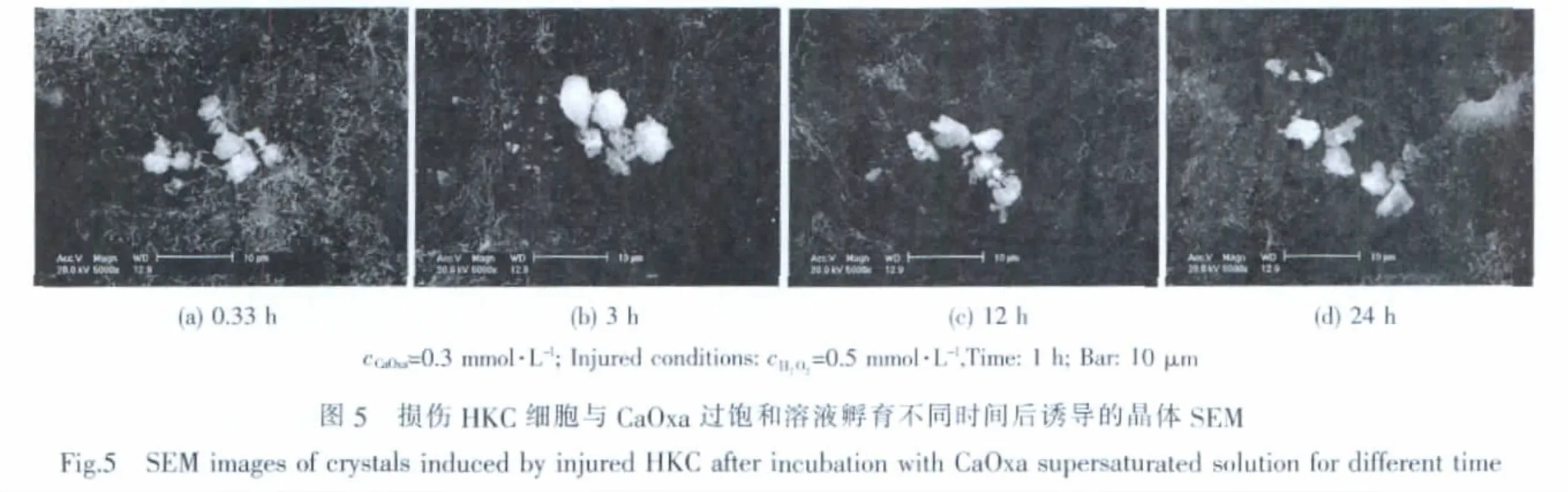
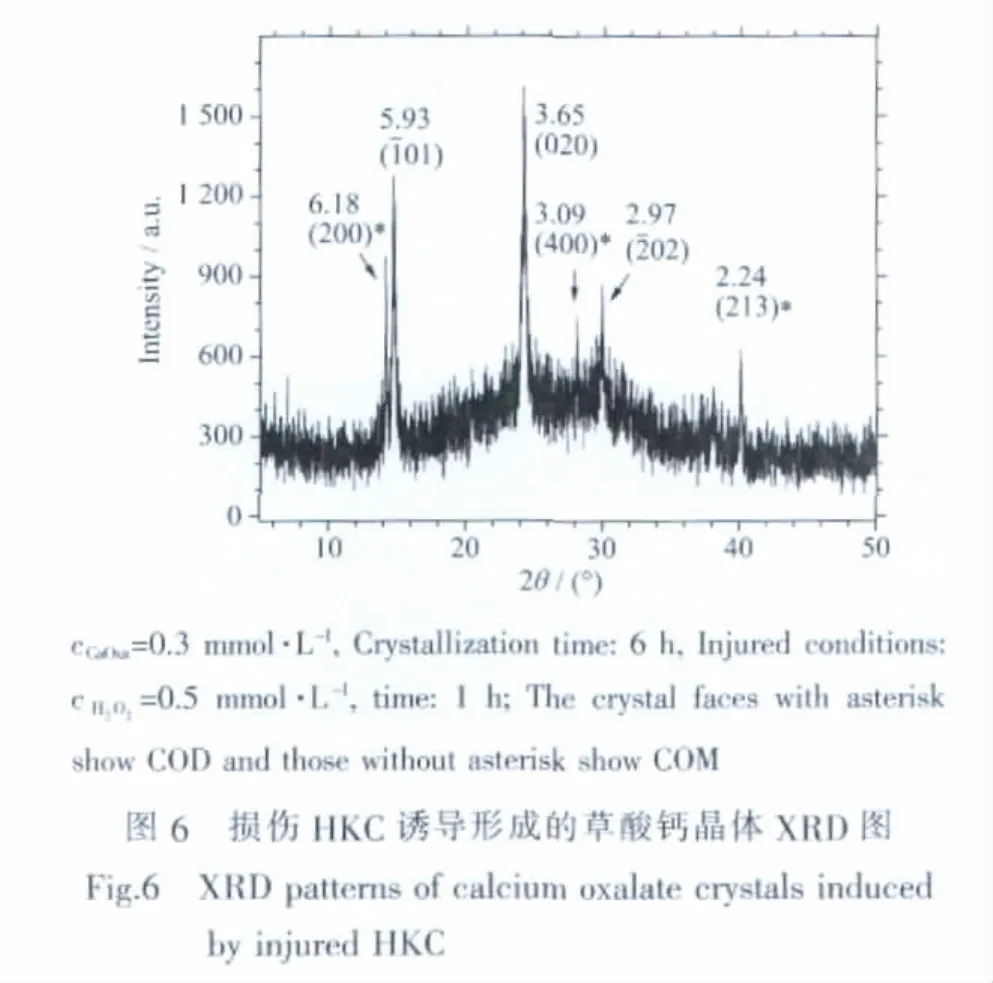
在损伤HKC诱导生成的CaOxa晶体中,不但形成聚集的晶体簇,而且COM晶体的比例显著增加。图6为损伤HKC诱导生成的CaOxa晶体的XRD图。可以看到,XRD图中同时出现了归属于COM和COD晶体的衍射峰,且COM晶体的衍射峰强度高于COD晶体,图中晶面间距d=0.618、0.309和0.224 nm分别归属于COD晶体的 (200)、(400)和(213)晶面,d=0.593、0.365和0.297 nm分别归属于COM 的(101)、(020)和(202)晶面。
从图2可以看出,HKC受损伤后,在其表面表达OPN。OPN是一种带负电的分泌型的糖基化磷酸化蛋白,广泛分布于多种组织和细胞中,其相对分子质量约为44 kDa[23],含有约300个氨基酸残基,其中酸性氨基酸如天冬氨酸残基、谷氨酸残基和丝氨酸残基约占总氨基酸量的一半。因此,OPN分子中含有丰富的酸性结构域,这些酸性结构域能与游离的Ca2+相结合,并可以粘附表面带正电荷的COM晶体,促进晶体在细胞表面的滞留[24-25]。因此,细胞受到损伤后,细胞吞噬晶体的能力显著减弱(图5),导致大量晶体滞留在肾小管内,引起晶体的聚集,甚至堵塞肾小管。
相比表面具有较高正电荷密度的COM晶体,COD晶体表面电荷密度很低,COD表面负电荷密度较高的部位仅处在其锥体的2个顶端[26-27],在这两个顶端上由于草酸根的突出而带负电。损伤的HKC表面由于表达了OPN等酸性分子而带负电,因此,COD晶体与损伤HKC的作用较弱。
上述结果提示,通过研究不同晶相的CaOxa晶体与不同性质的细胞作用,有助于阐明肾石病复杂的病理学过程。
3 结 论
以氧化性损伤的HKC体系为模型,研究了CaOxa过饱和溶液与HKC的相互作用。结果表明,CaOxa晶体在正常HKC和受损伤HKC表面的成核和聚集行为存在差异。正常HKC主要诱导COD晶体形成,并对COD晶体的内吞能力较强,而损伤HKC的内吞能力减弱。损伤HKC促进COM的成核和聚集,因此,HKC受损伤后,增加了草酸钙结石形成的危险性。
[1]Hovda K E,Guo C G,Austin R,et al.Toxicol.Lett.,2010,192(3):365-372
[2]Aihara K,Byer K J,Khan S R.Kidney Int.,2003,64(4):1283-1291
[3]Schepers M S J,van Ballegooijen E S,Bangma C H,et al.Kidney Int.,2005,68(4):1543-1553
[4]Verkoelen C F,Romijn J C,de Bruijn W C,et al.Kidney Int.,1995,48:129-138
[5]Thongboonkerd V,Semangoen T,Sinchaikul S,et al.J.Prot.Res.,2008,7(11):4689-4700
[6]Thamilselvan S,Khan S R.J.Nephrol.,1998,11(Suppl 1):66-69
[7]Escobar C,Byer K J,Khan S R.BJU Int.,2007,100:891-897
[8]Lieske J C,Toback F G,Deganello S.Calcif.Tissue Int.,1996,58:195-200
[9]Hamamoto R,Furukawa Y,Morita M,et al.Nature Cell Biol.,2004,6(8):731-740
[10]Thamilselvan S,Khan S R,Menon M.Urol.Res.,2003,31:3-9
[11]Veena C K,Josephine A,Preetha S P,et al.Life Sci.,2006,79:1789-1795
[12]Khan S R,Glenton P A,Byer K J.Kidney Int.,2006,70:914-923
[13]Yasui T,Fujita K,Asai K,et al.J.Urol.,2002,9(2):100-108
[14]Guo C G,Cenac T A,Li Y,et al.Toxicol.Lett.,2007,173:8-16
[15]Koul H K,Menon M,Chaturvedi L S,et al.J.Biol.Chem.,2002,277:36845-36852
[16]HUANG Zhi-Jie(黄志杰),LI Jun-Jun(李君君),HE Jie-Yu(何节玉),et al.Spectrosc.Spectr.Anal.(Guangpuxue Yu Guangpu Fenxi),2010,30(7):1913-1917
[17]Wesson J A,Ward M D.Elements,2007,3(6):415-421
[18]Lieske J C,Swift H,Martin T,et al.Proc.Nat.Acad.Sci.,1994,91(15):6987-6991
[19]Lieske J C,Walsh-Reitz M M,Toback F G.Am.J.Physiol.Renal Physiol.,1992,262:F622-F630
[20]LieskeJC,TobackFG.Am.J.Physiol.,1993,264:F800-F807
[21]Khan S R.Urol.Res.,2006,34(2):86-91
[22]Pelkmans L,Fava E,Grabner H,et al.Nature,2005,436(7047):78-86
[23]QIN Ling(秦 岭),CHEN Jiang-Hua(陈江华).Int.J.Urol.Nephrol.(Guoji Miniaoxitong Zazhi),2006,26(1):129-132
[24]ZHONG Yu-Sen(钟宇森),CAI Hua-Fang(蔡华芳),LUO Yan-Xi(罗砚曦).Chinese J.Integrated Traditional Western Nephrol.(Zhongguo Zhongxiyi Jiehe Shenbing Zazhi),2009,10(8):741-743
[25]Verkoelen C F.J.Am.Soc.Nephrol.,2006,17(6):1673-1687[26]Tunik L,Hueredi-Milhofer F,Garti N.Langmuir,1998,14:3351-3355
[27]DENG Fang(邓 芳),OUYANG Jian-Ming(欧阳健明).Chem.Res.Appl.(Huaxue Yanjiu Yu Yingyong),2005,18(5):449-454
Difference of Endocytosis to Calcium Oxalate Crystals by HKC Cells before and after Injury
TAN Jin DENG Sui-Ping OUYANG Jian-Ming*
(Institute of Biomineralization and Lithiasis Research,Jinan University,Guangzhou 510632)
An oxidative injury model of human kidney proximal tubule epithelial cell line (HKC)was used to investigate the difference of crystallization of calcium oxalate(CaOxa)modulated by HKC before and after injury.Cell viability was examined by using Cell Counting Kit (CCK-8)assay;the change of expression of crystal adherent molecule osteopontin (OPN)on HKC after injury was observed by laser confocal microscope;the morphological change of HKC was observed by inverted microscope;the microstructure of HKC and the crystals induced by HKC were observed by means of scanning electron microscopy (SEM);the crystal component was characterized by X-ray diffraction (XRD).Calcium oxalate dihydrate (COD)crystals were mainly induced from CaOxa supersaturated solution by normal HKC,while COD crystals and calcium oxalate monohydrate(COM)crystals were simultaneously induced by injured HKC.The endocytosis of normal HKC to COD crystals was strong,but weak for injured HKC.After expression of OPN,the injured HKC can promote nucleation and aggregation of CaOxa crystals.It increases the risk of urolithiasis formation.
calcium oxalate;cell modulation;kidney stones;biomineralization
R69;R329;O614.23+1
A
1001-4861(2010)12-2131-07
2010-07-12。收修改稿日期:2010-08-17。
国家自然科学基金资助项目(No.20971057)。
*通讯联系人。E-mail:toyjm@jnu.edu.cn,Tel:020-85223353
谈 金,男,26岁,硕士研究生;研究方向:生物无机化学。
