乳抗氧化肽的分离纯化与结构鉴定
2010-09-15刘志东郭本恒王荫榆李云飞刘振民
刘志东,郭本恒,王荫榆,李云飞,刘振民
1上海交通大学生命科学技术学院,上海 200240;2光明乳业技术中心乳业生物技术国家重点实验室,上海 200436;3上海交通大学农业与生物学院,上海 200240
乳抗氧化肽的分离纯化与结构鉴定
刘志东1,2,郭本恒2*,王荫榆2,李云飞3,刘振民2
1上海交通大学生命科学技术学院,上海 200240;2光明乳业技术中心乳业生物技术国家重点实验室,上海 200436;3上海交通大学农业与生物学院,上海 200240
本文检测了不同分子量范围的WPI(乳清分离蛋白)酶解物的抗氧化活性,结果表明各个组分显示出不同的抗氧化活性,其中分子量小于 5 kDa的组分最强。采用凝胶过滤色谱对分子量小于 5 kDa的WPI酶解物进行分离,抗氧化活性强的组分继续采用 RP-HPLC进行纯化。通过MALD I-TOF-MS与氨基酸组成分析鉴定该活性肽为 His-Ile-Arg。
乳清分离蛋白,抗氧化肽,分离纯化,氨基酸序列
随着科学的发展,人们逐渐认识到机体氧化产生的自由基与人的衰老和许多疾病有关。因此,有关机体抗氧化的研究成为现代生命科学研究的前沿;获得具有较好抗氧化活性物质的研究也成为生物学,医学和食品科学等领域的研究热点之一。抗氧化肽由于其良好的抗氧化活性、低毒、分子量低、易于在机体内吸收和转运等特性而成为近年来研究的热点之一[1,2]。乳清是干酪生产过程中产生的副产品。乳清蛋白主要包括α-乳白蛋白、β-乳球蛋白,血清白蛋白和免疫球蛋白等[3]。近年来,乳清蛋白作为功能性成分在食品中广泛应用。乳清蛋白经蛋白酶水解后不仅能够显著改善其乳化性、起泡性等性能,而且降解后产生的生物活性肽更易于机体的吸收、转运及利用[4]。目前国内关于乳抗氧化肽的研究较少;国外关于乳抗氧化肽的研究也比较零散,主要是所用蛋白酶具有随意性,功能性的检测方法单一,尤其是关于抗氧化肽的构效关系还没有阐明。
目前抗氧化肽分离纯化的方法主要有三种:一是凝胶过滤色谱,按照活性肽的大小进行分离,二是离子交换色谱,按照活性肽所具有的带电基团的性质和数目进行分离:三是反相高效液相色谱 (RPHPLC),按照活性肽的疏水性强弱进行分离。电喷雾-四极杆-飞行时间 (ESI-quadrupole-time of flight, ESI-Q-TOF)用于测定肽链的氨基酸序列[5,6]。
本研究采用超滤、凝胶过滤层析和 RP-HPLC对具有较好抗氧化活性的乳肽进行分离纯化并采用电喷雾串联质谱进行结构鉴定,为提高乳清蛋白的附加值和深入研究提供理论依据。
1 材料与方法
1.1 材料与试剂
WPI酶解物 (自制);Sephadex G-15(瑞典 Pharmacia公司);α-氰基-4-羟基肉桂酸、DPPH、胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶 (Sigma-Aldrich公司);三氟乙酸,乙腈 (德国Merck公司);其他试剂均为分析纯。
1.2 主要仪器
超滤装置 Vivaflow 50(5000,10000MWCO,德国Sartorius公司);紫外检测仪 HD-3,DBS-100自动部分收集器,DHL-B电脑定时恒流泵 (上海沪西分析仪器厂);高效液相色谱仪 (LC-8A RP-HPLC,日本岛津公司);Avanti冷冻离心机 (美国 Beckman Kulter公司);UV-754紫外分光光度计 (上海精密科学仪器有限公司);基质辅助激光解吸附电离飞行时间质谱 (MALD I-TOF-TOF MS,美国应用系统生物公司);LABCONCO真空冻干机 (美国);Hitachi 835-50氨基酸自动分析仪(日本日立公司)。
1.3 实验方法
1.3.1 WPI酶解物(WPIHs)的制备[7]
1.3.2 抗氧化活性的检测[8]
1.3.3 乳抗氧化肽的分离纯化
1.3.3.1 WPI酶解物(WPIHs)的超滤分离
将乳清分离蛋白酶解物离心,取上清液经 l0 kDa超滤膜截流分离,保留浓缩液,将滤过液经 5 kDa超滤膜截流分离,依次制备分子量为 10 kDa以上、5~10 kDa,5 kDa以下的多肽。然后将各部分溶液进行真空冷冻干燥,分别测定各部分的抗氧化活性。
1.3.3.2 Sephade G-15凝胶过滤层析
将分子量小于 5 kDa的冻干品上 Sephadex G-15柱(1.6 cm ×100 cm),采用 20 mM醋酸-醋酸钠缓冲液平衡并洗脱,自动分布收集器收集,在 220 nm处紫外光检测,收集洗脱峰;合并每次收集的相同组份冻干后,检测其抗氧化活性。
1.3.3.3 RP-HPLC纯化
样品处理方法:由于样品冻溶的时候有少量沉淀生成,疑是缓冲液结晶。样品溶解后经高速离心机 12,000×g离心 15 min,再过 0.45μm滤膜过滤后,用 RP-HPLC进行纯化。
RP-HPLC的分离纯化条件:半制备型柱(μBondapak C1819 mm ×300 mm),分析型柱(μBondapak C183.9 mm×300 mm);流动相:A,5%乙腈,含 0.05%三氟乙酸 (TFA);B,80%乙腈,含0.05%TFA;检测波长 220 nm,流速:1 mL/min,进样量:2 mL。梯度洗脱程序为 0~5 min,100%A;5~20 min,100%A~40%B;20~30 min,40%B~ 100%B;30~40 min,100%B;40~50 min,100%B~100%A;50~55 min,100%A。
1.3.4 乳抗氧化肽的稳定性实验
在体外模拟人体自然生理消化过程:在 1%(w/ v)的样品溶液 (样品溶于 0.1 M的 KCl-HCl缓冲液,pH 2.0)中,加入 1%(w/w)的胃蛋白酶,于 37℃下水解 2 h(模拟胃中的消化环境),在沸水浴中保持 10 min后中止反应,冷却至室温,并用 2 M NaOH调节 pH值至 7.0。取适量水解液在12 000× g下离心 30 min,测定上清液的活性。在剩余的中性水解液中再加入 1%(w/w)的胰蛋白酶和胰凝乳蛋白酶(1:1),于 37℃下水解 2 h(模拟肠道中的消化环境),然后在沸水浴中保持 10 min中止反应,冷却至室温,再取适量水解液于 12 000×g下离心 30 min,测定上清液的活性[9]。
1.3.5 乳抗氧化肽的结构分析
点样方式:先点 0.5μL的样品于MALD I不锈钢靶板上,自然干燥后再点上 0.5μL,0.5 g/Lα-氰基-4-羟基肉桂酸(CCA)溶液(溶剂为 0.1%TFA+ 50%乙腈),在室温下自然干燥。另点 0.5μL 0.5 g/L CCA溶液 (不点样品)作为空白对照。
质谱分析:激光源:355 nm波长的 Nd:YAG激光器,加速电压 20 kV,质量扫描范围:m/z 100~800。
MS分析参数:碰撞诱导解离 (C ID):关;相对分子质量范围:100~3000;固定激光强度:6000;数字转换器:容度 1.0 ns。
质谱仪的分析软件采用 4700 Explorer T M Software。
1.3.6 乳抗氧化肽的氨基酸组成分析
将样品置于水解管中,加入 6 M的盐酸,真空条件下 110℃下水解 24 h,冷却后蒸干。干物质溶于柠檬酸缓冲液,可以测定色氨酸以外的其它氨基酸含量。
2 结果
2.1 乳抗氧化肽的分离纯化
2.1.1 WPI酶解物的超滤分离
本实验采用木瓜蛋白酶水解乳清分离蛋白,酶解时间 4 h,先将酶解液离心去除不溶性物质,然后分别用 l0 kDa和 5 kDa两种超滤膜对酶解液进行超滤以获得不同分子量范围的乳肽。

表 1 不同分子量范围肽的抗氧化活性Table 1 Antioxidative activity of fractions from WPI hydrolysate
以DPPH自由基清除率为指标测定了不同分子量范围多肽的抗氧化活性,如表 1所示。可见乳清蛋白酶解物的分子量范围不同其抗氧化能力相差也很大。乳清蛋白酶解物的抗氧化活性成分主要集中在 5 kDa以下(WPIHs-Ⅲ)。所以,在后续的实验中主要研究了(WPIHs-Ⅲ),浓缩后冻干,置于-20℃贮存备用。
超滤法是根据滤膜孔径的大小实现对样品按分子量大小和形状进行分离,常用于样品的分级分离和浓缩。超滤法可以按膜的截留分子量(K WCO)来对物料进行分离以达到初步分级的目的,但精度不是很高。这是因为其分离效果受物料微粒的电荷、分子大小及形状等方面的影响,导致分级纯化效率较低,在使用中应与其它技术联合使用,以获得更为好的分离效果。因此,本实验在超滤之后再用凝胶过滤色谱和 RP-HPLC进行分离纯化。
2.1.2 Sephadex G-15凝胶过滤层析
将WPI Hs-Ⅲ的组分通过 Sephadex G-15凝胶柱来进行分离纯化,洗脱液为 20 mM的醋酸-醋酸钠缓冲液,检测波长为 220 nm,洗脱流速为 0.5 mL/ min。由洗脱图 1可以看到,样品经 Sephadex G-15凝胶柱分离后得到 5个洗脱峰WPI Hs-Ⅲ-1、WPIHs-Ⅲ-2、WPI Hs-Ⅲ-3,WPIHs-Ⅲ-4和WPIHs-Ⅲ-5,分别收集这 5个洗脱峰冷冻干燥后测定其抗氧化活性。
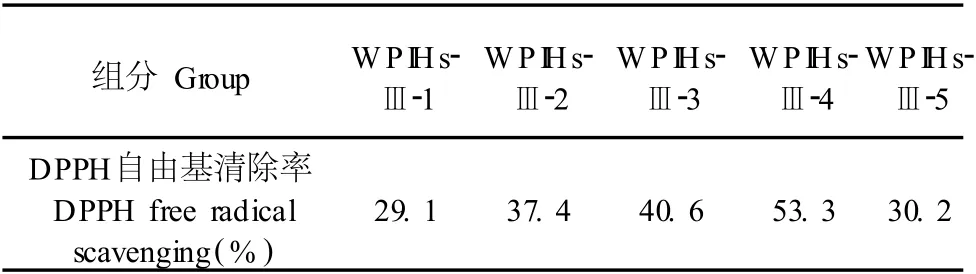
表 2 Sephadex G-15凝胶过滤层析分离得到组分的抗氧化活性Table 2 Antioxidant activity of fractions from WPIHs-Ⅲfraction
从表 2中可以看出,这 5个洗脱峰组分的 DPPH自由基清除率分别为 29.1%、37.4%、40.6%、53.3%和 30.2%,其中第 4个洗脱峰的自由基清除能力最强。WPIHs-Ⅲ-1至WPIHs-Ⅲ-5均有一定的抗氧化活性,并且按照出峰次序呈递增的趋势, WPIHs-Ⅲ-1和WPIHs-Ⅲ-2清除率较低,小于分离前的样品峰;WPI Hs-Ⅲ-4洗脱峰组分的抗氧化活性最高,相对于其它洗脱峰抗氧化活性较显著。通过比较可以发现,凝胶柱层析的分离纯化效率要比超滤高的多,虽然二者同是利用分子量大小来进行分离纯化的,但由于超滤膜的孔径存在不均一性,膜上膜下的分离比较粗糙,而柱层析系统的分离借助的是紫外检测系统,峰与峰之间的分离要精确许多。
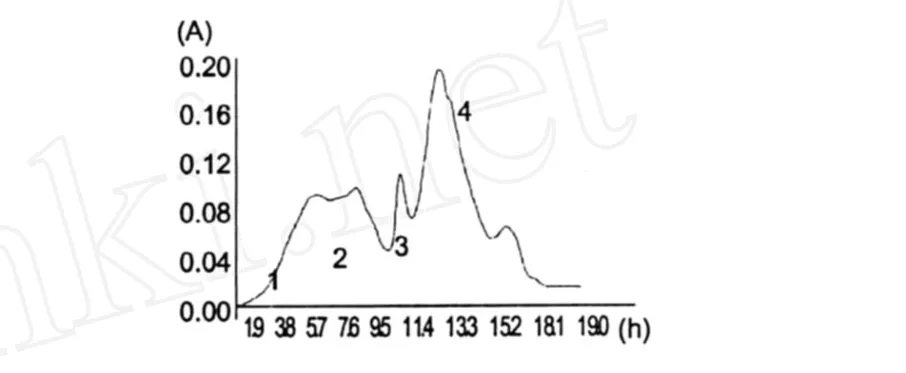
图 1 Sephadex G-15凝胶层析图谱Fig.1 Sephadex G-15 chromatogram of the fraction from WPI Hs-Ⅲ
2.1.3 RP-HPLC纯化
将待分离的洗脱峰 4组分经半制备 RP-HPLC分离后得到 6个洗脱峰 (图 2),分别收集并冷冻干燥后测定其抗氧化活性。结果如表 3所示,其中第3个洗脱峰组分的抗氧化活性最强。从梯度洗脱程序看,在此区域内采用的是降低流动相极性 (即降低流动相中水的含量)的线性梯度洗脱。

表 3 半制备RP-HPLC分离得到WPI Hs-Ⅲ-4组分的抗氧化活性Table 3 Antioxidant activity of fraction from WPIHs-Ⅲ-4 by RP-HPLC

图2 半制备型RP-HPLC图谱Fig.2 RP-HPLC chromatogram of fraction from WPI Hs-Ⅲ-4 by RP-HPLC

图3 分析型RP-HPLC图谱Fig.3 RP-HPLC chromatogram of fraction from WPI Hs-Ⅲ-4-3 by RP-HPLC
收集抗氧化活性最高峰的组分,采用分析型的RP-HPLC分离纯化后得到 1个组分(图 3)。
2.2 乳抗氧化肽的稳定性实验
在研究食品中的“功能性成分”时,非常有必要检测产品在各种环境下的稳定性,包括热稳定性、与其他组分共处时的稳定性及贮存稳定性等。其中,最重要的是其在人体内自然生理消化过程的稳定性。许多来源于食品蛋白质的生物活性肽在体内测试时就丧失了它们的生物活性,这有可能是它们在胃肠道的消化过程中被水解了而降低了它们的活性[5]。生物活性肽在体内活性的稳定性可以直接通过动物实验或者临床测试来完成。但是,通过体外实验的方法来模拟胃肠道系统的消化过程比体内实验更加方便。由于胃蛋白酶-胰酶复合酶水解模式最接近人体自然生理消化过程,于是本实验采用了此模式来检测乳抗氧化肽在体内消化的稳定性。
表 4是乳抗氧化肽经过胃蛋白酶-胰复合酶水解后的活性比较,由表中可知,乳抗氧化肽在经过胃肠道消化后活性变化不大,尤其是胃蛋白酶水解后的乳抗氧化肽在胰复合酶作用下几乎不会对抗氧化活性有影响;其次,胃蛋白酶可能酶解了部分抗氧化肽,从而影响了部分肽的活性,使其自由基清除率略有降低。

表 4 乳抗氧化肽WPIHs-Ⅲ-4-3经胃肠道酶消化后的活性Table 4 Antioxidant activity ofWPIHs-Ⅲ-4-3 before and after digestion with pepsin and pancreatin
2.3 乳抗氧化肽的结构分析
质谱法测定肽或蛋白质的序列是根据质谱中的碎片离子来推导的,质谱中出现的序列信息碎片主要是通过酰胺键 (肽键)断裂所形成 (图 4)。这些碎片还可以进一步形成脱水、脱氨的离子,但 b型和y型离子出现这种碎片的几率较大。根据 P.Roepstorf和 J.Fohlman提出的命名系统 (由 Bieman等修正)[10],N端碎片离子用英文字母 a,b,c等表示,C端离子用字母 x,y,z等表示 (图 4)。其中,y型离子的一般结构为+H2-(HNCHRCO)nOH,b型离子为 H,a型离子为 H(HNCHRCO)n-1,N=,下标代表氨基酸残基所处的位置。由于这几组碎裂峰的丰度相对较高,因此,它们是确定氨基酸序列的主要依据。

图 4 肽主链断裂及其碎片命名Fig.4 Sketch map of fragment peptide back bone and the nomenclature
目的峰的质谱鉴定结果见图 5和 6。从图 6可以看出,质谱图中大部分出现的是 b和 y系列碎片,这验证了肽链中酰胺键较容易断裂的推断,其中丰度较强的主要离子峰都可以从结构上进行解释。此外,碱性氨基酸对肽键断裂也有特殊的作用,它们的质子亲和能较高,具有使质子在肽链或碎片上定位的倾向。如果精氨酸在肽链的 N端,碎裂中倾向于产生N端离子,精氨酸在 C端则倾向于产生 C端离子[11]。由于木瓜蛋白酶水解作用的专一性较强,只断裂赖氨酸或精氨酸羧基末端参与形成的肽键,精氨酸应在肽链的 C末端。因此,质谱图中应是 y系列的离子 (图 5)。经过软件分析并标注 (图 6),可以看出在此区域内显示 H(His)、I(Ile)、R(Arg)3种氨基酸的多个相关特征离子峰,其中分别标注为H、I和 R的 3个峰所对应的是这 3种氨基酸的亚氨正离子的质荷比[12]。由于 L(Leu)与 I(Ile)的相关特征离子峰是完全相同的。因此,图 6中的离子峰是可能是 I。在得到肽段的氨基酸残基种类的信息之后,运用De Novo Explorer分析软件对这几种氨基酸排列的顺序进行分析。经过分析,我们认为这个肽组分的氨基酸序列为 H I(L)R。由于软件无法区分L(Leu)与 I(Ile)。因此,必须结合氨基酸组成分析的结果进行分析,这样可以最后确定肽段中氨基酸的种类和数量。

2.4 乳抗氧化肽的氨基酸组成分析
乳抗氧化肽的氨基酸组成分析结果表明:该肽主要由组氨酸 (His,H),异亮氨酸 (Ile,I)和精氨酸(Arg,R)组成,相对摩尔比例为 1∶1∶1,相对分子质量为 425.28 Da。
国际上通常要求相对分子质量低于 1000的物质的测定值与计算值的误差应在 5×10-6以内,根据这个肽段所得出的精确计算的相对分子质量为425.28 Da,其分子离子 [M +H]+质量则应为425.288+1.0078=426.2958。
由于MALD I-TOF-TOF-MS的分析结果精度很高,质荷比精度高达 0.0001。与 ESI-MS最重要的区别是由于能够得到有特征性的二级谱图,可以得到确定的氨基酸序列,而且方便快捷,但仪器较为昂贵。氨基酸组成分析则是对这一方法有力的佐证和必要的补充。综上所述,实验从质谱和氨基酸组成分析两方面确证抗氧化肽的氨基酸序列为 H I R (His-Ile-Arg)。
3 讨论
本研究采用不同的超滤膜对乳清分离蛋白的木瓜蛋白酶酶解物实行了分级,并对不同分子量大小的组分进行了抗氧活性检测。在各组分中,分子量小于 5 kDa的酶解物抗氧化性最强。目前已经报道的各种抗氧化肽的分子量都较小,氨基酸残基的数目一般在 20个以内。Chen等[13]从β-伴大豆球蛋白酶解物中分离到的 6种抗氧化肽,它们是由 5-16个氨基酸残基构成;Se-Kwon等[14]在分步酶解阿拉斯加鳍鱼皮制备抗氧化肽时,酶解到第 2步得到的抗氧化肽其分子量在 1.5~4.5 kDa的范围;沈蓓英[15]利用酸性蛋白酶AP水解大豆分离蛋白得到了分子量约 0.7 kDa的抗氧化肽;刘大川[16]利用碱性蛋白酶 2709水解大豆分离蛋白得到了分子量在 2 kDa以下的抗氧化肽。Niranjan Rajapakse等[17]将鱿鱼肉酶解液根据分子量的不同分为 10 kDa以上、5~10 kDa,3~5 kDa和 3 kDa以下四个部分,它们在亚油酸体系中对 7天后亚油酸的抗氧化率分别为18.27%,23.32%,48.45%和 67.39%,这些抗氧化肽的分子量大小与本试验结果相近。实验中采用C18柱,进行线性梯度洗脱,成功的将凝胶过滤层析后的组分进行了分离,获得了相对较纯的抗氧化肽。
蛋白质和多肽氨基酸序列测定的传统方法是以DNA顺序分析和 Edman降解为基础的测序方法,即N端测序法。DNA顺序测定解决不了翻译后加工所导致的氨基酸残基的修饰的问题,N端测序法的缺点是不能测定 N端修饰的蛋白质或多肽[18]。除非经过脱修饰反应,使 N端的氨基酸释放出来。而且对于小的肽段,Edman降解法常常不能测定全序列,可能是由于小肽在支持剂上不能牢固地吸附的原因。近年来,生物质谱的发展,尤其是纳升电喷四极杆-飞行时间串联质谱 (Nano-ESI-Q-TOF electrspectrometry ionization-quadrupole-time of flight)的出现为蛋白质及多肽的测序开辟了一个新天地,成为鉴定微量蛋白质及蛋白质翻译后修饰的有力工具[19-23]。电喷雾质谱是根据肽段经惰性气体碰撞而诱导裂解产生的一系列有规律的碎片离子之间的质量差来推断氨基酸序列。纳升电喷雾串联质谱就是在四极杆-飞行时间串联质谱 (Q-TOF)上配备一个纳升喷雾源,该方法使蛋白质及多肽的测序不再受翻译后修饰及纯度的限制,与常用的三、四级电喷雾串联质谱或离子阱电喷雾串联质谱比较,四级杆-飞行时间电喷雾串联质谱 (Q-TOF-ESI-MS/MS)具有更高的分辨率、灵敏度和质量准确度,更适合蛋白质及多肽测序,测定结果准确可靠。本研究采用纳升电喷雾-四极杆-飞行时间串联质谱技术对乳清分离蛋白酶解物中分离获得的肽段的结构进行了鉴定。
4 结论
4.1 采用超滤膜对乳清分离蛋白酶解物进行超滤处理,分子量在 5 kDa以下的乳清分离蛋白酶解物对DPPH自由基率的清除率最高。
4.2 采用 Sephadex G-15凝胶过滤层析法对低分子量酶解物进行了分离,20 mM的醋酸-醋酸钠缓冲液进行洗脱,收集DPPH自由基清除能力最强的洗脱峰。样品冻干后,采用 RP-HPLC继续纯化,得到抗氧化活性最强的洗脱峰。MALD I-TOF-TOF-MS及氨基酸组成结果分析表明抗氧化活性强的组分中的肽为 His-Ile-Arg。
1 Liu H(刘慧),Feng ZB(冯志彪).Advance of antioxidative peptides.Far m Prod Proc(农产品加工),2009,7:64-67.
2 Zhang H(张昊),Ren FZ(任发政).Research advance of natural antioxidant peptides.Food Sci(食品科学 ),2008, 29:443-447.
3 Guo BH(郭本恒).Dairy Chemistry(乳品化学).Beijing: China Light Industry Press,2001,158-183.
4 Caessens PW,Visser S.β-lactoglobulin hydrolysis.Peptide composition and functional properties of hydrolysates obtained by the action of plas min,trypsin,and Staphylococcus aureus V8 protease.J Agric Food Chem,1999,47:2973-2979.
5 Jiang ping W,Xiaolin D.Characterization of inhibition and stability of soy protein derived angiotensin I converting enzyme inhibitory peptides.Food Res Int,2002,(35):367-375.
6 Elisabeth K,Florence R,Ida DY,et al.Fractionation at pilotplant scale of an haemoglobin hydrolysate by strong anionic exchange chromatography:application to the preparation of an amphiphilic peptide.J Chem Technol B iotechnol,1998,71: 35-42.
7 Liu ZD(刘志东),Guo BH(郭本恒),Wang YY(王荫榆),et al.Antioxidant activity of the hydrolysates ofwhey protein isolates.Nat Prod Res Dev(天然产物研究与开发),2007, 3:477-480.
8 Liu ZD(刘志东),Wang YY(王荫榆),Guo BH(郭本恒),et al.Methods to deter mine antioxidative activity.Nat Prod Res Dev(天然产物研究与开发),2008,3:563-567.
9 Roufik S,Gauthier SF,Sylvie LT.In vitrodigestibility of bioactive peptides derived from bovineβ-lactoglobulin.IntDairy J,2006,16:294-302.
10 Biemann K.Mass spectrometry of peptides and proteins.Ann Rev B iochem,1992,61:977-1010.
11 Chen J(陈晶),Fu H(付华),Chen Y(陈益).Application ofmass spectrometry on the sequencing of peptides and proteins.Chin J organic Chem(有机化学),2002,22(2):81-90.
12 Purcell AW,Zhao GL,Aguilar M I,et al.Chrom atographia, 1999,852(1):43.
13 Chen HM,KajiMuramoto,Fumio Yamauchi,et al.Structural analysis of antioxidative peptides from soybeanβ-congiycinin.J Agric Food Chem,1995,43:574-578.
14 Kim SK,Kim YT,Byun HG,et al.Isolation and characterization of antioxidative peptides from gelatin hydrolysate of Alaska Pollack skin.J Agric Food Chem,2001,49:1984-1989.
15 Shen PY(沈蓓英).Study on the antioxidantive peptide derived soybean protein.China O ils and Fats(中国油脂), 1996,21(6):21-24.
16 Liu DC(刘大川),Zhong FX(钟方旭).Study on functional properties of soybean peptides.China O ils and Fats(中国油脂),1998,23(3):9-1.
17 Niranjan R,EreshaM,Hee GB,et al.Purification andin vitroantioxidative effects of giant squid muscle peptides on free radical mediated oxidative systems.J Nutr B iochem,2005, 16:562-569.
18 Yu H,YiLS.Purification and partialpeptide sequence analysis of the boar32 kDa sperminogen.M ol Cells,2001,12:107-111.
19 Peng JM,Gygi ST.Proteomics:the move to mixtures.J M ass Spectrom,2001,36:1083-1091.
20 Nemeth-Cawley JF,Kamik S,Rouse JC.Analysis of sulfated peptides using positive electrospray ionization tandem mass spectrometry.J M ass Spetrom,2001,36:1301-1311.
21 Yan JX,Walt R,Berkelman T,et al.A modified silver staining protocol for visalization of proteins compatible with matrix-assisted laser desorption/ionization and electrospray ionization mass spectrometry.Elctrophoresis,2000,21:3666-3672.
22 Chen HM,Muramoto K,Yamauchi F,et al.Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein.J Agric Food Chem,1996,44:2126-2130.
23 Moos mann B,Behl C.Secretory peptide hor mones are biochemical antioxidants:structure-activity relationship.M ol Phar macol,2002,61:68-76.
Isolation and Identification of Antioxidative Peptide Derived from M ilk Protein
L IU Zhi-dong1,2,GUO Ben-heng2*,WANG Yin-yu2,L I Yun-fei3,L IU Zhen-min2
1School of Life Sciences and B iotechnology,Shanghai Jiaotong University,Shanghai 200240,China;2State Key Laboratory of Dairy B iotechnology,Technical Center,B right Dairy Co.L td,Shanghai 200436,China;3School of Agriculture and B iology,Shanghai Jiaotong University,Shanghai 200240,China
The evaluation of antioxidative activity ofWPI(whey protein isolates)hydrolysates showed that the fraction with molecularweight below 5 kDa possessed the highest antioxidative activity.The most active fraction was obtained by gel filtration chromatography,and further separated by RP-HPLC.The purified peptide was determined to be His-Ile-Arg byMALD I-TOF-MS and amino acid analysis.
WPI;antioxidative peptide;isolation and purification;sequence of peptide
TS252.7
A
1001-6880(2010)05-0740-07
2009-10-26 接受日期:2010-02-04
“十一五”国家科技支撑计划(2006BAD04A14, 2006BAD04A06);“863”国家计划项目(2007AA10Z353)
*通讯作者 Tel:86-532-88963253;E-mail:zdliu1976@163.com