帽蕊木α-葡萄糖苷酶抑制活性研究
2010-09-15康文艺宋艳丽
康文艺,宋艳丽,张 丽
河南大学中药研究所,开封 475004
帽蕊木α-葡萄糖苷酶抑制活性研究
康文艺*,宋艳丽,张 丽
河南大学中药研究所,开封 475004
利用体外抑制α-葡萄糖苷酶模型,首次对植物帽蕊木叶、皮提取物和从中分离得到的化合物进行活性评价,并与阳性对照Acarbose进行比较。结果表明帽蕊木叶和皮提取物都具有很高抑制α-葡萄糖苷酶活性,且叶的活性要好于皮,同一部位的正丁醇和乙酸乙酯提取物的活性要好于石油醚提取物;从帽蕊木中得到的化合物莨菪内酯 (scopletin)的α-葡萄糖苷酶抑制活性 (I C50=35.03μg/mL)高于阳性对照 Acarbose(IC50=1081.27 μg/mL)约为其活性的 30倍。
帽蕊木;α-葡萄糖苷酶;抑制活性
帽蕊木 (M itragyna rotundifoliaKuntze.)为茜草科帽蕊木属植物。本属植物约有 10种,非洲分布 4种,亚洲 6种,分布在印度,孟加拉,缅甸,泰国和老挝等国家[1-3]。我国仅有 1种,产于云南南部[4,5]。该属的植物民间用途广泛,可用于发热、疝气、肌肉疼痛的治疗[6,7],抗疟[8],并可以驱虫[9]。文献研究表明,帽蕊木属植物化学研究主要集中在吲哚类生物碱成分上[10,11],药理研究也非常明确,主要集中在抗肿瘤、心血管疾病和抗菌活性。
α-葡萄糖苷酶抑制剂可竞争性抑制小肠内α-葡萄糖苷酶的活性,延缓或抑制葡萄糖在肠道的吸收,从而有效降低餐后高血糖。由于其独特的优势,目前已被广泛用于糖尿病及其并发症的防治,临床上主要使用阿卡波糖和伏格列波糖等。作者在对产于云南西双版纳的帽蕊木进行系列研究中[12-16],共得到 28个化合物。本文利用体外抑制α-葡萄糖苷酶模型,首次对帽蕊木提取物及其从中得到的 28个化合物进行α-葡萄糖苷酶活性筛选,发现莨菪内酯(scopletin)具有较好的抑制α-葡萄糖苷酶活性。
1 试剂与仪器
1.1 试剂
α-葡萄糖苷酶 (α-glucosidase,EC 3.2.1.20);4-硝基苯-α-D-吡喃葡萄糖苷 (4-N-trophenyl-α-D-glucopyranoside,PNPG,026K1516);阿卡波糖 (Acarbose,Lot 16869)和 DMSO均购自 Sigma公司;帽蕊木于 2006年 10月采集于云南西双版纳地区,经中国科学院西双版纳植物园崔景云高级工程师鉴定为茜草科帽蕊木属植物帽蕊木M.rotundifoliaKuntze,标本存于河南大学天然药物研究所 (No.0610221)。
1.2 仪器
MultiskanMK3酶标仪 (Ther mo Electron);LRH-150恒温培养箱 (上海一恒科技有限公司);DELTA 320型 PH计 (Mettler-Toledo);电子天平 (Mettler-Toledo)。
2 方法
2.1 提取物制备
帽蕊木茎皮和叶干燥,粉碎后,分别用 V(丙酮)∶V(水)=7∶3室温下冷浸 3次,每次 7 d。回收试剂后分别得到帽蕊木茎皮浸膏和叶浸膏。分别将浸膏悬浮于水中,依次向悬浮液中加入石油醚、乙酸乙酯和正丁醇,振摇萃取。萃取液真空减压干燥,分别得到帽蕊木皮和叶石油醚、乙酸乙酯和正丁醇提取物。
2.2 α-葡萄糖苷酶活性成分的筛选方法
2.2.1 检测方法
在 96孔板上进行,反应体系参照张丽建立[17]的方法,按照 I%=[1-(OD样品-OD样空)/(OD阴性-OD空白)]×100%计算抑制率,并用Origin软件求出相应 IC50值。
2.2.2 标准曲线制作
根据采用的反应体系,用磷酸缓冲液 (pH 6.8)配置 1000μmol/L PNP,稀释成 400、300、200、150、100、50、25、5和 0μmol/L。分别取 9种不同浓度的PNP溶液各160μL,加入0.2 mol/L Na2CO3溶液80 μL,混匀,在 405 nm下测定 OD值,测三组取平均值。以OD值为纵坐标,对硝基苯酚浓度为横坐标,做出标准曲线。
2.2.3 α-葡萄糖苷酶活力的测定
根据所采用的反应体系:112μL磷酸钾缓冲液(pH 6.8),加入 20μL 0.2 U/mLα-糖苷酶,8μL DMSO,37℃恒温 15 min后加入 2.5 mmol/L PNPG 20μL,37℃恒温反应 15 min。再加入 80μL 0.2 mol/L的Na2CO3溶液,于 405 nm波长下测OD值。
酶活力单位定义:37℃、pH 6.8条件下,每分钟水解底物所产生 1μmol对硝基苯酚的酶量,规定为一个酶活力单位 (U)[17]。
3 结果与讨论
3.1 提取物活性的比较分析
表 1显示,同一浓度下,帽蕊木不同溶剂提取物α-葡萄糖苷酶抑制活性从大到小依次为:帽蕊木叶正丁醇提取物 >帽蕊木皮正丁醇提取物 >帽蕊木叶乙酸乙酯提取物 >帽蕊木皮乙酸乙酯提取物 >帽蕊木皮石油醚提取物 >Acarbose>帽蕊木叶正丁醇提取物。而从帽蕊木皮中得到的化合物 Scopletin在浓度为 100μg/mL时,对α-葡萄糖糖苷酶的抑制率已达到 81.59%。
由以上初筛抑制率为指导,对帽蕊木提取物进行复筛,发现:帽蕊木提取物中,叶抑制α-葡萄糖糖苷酶活性最高,乙酸乙酯和正丁醇提取物的 I C50值分别为 34.46μg/mL和 6.023μg/mL,远远高于阳性对照 acarbose(IC50=1081.27μg/mL);帽蕊木皮也具有很高的抑制α-葡萄糖糖苷酶活性,石油醚、乙酸乙酯、正丁醇提取物 (IC50值分别为 260.98、68.82、18.69μg/mL)都高于阳性对照 acarbose。
由此可见帽蕊木不同部位虽都具有很高的α-葡萄糖糖苷酶抑制活性,但抑制活性有所差别,叶的活性要好于皮。
另外,帽蕊木同一部位不同溶剂提取物相比较,乙酸乙酯和正丁醇提取物的活性高于石油醚提取物。说明帽蕊木的α-葡萄糖苷酶抑制活性不仅与部位有关,还与提取物极性密切相关。从帽蕊木中得到的化合物 scopletin具有很强的抑制α-葡萄糖苷酶活性 (I C50=35.03μg/mL),其对α-葡萄糖苷酶的半数抑制浓度比阳性对照 acarbose约小 30倍。
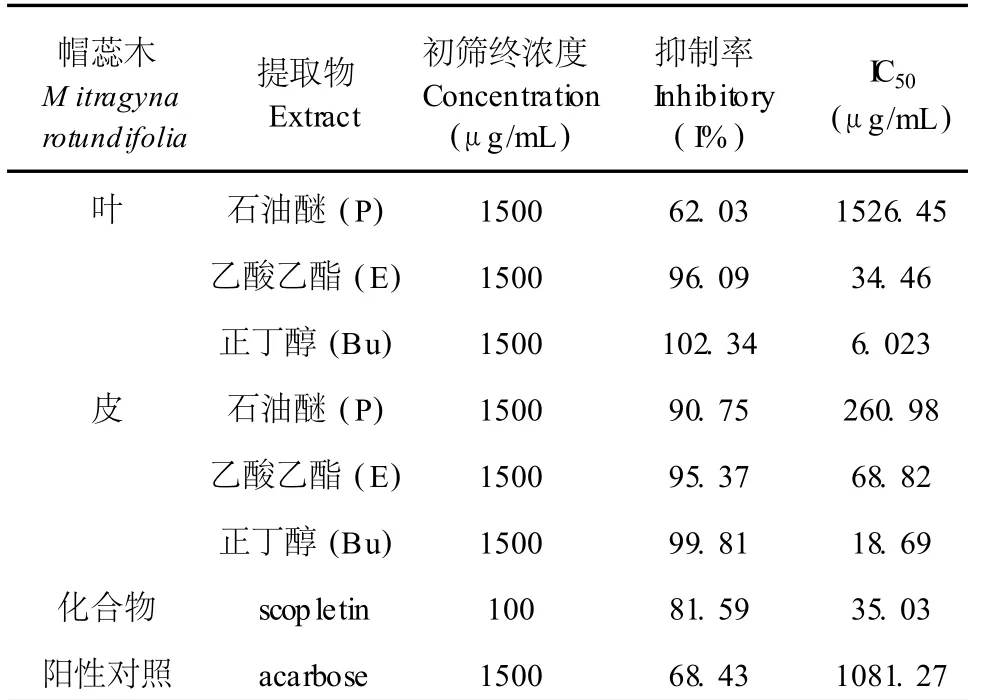
表 1 不同提取物的α-葡萄糖苷酶抑制活性Table 1 The inhibitory activity of extracts ofα-glucosidase
3.2 样品浓度对α-葡萄糖糖苷酶抑制活性的影响
图 1显示,在试验浓度范围内,帽蕊木不同部位不同溶剂提取物及从中分离得到的化合物 scopletin的α-葡萄糖苷酶抑制活性均呈剂量依赖性,而且,当抑制率达到一定程度时,再增加提取物质量浓度,抑制活性不再提高。
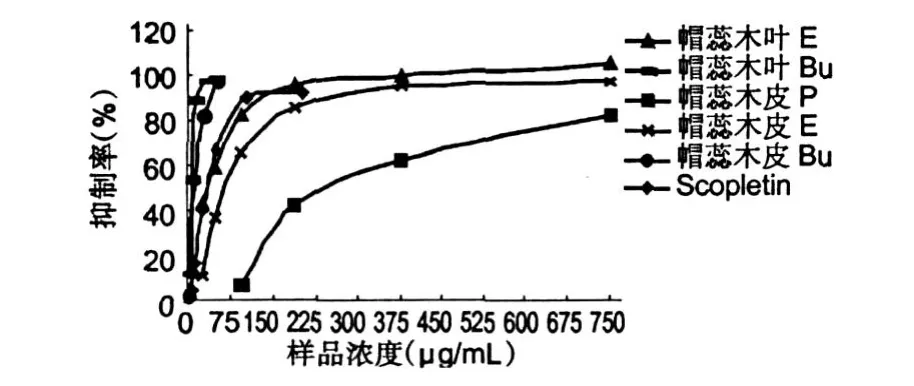
图 1 样品浓度对α-葡萄糖苷酶活性的影响Fig.1 Effect of sample concentration on the activity ofαglucosidase
3.3 化合物 scopletin抑制类型的确定
化合物 scopletin取合适的两个不同浓度,PNPG取 5个不同浓度,分别测定反应速度。按 Lineweave-Burk作图法,以 1/[S]为横坐标 1/V为纵坐标,分别绘制化合物的抑制作用动力学曲线 (图 2),得到α-葡萄糖糖苷酶的Km值为 2.89 mmol/L。
图中可以看出,化合物 scopletin对α-葡萄糖苷酶抑制作用属非竞争性抑制,反应速度Vmax随着受试化合物浓度的增大而变小,米氏常数Km保持不变。根据非竞争性抑制动力学方程[18,19]:1/V′max= 1/Vmax(1+[I]/Ki),可以求出化合物 Scopletin的Ki值分别为:2.44μg/mL。
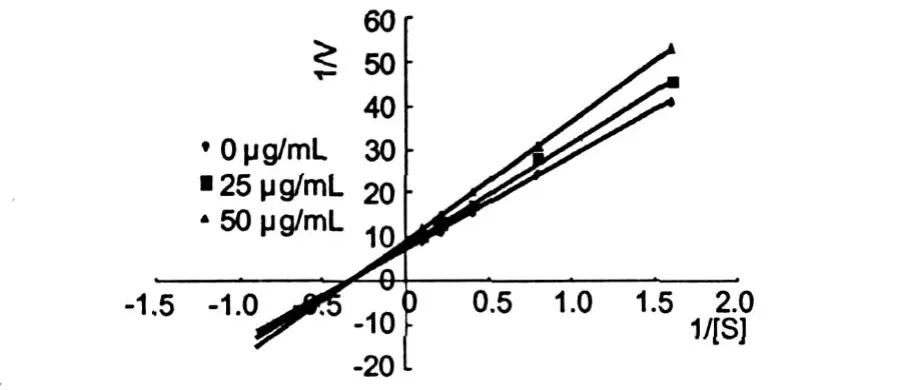
图 2 化合物 scopletin的 Lineweave-Burk双倒数曲线Fig.2 The Lineweave-Burk of scopletin on the activity of α-glucosidase
4 结论
4.1 本文首次利用体外α-葡萄糖苷酶抑制活性筛选模型对帽蕊木不同部位不同溶剂提取物的α-葡萄糖苷酶抑制活性进行了考察,结果表明帽蕊木叶和皮都具有很好的活性,且叶的活性好于皮。
4.2 化合物 scopletin具有很强的α-葡萄糖苷酶抑制活性 (I C50=35.03μg/mL),其对α-葡萄糖苷酶的半数抑制浓度比阳性对照 acarbose约小 30倍,以期开发为天然的α-葡萄糖苷酶抑制剂。
4.3 化合物 scopletin对α-葡萄糖苷酶抑制作用属于非竞争性抑制类型,说明它既可以和酶,也可以和酶-底物复合物结合,从而降低酶活性,达到降低血糖作用。
1 Shellard EJ,Hougton PJ,Masechaba R.TheM itragynaspecies ofAsia part XXXII.Planta M ed,1978,34:253.
2 Shellard EJ,BecketAH,Payom T,et al.TheM itragynaspecies ofAsia partV III.Planta M ed,1967,15:245.
3 Shellard EJ,Houghton PJ.TheM itragynaspecies of Asia part XXV II.Planta M ed,1974,25:172.
4 Hou KZ(候宽昭).A Dictionary of the Families and Genera of Chinese Seed Plants(中国种子植物科属词典).Beijing:Science Press,1982.313.
5 Chinese Academy of Sciencer Chinese flora writers(中国科学院中国植物志编辑委员会).Chinese Flora(中国植物志).Beijing:Science and Technology Press,1999,71:245.
6 Chittrakarn S,Sawangjaroen K,Prasettho S,et al.Inhibitory effects of kratom leaf extract(M itragyna speciosaKorth.)on the rat gastrointestinal tract.J Ethnophar macol,2008,116 (28):173-178.
7 Pandey R,Singh SC,GuptaMM.Involvement ofμ-opioid receptors in antinociception and inhibition of gastrointestinal transit induced by 7-hydroxymitragynine,isolated from Thai herbal medicineM itragyna speciosaHeteroyoh imbinoid type oxindole alkaloids fromM itragyna parvifolia.Phytochem istry, 2006,67:2164-2169.
8 Adjétey TAK,DjèMK,Vangah-Manda M,et al.Antimalarial activity ofM itragyna ciliata(Aubrev and Pellegr)(Rubiaceae):Preliminary study.South Afr J Bot,2007,73:226-229.
9 Shellard EJ,Phillipson JD.The mitragyna species of Asia. Part I.The alkaloids of the leaves ofM itragyna rotundifolia(Roxb.)O.Kuntze.Planta M ed,1964,12:27-32.
10 KitajimaM,Nakayama T,Kogure N,et al.New heteroyohimbine-type oxindole Alkaloid from the leaves of ThaiM itragyna hirsuta.J NatM edicines,2007,61:192-195.
11 KitajimaM,Misawa K,Kogure N,et al.A new indole alkaloid,7-hydroxyspeciociliatine,from the fruits of MalaysianM itragyna speciosaand its opioid agonistic activity.J Nat M edicines,2006,60:28-35.
12 KangWY(康文艺),Zhang BR(张百让),et al.Study on the chemical constituents ofM itragyna rotundifoli.J Chin M ed M ater(中药材),2006,29:557-560.
13 KangWY,Hao XJ.Triterpenoid saponins fromM itragyna rotundifolia.B iochem Syst Ecol,2006,34:585-587.
14 KangWY(康文艺),Shi YY(石渊渊),Hao XJ(郝小江). Quinovic acid triterpenoid saponins from bark ofM itragyna rotundifolia.China J Chin M ater M ed(中国中药杂志 ), 2007,32:2015-2018.
15 He GD(贺光东),Yu HP(于海平),et al.Deter mination of catechin in the stem bark ofM itragyna rotundifoliaKuntze. by HPLC.Fine Chem(精细化工),2008,25:1198-1200.
16 Song YL(宋艳丽),KangWY(康文艺).Antioxidant activity ofM itragyna rotundifolia.Fine Chem icals(精细化工 ), 2009,26(2):150-152.
17 ZhangL(张丽),Li XM(李晓梅),et al.Inhibition of alphaglucoside ofErigeron canadensisL.,J Henan Univ,M ed Sci(河南大学学报医学版),2008,27(4):39-41.
18 Wang JY(王镜岩),Zhu SG(朱圣庚).B iochem istry(生物化学).Beijing:Higher Education Press,2002.371.
19 Ma QY(马庆一),Chen LH(陈丽华),Yang HY(杨海延),et al.Screeningofα-glucosidase inhibitors fromCoruns officinalis(Ⅱ).FoodSci(食品科学),2007,28(2):73.
Inhibition ofα-Glucoside ofM itragyna rotundifoliaKuntze.
KANGWen-yi*,SONG Yan-li,ZHANGLi
Institute of ChineseM ateria M edica,Henan University,Kaifeng 475004,China
The inhibitory activities ofα-glucosidase of leaves,barks extracts and compounds fromM itragyna rotundifoliaKuntze.were screenedin vitrofor the first t ime,and the results were compared with acarbose.The results showed that leaves and barks extracts fromM.rotundifoliaall had inhibitory activity ofα-glucosidase,and the activity of leaveswas higher than thatof barks.Then-butanol extract and ethyl acetate extract from the same partofM.rotundifoliahad higher inhibitory activity ofα-glucosidase than thatof the petroleum ether extract.The compound of scopletin had higher inhibitory activity ofα-glucosidase(I C50=35.03μg/mL),and the value of I C50was lowered about thirty times than that of positive control acarbose.
M itragyna rotundifoliaKuntze.;α-glucosidase;inhibitory activity
Q946.81;R285
A
1001-6880(2010)04-0658-04
2008-09-04 接受日期:2008-10-23
河南省教育厅基础研究计划(2008A360002)
*通讯作者 Tel:86-378-3880680;E-mail:kangweny@hotmail.com
